高效降解海带芽孢杆菌菌株的筛选及活性成分检测
2019-10-23张晶晶解学仕周丽李燕王婷
张晶晶,解学仕,周丽,李燕,王婷,*
(1.齐鲁工业大学(山东省科学院)山东省微生物重点实验室,山东济南250353;2.史丹利农业集团股份有限公司,山东临沂276700;3.山东福瑞达生物工程有限公司,山东济南250353)
在亚洲国家的沿海地区,海藻作为传统食物已被消费了几个世纪,且各种可食用海藻现已越来越多地被用作全球潜在工业应用的成分来源[1]。海藻种类繁多,资源丰富,是重要的海洋资源。在我国,海藻主要以海带为主。海带又名昆布、纶布,常作为食品和中药原料,在《本草纲目》、《神农本草位》、《食用本草》及《中国中草药汇编》中均有记载。海带不仅含有丰富的蛋白质、维生素和矿物质,还含有如褐藻酸、褐藻糖胶、褐藻淀粉、海带多酚、褐藻纤维、甘露醇、高不饱和脂肪酸、岩藻黄质和甾醇类化合物等丰富的生理活性物质[2]。海藻多糖主要包括褐藻胶、褐藻糖胶和褐藻淀粉。作为主要成分的褐藻糖胶已被报道具有的作用包括免疫调节、抗肿瘤、抗病毒、抗菌消炎、抗氧化、抗凝脂、降血糖等[3],其中因褐藻糖胶仅占4%含量就可以阻止癌细胞生长,并引起肿瘤细胞凋亡而引起人们广泛关注。研究表明,褐藻糖胶抑制了肝癌细胞QGY7703进入对数生长期,从而遏制了肿瘤的增长,褐藻糖胶对Hepes 的抑瘤率可超过50%,且不影响小鼠的正常生长,从而表现出比阳性药物的优越性[4]。海藻多酚是一大类结构不同的化合物,具有多种生物活性,目前对海藻多酚抗肿瘤活性、抗菌抗病毒活性、抗氧化活性研究较多。其中,鼠尾藻中褐藻多酚对人肝癌细胞株BEL-7402 和人肺癌细胞株A-549 具有较强的抗肿瘤作用,最佳抑制浓度在0.085 mg/L~0.10 mg/L 左右;小黏膜藻粗提物对KB 癌细胞、HT-29 癌细胞具有选择性细胞毒活性,对正常细胞NIH-3T3 基本上不具有毒性[5]。海藻酸盐是海藻酸与 Na+、Ca2+、Mg2+结合的线性多糖,有两个差向异构体组成:β-D-甘露糖醛酸和α-L-古洛糖醛酸[6]。藻酸盐由于其胶凝、乳化及成膜特性在食品,药物和医药工业中具有应用价值[7]。另外,低分子量的海藻酸盐具有抗氧化的潜在价值,可增强生物活性[8]。
然而,目前我国海带的开发主要集中于海带食品、海藻(带)肥料和碘、海藻酸、甘露醇等化工原料的提取,海带中活性成分的提取开发也是只针对一种或一类。例如传统海带多糖的提取方法包括热水提取法、酶提取法、碱提取法,而这些提取方法都存在一定的缺陷。热水提取的方法采用的温度是70 ℃~80 ℃,耗能多,提取时间长。酶提取的方法提取的时间长,工业生产需要使用的酶量大,不经济。碱提取法是现在工业提取海带多糖的主要方法,但是碱提取方法会造成多糖生物活性的降低。因此,开发一种绿色、高效、环保、全面的提取技术势在必行。经文献调研,芽孢菌酶系丰富,具有较强的蛋白酶、淀粉酶和脂肪酶活性,同时还具有降解非淀粉多糖的酶,如果胶酶、葡聚糖酶、纤维素等酶,适用于海带降解。本研究以天然新鲜海带为原料,以芽孢杆菌为出发菌株,以海带发酵黏度、海藻多糖、岩藻糖、海藻酸等海带活性成分为检测对象,对能够高效降解海带并释放活性成分的菌株进行筛选,为海带中活性成分的综合提取及利用奠定坚实基础。
1 材料与方法
1.1 材料与试剂
原料:菌株筛选所用新鲜海带采自渤海湾(山东荣成),发酵用海带干粉为上述新鲜海带经自来水洗净表面泥沙,于55 ℃下干燥48 h,经超微粉碎机粉化后杀菌并储存。
种子培养基[9],发酵培养基[9],海带液体培养基[10],LB 固体培养基(除海带外培养基原料均为分析纯):国药集团化学试剂有限公司。
L-半胱氨酸、无水乙醇、氯化钙、盐酸、苯酚(均为分析纯):国药集团化学试剂有限公司;L-岩藻糖:Sigma 公司;细菌基因组提取试剂盒:南京诺唯赞公司;DNA 测序:华大基因。
1.2 仪器与设备
LDZX-50KBS 灭菌锅:上海申安医疗器械厂;E-clipse E200 显微镜:尼康公司;FE20 pH 计:梅特勒-托利多仪器有限公司;CW5-100QA 超微粉碎机:烟台慧宝设备制造有限公司;SNB-4 数字黏度计:上海精科仪器有限公司;RS232-C 分光光度计:上海元析仪器有限公司;KQ2200B 超声提取器:昆山市超声仪器有限公司;HB-100 金属浴:杭州博日科技有限公司;TProfessional Thermocycler PCR 仪:德国 Biometra 公司;Centrifuge5804R 离心机:德国艾本德公司;Z216M离心机:德国赫姆勒公司。
1.3 方法
1.3.1 菌种筛选
将新鲜海带加入无菌水中,振荡培养20 min,取5 mL 水样加入45 mL 种子培养基,80 ℃处理20 min后 200 r/min 培养 24 h,稀释 104、105、106倍,平板划线培养,分离纯化后镜检。挑取典型菌落接种于海带培养基,同时设置空白组(未加海带干粉)和对照组(未加菌种)。37 ℃振荡培育24 h,分别检测发酵海带黏度,使海带黏度明显增加的菌株为目的菌株。菌株纯化后储存在30%甘油中于-80 ℃保存。
1.3.2 海带降解及产物制备
将筛选得到菌株接种至种子培养基中培养至指数期,试验组(接种量2%)、对照组(接种量为0)分别将种子液转接至添加5%海带干粉的发酵培养基中,37 ℃振荡培育 24 h。将发酵样品 4 ℃,10 000 r/min 离心10 min。取其上清液,待测。
1.3.3 海带发酵液中多糖含量的检测
采用SNT 4260-2015《出口植物源食品中粗多糖的测定苯酚-硫酸法》[11]检测发酵液上清中的多糖含量。
吸取样品200 μL 于50 mL 离心管内,提取多糖。提取结束后,4 000 r/min 离心10 min 后弃去上清液。用水将洗涤、离心后得到的不溶物转移入圆底烧瓶,超声提取 30 min,重复 2 次。冷却至室温(约 25 ℃),过滤,将上清液转移至200 mL 容量瓶中,残渣洗涤2 次~3 次,洗涤液转至容量瓶,加水定容。此溶液为样品测定液。
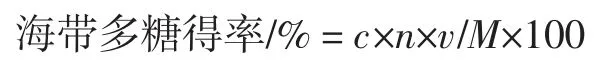
式中:c 为标准曲线对应的多糖含量,mg/mL;n 为稀释倍数;v 为培养基体积,mL;M 为培养基中海带干粉质量,g。
1.3.4 海带发酵液中岩藻糖含量的检测
采用改良Gibbons 比色法[12]检测岩藻糖。
标准曲线的制备:配置岩藻糖标准液,将20 mg 岩藻糖标准品加少量水溶解,溶液转移至100 mL 容量瓶中。梯度配置配成1 mL 溶液置于比色管中,每个梯度3 个平行样,冰水浴中加入 4.5 mL(体积比 6 ∶1)浓硫酸,摇匀。1 min 后,在沸水浴中准确加热10 min,迅速冷制室温(25 ℃左右),向每个管中加入100 μL 3%L-半胱氨酸,摇匀,静置 90 min,分别在 396、427 nm 下测定吸光度。以吸光度值差为纵坐标,以样品量为横坐标,绘制标准曲线。样品检测以合适稀释浓度样品液1 mL 代替1 mL 岩藻糖溶液进行检测。
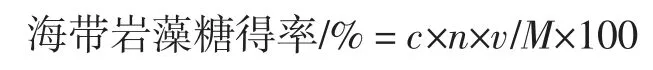
式中:c 为标准曲线对应的岩藻糖含量,mg/mL;n为稀释倍数;v 为培养基体积,mL;M 为培养基中海带干粉质量,g。
1.3.5 海带发酵液中海藻酸含量的检测
采用钙凝-酸化法[13]检测海藻酸含量。
向上清中加入4%的氯化钙(氯化钙用少量水溶解),搅拌状态下逐滴加入,抽滤得沉淀为海藻酸钙。向沉淀中加入等质量的水,搅拌均匀后,加入与氯化钙等质量的盐酸,抽滤,用50%的乙醇将沉淀冲洗两遍,于烘箱中60 ℃过夜烘干至恒重,称量烘干至恒重滤纸质量为M1,称量滤纸及沉淀质量M2,M2-M1即为海藻酸的质量。
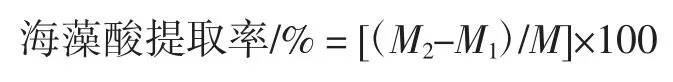
式中:M2为烘干至恒重的滤纸和海藻酸质量,g;M1为烘干至恒重的滤纸质量,g;M 为添加海带干粉质量,g。
1.3.6 菌种鉴定及进化树构建
经细菌试剂盒提取基因组,以提取所得DNA 为模板,利用细菌16SrDNA 通用引物27F(AGAGTTTGATCCTGGCTCAG)和 1492R(ACGGCTACCTTGTTACGACTT)扩增16s 序列,扩增后产物进行琼脂糖凝胶电泳检测,回收目的条带送至华大基因测序。进化树构建:在美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)采用基本局部比对搜索工具(basic local alignment search tool,BLAST)搜索与目的菌株序列同源性高的序列,经MEGA 6.0 构建系统发育树。
1.3.7 统计分析
所有试验重复3 次,结果表示为平均值±标准偏差(standard deviation,SD)。 使用 SPSS 软件对数据进行方差分析(ANOVA)并使用绘制各菌株发酵后生物活性成分含量柱状图以显示不同菌株对海带的降解能力差异,筛选出特色益生菌株。
2 结果与讨论
2.1 菌种筛选
经富集初筛和划线纯化,获得20 株芽孢菌,后经黏度检测筛选,获得12 株对海带有明显降解效果的典型芽孢菌,海带培养物的黏度及对应菌株形态描述详见表1 和表2,菌落形态及细胞形态分别见图1 和图2。以此为出发菌株对海带进行发酵降解和活性成分检测。
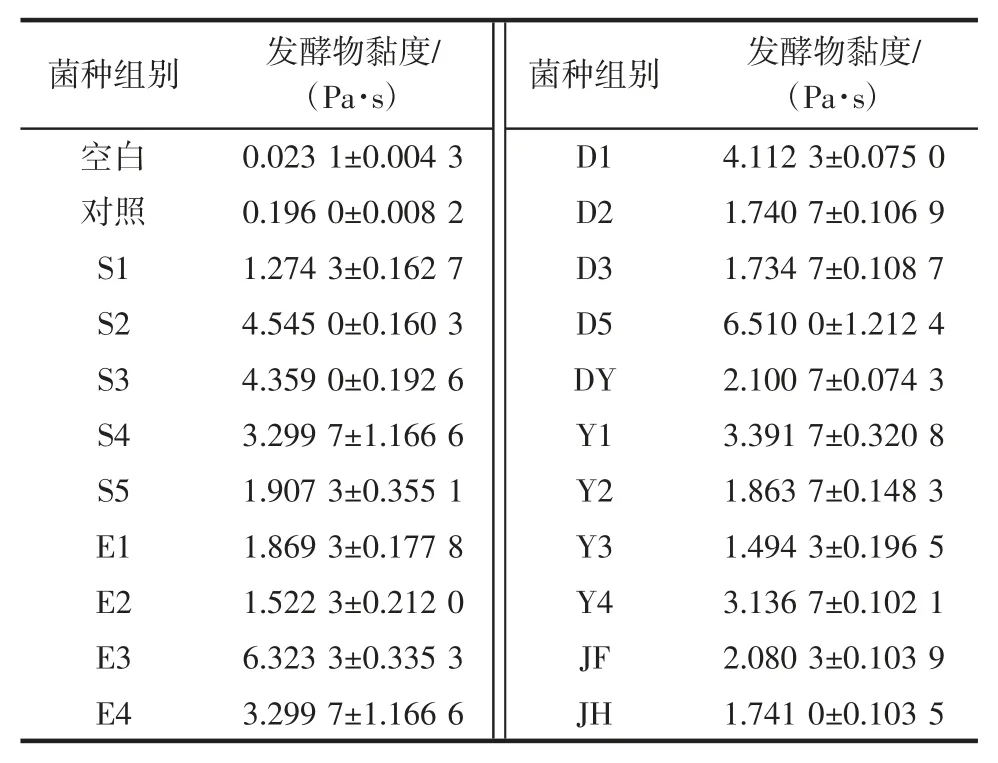
表1 初筛获得20 株芽孢菌发酵海带的黏度Table 1 Viscosity of Laminaria japonica fermented by 20 strains preliminary sreening

表2 12 株芽孢菌菌落及细胞形态描述Table 2 Colony and cell morphology description of 12 strains of Bacillus
图1 12 株芽孢菌菌落形态Fig.1 Colony morphology of 12 strains of Bacillus
2.2 海带发酵液中多糖含量的检测对比
采用苯酚硫酸法绘制多糖标准曲线:y=12.03x-0.051 6 R2=0.998 9。基于此曲线计算经不同来源菌株发酵后海带多糖含量如图3 所示。
结果表明获得的不同来源菌种均可在发酵过程中增加发酵液中褐藻多糖的含量。菌株D3 在此过程中效果更为明显,多糖含量为(360.89±6.93)mg/g,提取率达到(36.09±0.07)%,比对照组提高88.0%,高于热水浸提法的海藻多糖提取率4.99%[14]和纤维素酶法褐藻多糖提取率11.62%[15]。
2.3 海带发酵液中岩藻糖含量的检测对比
采用Gibbons 比色法法绘制岩藻糖标准曲线:y=5.028 2x-0.032,R2=0.999。基于此曲线计算经不同来源菌株发酵后岩藻糖含量如图4 所示。
数据显示岩藻糖含量与对照组比较,提高16.4%~100.3 %。菌株D1 处理后岩藻糖含量为(138.76±21.11)mg/g,提取率为(13.88±0.21)%,比对照组提高一倍多;S2 与 D3 岩藻糖含量为(134.79±16.42)mg/g和(119.5±2.70)mg/g,提取率为(13.48±0.16)%和(11.95±0.03)%,较对照组增高94.5%和72.5%。结果均高于优化后热水浸提岩藻糖的得率10.61%[16]。
图2 12 株芽孢菌细胞形态Fig.2 Cell morphology of 12 strains of Bacillus
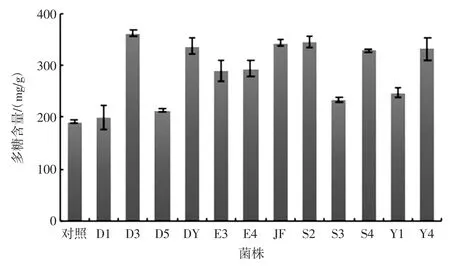
图3 12 株益生菌发酵后海藻多糖含量Fig.3 The content of seaweed polysaccharide after fermentation of 12 probiotics
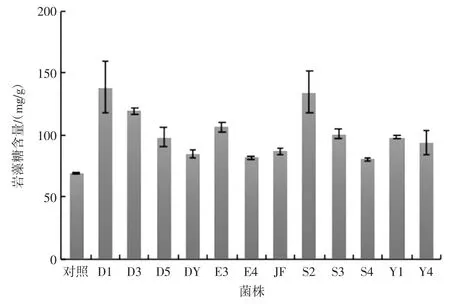
图4 12 株益生菌发酵后岩藻糖含量Fig.4 The content of fucose after fermentation of 12 probiotics
2.4 海带发酵液中海藻酸含量检测对比
利用不同菌株对海带进行发酵处理前后,海藻酸的产量变化明显,菌株发酵后海藻酸含量如图5 所示。
与对照组相比除菌株D5 外,其他菌株对海带发酵处理后海藻酸产量明显上升。其中,S2 发酵组提高最为显著,经 S2 发酵后得率为(49.05±3.03)%,比对照组提高 9.40 倍;Y4 发酵组和 E4 发酵组分别为(38.61±1.79)%和(38.05±0.34)%,分别比对照组提高7.19 倍和7.07 倍。D3 发酵组提取率为(34.68±4.37)%,比未发酵的对照组提高6.36 倍。
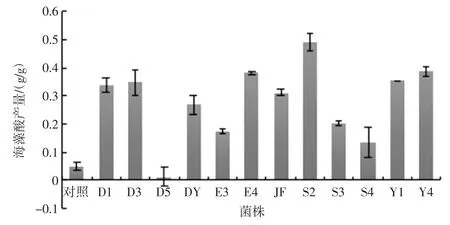
图5 12 株益生菌发酵后海藻酸含量Fig.5 The content of alginic acid after fermentation of 12 probiotics
2.5 菌种鉴定结果及分析
综合12 株典型芽孢菌株发酵后成分检测分析,结果显示D3 的对海带的综合降解提取效果最好。经扩增得到长度约为1 500 bp 的D3 菌株16S rDNA 序列,结果如图6 所示。测序结果用BLAST 进行序列同源性比对,并利用MEGA 6.06 构建系统发育树,结果见图7。
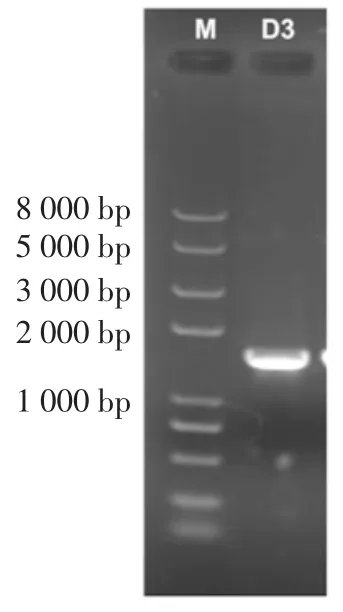
图6 菌株D3 16S rDNA 经聚合酶链式反应(polymerase chain reaction,PCR)扩增结Fig.6 Electrophoresis of PCR amplified 16S rDNA
由系统发育树可知,D3 菌株与Bacillus siamensis PD-A10(NR 117274)处于同一个分支,亲缘关系最近,因此将菌株D3 归属于Bacillus siamensis。暹罗芽孢杆菌(Bacillus siamensis)是 2010年报道的一个新种,截至目前属于该种的菌株报道不多。

图7 菌株D3 基于16S rDNA 系统发育树Fig.7 Phylogenetic tree of strain D3 based on 16S rDNA gene sequences
3 结论与讨论
海带发酵液多糖的主要成分是褐藻多糖,是海带中广泛存在的一大类具有生物活性的成分,在免疫调节、抗疲劳、抗凝血、抗辐射、抗氧化、抗衰老、抗肿瘤、抗病毒等方面的研究[17-18]不断深入。人体产生的活性氧(reactive oxygen species,ROS)攻击自身大分子化合物从而导致炎症、糖尿病和癌症等疾病,褐藻多糖具有良好的抗氧化活性,可以保护人体免受活性氧的损伤。低浓度的褐藻多糖能直接清除多形核白细胞呼吸爆发产生的活性氧自由基[19],高浓度的多糖能阻止活性氧的生成。在体外活性研究中岩藻多糖表现出对肿瘤细胞的杀伤力,抑制并有效控制肿瘤转移。另外岩藻多糖的在抗流感、人乳头瘤病毒(human papillomavirus,HPV)、单纯疱疹病毒(herpes simplex virus,HSV)等的能力已得到验证。小鼠实验证明岩藻多糖可增强小鼠抗疲劳能力,增强耐缺氧能力,对受辐射损伤的的免疫功能调节作用呈量效关系。黎静等研究发现海带多糖可以调节皮肤基质金属蛋白酶活性,进而调节光老化皮肤胶原蛋白的代谢,减少日光照射对皮肤的损伤[20]。L-岩藻糖可看做一种甲基戊糖,其较大量地存在于海藻及树胶中,也发现于某些细菌的多糖中。L-岩藻糖具有免疫增强功能,并能够降胆固醇、降血脂。一方面L-岩藻糖通过对肠道微生物的调整,增强肠道机能。另一方面,L-岩藻糖还可以与病毒、细菌、毒素等结合,防止其感染细胞,增强机体免疫力。肖瑶等实验证明高剂量岩藻糖对免疫性肝损伤具有保护作用[21]。海藻酸极易形成钠盐,海藻酸钠是一种高粘性的高分子化合物,具有优良的分散性、保湿性、成膜性、抗菌性、可生物降解、生物相容性好等特点[22],由于其极强的亲水特性,当环境湿度较大时,海藻酸钠可吸收外界水分,保持内部的相对湿润,具有较强的吸湿作用,且成本较低,广泛应用于食品保鲜。具有高古洛糖醛酸含量的藻酸盐可形成坚固且刚性的凝胶,并且适用于食品和化妆品工业[6]。例如赵珊等以此为原料制备樱桃保鲜剂,明显延长保存期和贮藏品质[23]。陈妮娜等制备可降解改性复合膜应用与绿色食品包装以代替传统塑料膜[24]。机体产生的氧自由基使氧化反应增强,产生大量自由基,对机体组织的毒害很大[25]。海带中的褐藻糖胶、多酚类物质,对清除人体内自由基保护机体具有极大的作用。数据表明经不同芽孢菌发酵,提高了海带中抗氧化物质活性。而Bacillus siamensis D3 在其中具有显著优势,在食品领域具有重要的价值,应用潜力巨大。
微生物发酵是一种有前景的生物过程,通过增加发酵提取物中的酚类物质,蛋白质,还原糖和脂肪酸可提高海藻的营养价值及其生物功能活性[26]。对比各指标活性物质常用的提取方法及提取效率,区别于传统酶法、水提法等方法对海藻中单一组分的提取及酸碱和高温等处理过程,本研究中芽孢菌发酵能够综合性提高海藻中各项活性成分的种类和含量,综合利用价值提高且经济环保可循环。Hifney 等试验证明海带上清液中的海藻多糖、岩藻糖增多可能是菌株生长过程中分泌的胞外酶对海带的降解作用[10],研究人员证实一些藻类真菌在生长中伴随岩藻多糖酶和藻酸酶的产生,本研究以多指标评价筛选得到的降解海带并提高其活性成分的芽孢菌,而试验结果表明12 株不同芽孢菌株对海带发酵后各项指标均有提高但是能力存在较大差异,推测是生长中伴随产生降解海带的生物酶的种类和活力不同导致的差异或者不同菌株发酵周期长短存在差异而导致的不同。具体促进海带降解和释放生物活性物质的酶类及具体降解机制有待进一步深入研究。
目前,食品工业中使用最广泛的抗氧化剂是合成化合物,包括丁基化羟基甲苯,丁基羟基茴香醚,叔丁基氢醌和没食子酸丙酯,可能会对健康造成不良影响和致癌性[27]。因此,本研究所筛选所得菌株提取海藻多糖和海藻酸盐低成本、高效益、环保可再生,使海藻多糖和海藻酸盐等有望作为天然、安全、可再生的抗氧化剂应用于各领域。另外,海带发酵产物中富含的多糖、酚类化合物、氨基酸和脂肪酸等成分赋予海带更高的营养保健功能,既可单独提取或纯化作为功能性食品、保健品和化妆品原料,使海带活性物质作为新资源食品进一步开发,也可直接当作为复合活性营养应用于食品或化妆品中综合利用。
