铜渣与含砷污酸反应行为及除砷机理
2019-10-23李永奎祁先进惠兴欢郝峰焱蔡贵远
李永奎,祝 星*,祁先进,王 华,张 鑫,惠兴欢,郝峰焱,蔡贵远
铜渣与含砷污酸反应行为及除砷机理
李永奎1,2,祝 星1,2*,祁先进1,2,王 华1,2,张 鑫3,惠兴欢3,郝峰焱1,2,蔡贵远1,2
(1.昆明理工大学,省部共建复杂有色金属资源清洁利用国家重点实验室,云南 昆明 650093;2.昆明理工大学冶金与能与能源工程学院,云南 昆明 650093;3.楚雄滇中有色金属有限责任公司,云南 楚雄 675000)
分析铜渣组成结构和形貌特性的基础上,研究了铜渣与含砷污酸反应行为及脱砷规律,阐明了反应动力学过程,揭示了铜渣除砷机理.结果表明:在铜渣用量为0.2g/mL,反应温度为23℃,反应时间为24h的最优条件下,铜渣的最大去除容量达到25.89mg/g,除砷率达到99.56%,并且除砷后铜渣的砷浸出浓度低于5mg/L的危险废弃物界定限值,属于一般固体废弃物.铜渣除砷过程符合拟二级动力学模型,该过程受铁离子释放速度限制,离子交换吸附和化学沉淀方式同步进行实现了砷的脱除,两种方式的结合有利于砷的稳定化.铜渣与污酸反应释放大量的铁离子,通过离子交换吸附与砷酸根离子发生沉淀反应,形成较为稳定的砷酸盐及其衍生化合物,进而达到除砷目的.铜渣表现出优越的除砷性能,为重有色冶炼污酸处置提供了一种高效和低成本的方法.
铜渣;含砷污酸;除砷;动力学
含砷矿受自然演变和人类活动影响,可转变为迁移性较强的含砷化合物并暴露于环境中,给生态环境带来严重污染或潜在危害,特别是重有色冶炼工业的砷排放及污染[1-2].在重有色冶炼过程中,含砷硫化物精矿中大部分砷在火法冶炼中进入了二氧化硫烟气,一部分砷以重力收尘或静电除尘形式被脱除,另一部分砷在烟气制酸前的烟气洗涤和净化工序中被脱除,并富集于洗涤酸性废水,即通常所称的污酸[3].污酸中含有砷、氟、氯等有害杂质以及多种重金属元素,具有成分复杂、毒性强、排放量大和处置难度大等特点,是重有色冶炼主要的污染源.
目前,以污酸为代表的含砷酸性废水处置方法包含化学沉淀法[4]和吸附法[5-6],其中以中和和硫化为特征的化学沉淀法是高浓度含砷酸性废水的常用方法,而吸附法常用于低浓度酸性废水的深度除砷或净化.中和法虽除砷效果好,但沉淀剂及渣量大,形成的钙砷渣不稳定且毒性强,存在严重的二次污染[7-8].硫化法处置成本相对较高,砷可集中于硫化砷渣,虽然毒性强,但渣量相对较少,不过同时不可避免在中和工序产生大量石膏渣[9].吸附法具有高效率、可再生等优点,其中铁基吸附剂由于较强的砷亲和性,现已成为研究热点[10-11].基于此,亟需开发一种高效、廉价并且对含砷废水具有良好适应性的的除砷新方法.
在中和沉淀和吸附法除砷中,铁基氧化物或铁盐是重要的除砷药剂,这主要得益于铁氧化物吸附性及铁离子高效除砷特性[12-13].铁氧化物对As(Ⅲ)和As(Ⅴ)具有较高的亲和力,可以与酸性溶液中H+反应释放铁离子,通过静电吸附吸引和配位交替作用与砷生成不同形态化合物,达到除砷目的[14-15].铁氧化物进一步水解形成无定形水合物可以提供大量吸附砷离子的位置,有利于与砷化物发生共沉淀作用[16].赵雅光等[14]开展了还原铁粉-石英砂复合材料对水体As(III)脱除研究,发现还原铁粉表面吸附及其腐蚀产物对As(III)起到了吸附共沉淀作用;王震等[17]利用自制的纳米铁系物对As(Ⅲ)的吸附机理和性能研究,发现纳米铁系物表面特性和组成结构影响As(Ⅲ)的去除,As(Ⅲ)与纳米铁系物通过离子交换吸附形成配位化学键去除;冷迎祥等[18]采用铁氧化物对As(V)稳定化进行研究,探索了无氧与有氧条件下铁氧化物对除砷性能的影响,结果发现在有氧条件下铁氧化物表面产生的氧化铁与砷发生吸附共沉淀作用,形成稳定的配合物;曾辉平等[19]开展了铁锰泥除砷颗粒对As(Ⅴ)的吸附效果与除砷机理研究,结果发现铁锰泥除砷颗粒对As(Ⅴ)具有较好的效果,铁氧化物水解为As(Ⅴ)提供充足的吸附位点;Baig[20]通过共沉淀法负载铁/铁氧化物后制备出蜂窝煤渣/Fe3O4复合吸附材料,对水中As(III)和As(V)的选择性去除进行了系统研究,发现复合材料中铁离子的释放速度与砷氧化物的去除效率有直接关系,铁与砷离子通过静电吸附发生除砷沉淀反应.这些研究表明,铁基化合物表现出优越的除砷效果,主要得益于吸附和化学沉淀作用.但目前铁基化合物除砷药剂成本较高,推广应用受到限制,寻找或开发廉价铁基除砷药剂成为其规模化应用的关键.
铜渣是铜火法冶炼工业产生的富含铁的大宗固体废弃物,我国每年铜渣排放量约800万t.然而铜渣利用率很低,只有少部分用于水泥生产辅料、道路路基骨料和防腐除锈剂等,大部分被堆存在渣场,不仅占用土地又污染环境,也造成巨大的资源浪费[21].铜渣中含有丰富的铁氧化物和其他少量的碱性氧化物.铁氧化物有望为砷及其他重金属离子提供有效的吸附位点,铁氧化物和碱性氧化物可与酸反应,起到中和沉淀作用,促进重金属离子的吸附与沉淀[22].目前,铜渣作为污酸吸附剂和沉淀剂尚未研究,其特性决定铜渣用于污酸处理具有中和沉淀和吸附重金属离子的优势.因此,开展铜渣与污酸反应行为及除砷机理研究,对于突破污酸处置和铜渣综合利用具有重要意义.
基于此,本文开展了铜渣用于污酸除砷技术研究,将为含砷污酸无害化提供一种高效低成本处置方法.研究了铜渣用量和反应时间对铜渣除砷行为的影响,并优化铜渣除砷工艺条件.基于铜渣除砷效率和除砷容量,分析了除砷动力学过程,解析了铜渣和污酸反应行为.还利用SEM-EDS和FTIR对含砷铜渣的微观形貌和表面信息进行了分析,提出了铜渣除砷机理.
1 材料与方法
1.1 实验原料
实验采用的铜渣和污酸都是取自西南某铜冶炼厂,铜渣为水淬渣,渣样经自然干燥和研磨后,筛分粒径为100~200目的颗粒备用.污酸成分与其化学元素分析如表1所示.NaOH和30%H2O2均为分析纯.

表1 污酸成分(mg/L)
1.2 检测仪器
日本理学max-3BX射线衍射仪、PS-100电感耦合等离子发射光谱(ICP-AES,利曼中国)、荷兰FEI公司生产的Quanta 200型扫描电子显微镜(SEM)与EDAX Genesis 200型X-射线能谱仪(EDS)耦合仪(SEM-EDS)、美国赛默飞世尔科技公司制造的傅里叶变换红外光谱仪(FTIR)、荷兰帕纳科公司制造的AxiosmAX(PW4400/40)型波长色散X射线荧光光谱仪(XRF)、美国Quantachrome仪器公司生产ASIQC0004-3型Autosorb-iQ-C全自动物理/化学吸附分析仪和上海精密科学仪器有限责任公司生产的PHS-3D型pH计.表2为不同表征手段对应的检测条件和性能参数.

表2 不同表征手段对应的检测条件和性能参数
1.3 实验方法
污酸中砷以As(III)和As(V)两种价态形式存在,砷的存在形态直接影响着后续铜渣除砷效率和含砷渣毒性迁移能力[16,23].相比As(III),As(V)易与溶液中的金属阳离子结合形成稳定的砷酸盐.砷酸盐在自然环境下溶解度很低,具有较高稳定性.对污酸进行氧化处理有利于提高铜渣除砷率和含砷废渣稳定性[24].根据Molnrlu的研究将H2O2与污酸按砷离子浓度为1:1.2的化学计量混合,放置95℃的水浴锅中加热2h,自然冷却至室温备用[25].
(1)铜渣用量影响
按铜渣/污酸固液比为0.08g/mL、0.12g/mL、0.16g/mL、0.2g/mL、0.24g/mL、0.28g/mL、0.32g/mL、0.36g/mL、0.4g/mL加入锥形瓶中置于水浴恒温震荡器上,在23℃条件下以180r/min的转速振荡24h,取出后用孔径为0.45μm的微孔滤纸进行过滤,用ICP进行检测滤液中砷浓度,滤渣在60℃下干燥12h装袋密封备用.
(2)反应时间影响
按铜渣/污酸固液比为0.2g/mL加入锥形瓶中置于水浴恒温震荡器上,在23℃条件下以180r/min的转速分别振荡0.5h、1h、1.5h、2.5h、4h、9h、12h、18h、24h,取出后用孔径为0.45μm的微孔滤纸进行过滤,用ICP进行检测滤液中砷浓度,滤渣在60℃下干燥12h袋密封备用.所有实验设定3个平行样.
以砷去除率作为实验指标,考察铜渣用量和反应时间对污酸中砷去除率的影响.称取一定量的铜渣与污酸混合,在23℃的水浴恒温振荡器上以180r/min的转速振荡,振荡反应一定时间后,取出用孔径为0.45μm的微孔滤膜进行过滤,用ICP检测滤液中砷浓度,滤渣进行干燥装袋密封备用.按照下式(1)计算砷的去除率,
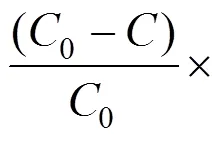
式中:0为初始时污酸中的砷离子浓度, g/L;为除砷后污酸中的砷离子浓度, g/L.
1.4 毒性浸出实验
按照中国环境保护提供的《HJ/T 299-2007》标准[25],对除砷铜渣进行硫酸硝酸法毒性浸出检测.该方法为:先将硫酸和硝酸以2:1的质量比溶解到去离子水中,调节溶液pH值为3.20±0.05,震荡摇匀配置浸提液,然后称取一定质量的样品放置在100mL的锥形瓶中,按液固比为10:1加入浸提液,将锥形瓶固定在恒温震荡箱上,以180r/min震荡频率震荡18h,震荡完成后,用孔径为0.45μm的微孔滤纸进行过滤,最后用ICP检测滤液中砷的浓度.
2 结果与讨论
2.1 铜渣特性表征
表3为铜渣的XRF测试结果,由表3知铜渣由Fe、Si、O等元素组成,主要成分为铁和硅氧化物,占铜渣总量的83.57%,还有含量少于6%的MgO、CaO和K2O碱性氧化物.按照《固体废物腐蚀性测定,GB/T 15555.12-1995》[26]对铜渣腐蚀性进行了测试,其浸出液pH值为9.11,偏碱性,属于一般固体废物.

表3 铜渣的化学组成
如图1所示为铜渣XRD图谱,结果显示铜渣主要由铁橄榄石玻璃相和少量的铁氧化物相组成.其中FeSiO4铁橄榄石相的衍射峰位于25.29°、31.63°、35.09°、36.02°及51.55°处,为铜渣的主要衍射峰,强度较高;Fe3O4相的衍射位于35.62°、43.18°、57.49°及62.69°处,相对强度较弱,部分衍射峰与铁橄榄石重叠.铜渣微观形貌如图2所示,图(2a)显示铜渣呈碎粒堆积状,碎块表面富集一些小颗粒,小颗粒形状不一;图(2b)显示除单个颗粒以玻璃相存在,玻璃相不规则并且有明显分界线,大多为菱角块状,表面光泽,质地紧密,由此推断碎块主要为FeSiO4相.铜渣富含铁氧化物,并且含有少量磁性铁,具有除砷用铁氧化物的部分特性,具有潜在的除砷能力[27-28],而碱性氧化物也将具备一定化学沉淀和吸附能力[29-30].
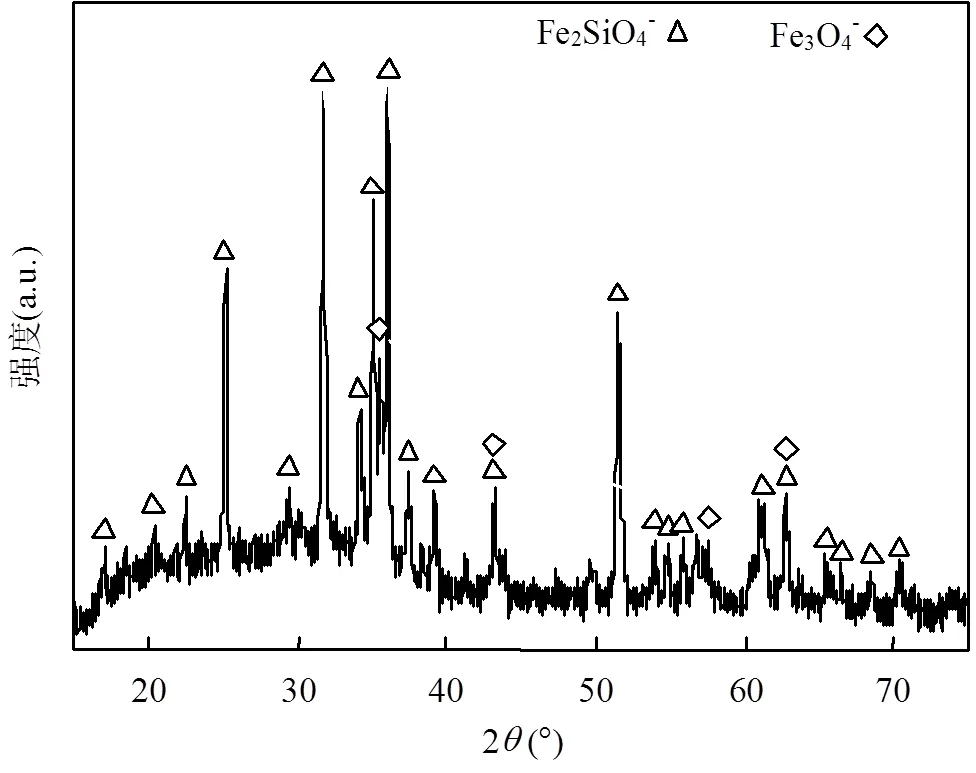
图1 铜渣的XRD图
铜渣比表面积和空隙特性由Autosorb-iQ-C全自动物理/化学吸附分析仪测试.BET结果显示铜渣的比表面积为0.71m2/g,孔体积为2.74×10-3cm3/g,平均孔径为7.77nm.根据IUPAC将吸附剂的孔径分为3类:微孔(<2nm)、介孔(2~50nm)与大孔(>50nm)[31],表明铜渣表面空隙很小.

2.2 铜渣与污酸反应行为
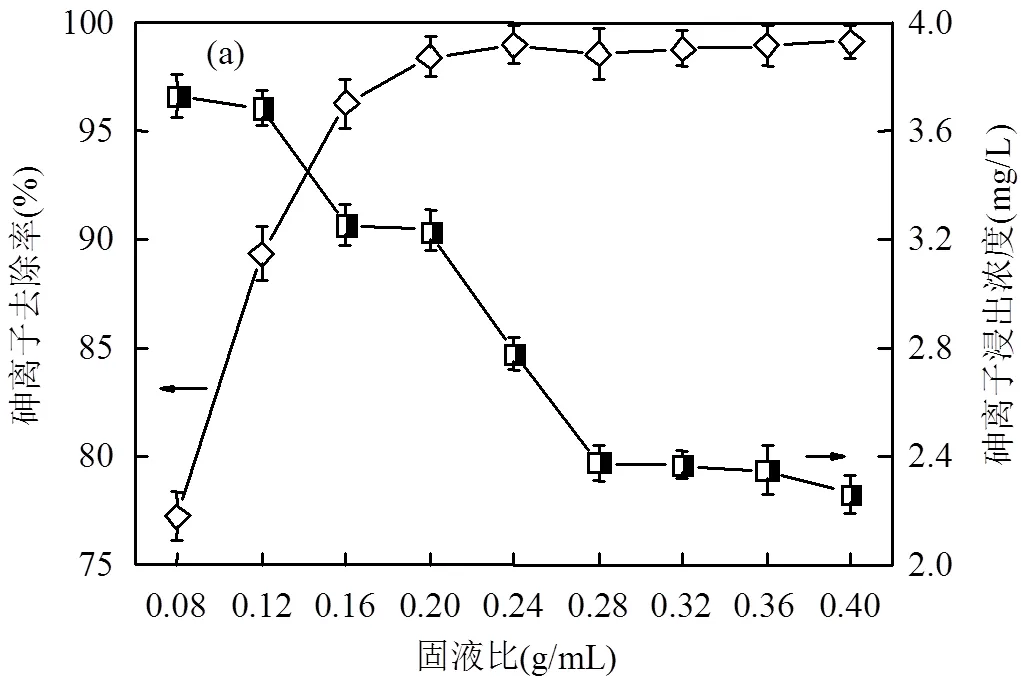
2.2.1 铜渣用量 图3(a)为铜渣用量对污酸中砷去除率和除砷铜渣毒性浸出的影响,铜渣与污酸反应时间为24h,反应温度为23℃.如图所示,随着铜渣用量增加,铜渣对砷的去除率先增大后基本保持不变.当铜渣用量小于0.2g/mL时,砷的去除率随用量增加呈线性增大.此时,除砷铜渣中砷的毒性浸出浓度呈下降趋势,并且都低于《危险废物鉴别标准GB5085.3-2007》规定的5mg/L[32],属于一般固体废弃物.当铜渣用量大于0.2mg/L时,砷的去除率变化很小,基本维持在98.56%左右.同时,除砷铜渣中砷的毒性浸出浓度相对变化也较小.
铜渣富含铁氧化物与其他少量碱性氧化物的化学组成特点[33],决定了铜渣可以通过离子交换吸附和化学共沉淀去除污酸中的砷[34-35].随铜渣用量增加,溶液中砷酸根离子和铜渣反应接触面积增大,并且可提供更多的有效吸附位点,砷酸根离子和铜渣充分反应生成稳定的砷酸铁及其衍生化合物.同时,铜渣溶解在溶液中的铁离子与碱性离子浓度增加,增大溶液中正电位浓度,促进砷酸根离子和铁离子共沉淀反应[36].铜渣用量越多,反应越充分,生成的含砷化合物越稳定,除砷铜渣中砷的毒性浸出越小.当铜渣用量达到较大水平时,溶液中砷酸根离子和铜渣的反应趋于饱和,导致砷离子浓度变化很小.此时,砷酸根离子和铜渣充分反应,含砷化合物达到稳定化.
由图3(b)可见,在酸性条件下,铜渣中铁氧化物会和酸根离子反应并且释放铁离子,并且铜渣中碱性氧化物会发生水解和电离,产生大量的OH-基团,溶液中的H+与OH-发生中和反应[37],导致溶液的pH增加.当溶液中砷酸根离子和铜渣反应达到平衡后,铜渣表面生成的砷酸铁及其他沉淀物阻碍了铜渣溶解,溶液中H+浓度梯度减小,导致溶液终点pH变化较小.在考虑铜渣用量时,因考虑除砷技术、成本和环境问题,根据实际情况采用一个最佳用量.铜渣用量为0.2g/mL时为最佳用量,其除砷率为98.42%,除砷铜渣中砷的浸出毒性浓度为3.23mg/L,低于国家标准规定的5mg/L[32].
2.2.2 反应时间 图4(a)为反应时间对铜渣和污酸反应中砷去除率和除砷铜渣毒性浸出的影响,铜渣/污酸固液比为0.2g/mL、反应温度为23℃.如图所示,在初期,砷的去除率随时间的延长显著变化,去除率曲线变化较陡直,反应时间达到12h后砷去除率保持较高水平,当反应时间为12h时,砷去除率达到97.15%;在后期,砷的去除率随时间的延长变化缓慢,去除率曲线变化较平缓,砷的去除基本维持在98.65%附近.反应时间对砷去除率显示出“快速吸附,缓慢平衡”的规律.整个反应过程中,除砷铜渣的砷毒性浸出浓度都低于5mg/L[32].溶液中砷酸根离子和铜渣的接触时间越长,除砷铜渣中砷的毒性浸出浓度越低.这主要是在较短时间内铜渣通过吸附脱除砷,随反应时间增加化学反应不断进行,形成稳定化合物,所以毒性浸出较低.

研究表明,铜渣对砷酸根离子去除是离子交换吸附和化学沉淀共同作用[28,34-35].起始,铜渣中铁氧化物与H+反应,释放大量的铁离子,增加溶液正电位浓度,砷酸根离子和铁离子主要靠静电作用,快速吸附共沉淀[38],而且初始砷离子浓度与铜渣表面能相差较大[39],因而砷酸根离子吸附在铜渣表面,很快达到平衡;随着反应时间增加,H+浓度梯度减小,砷酸铁及其他沉淀物附着在铜渣表面,铁离子释放速度受限制,砷酸根离子与铁离子的作用能力逐渐降低,而吸附在铜渣表面的砷酸根离子与铜渣发生化学反应,形成稳定的砷酸铁和及其衍生化合物[40].因此,砷的脱除主要通过离子交换吸附和化学沉淀方式同步进行实现.
图4(b)为反应时间对铜渣反应后污酸终点pH值的影响.由图知,随着反应时间的增加,污酸终点pH先快速增加后趋于稳定.铜渣与污酸接触时间越长,有利于铁氧化物在酸性条件下的溶解反应,碱性氧化物水解和电离越充分,污酸终点pH变化越明显.当反应时间达到一定值后,溶液中的H+浓度减小,酸碱中和反应驱动力减弱,污酸终点pH保持相对稳定.
2.3 铜渣反应动力学分析
铜渣用于污酸,除砷过程表现为“快速吸附,缓慢平衡”规律.铜渣除砷伴随着复杂的物理化学作用,在吸附过程中铜渣中铁氧化物溶解释放出铁离子,与砷酸根离子发生化学吸附同时进行化学稳定化.铁离子的释放缓解了砷酸根离子与硫酸根离子之间的相互竞争力[41],增强了铜渣表面对砷酸离子的物理吸附.由2.1部分结果可知,铜渣比表面积、孔体积和平均孔径很小,表明铜渣表面物理吸附作用很低,化学吸附为主导.准二级动力学可以描述吸附剂对吸附质的化学吸附反应[42],而颗粒内扩散模型可以很好的描述吸附过程机理[43].
为了揭示铜渣用于污酸除砷动力学过程和分析除砷控速步骤,采用准二级动力学方程和颗粒内扩散模型对实验结果进行线性拟合分析,其线性表达式分别为:

qt
=
kpt
1/2
+
c
(3)
式中:e代表铜渣达到平衡时的吸附量,mg/g;反应时间为时铜渣的吸附量,mg/g;代表反应时间,min;2代表二级吸附动力学吸附速率常数,g/(mg·min))代表扩散速率常数,mg/(g·min1/2);c代表与界面层厚度有关的常数,mg/g.
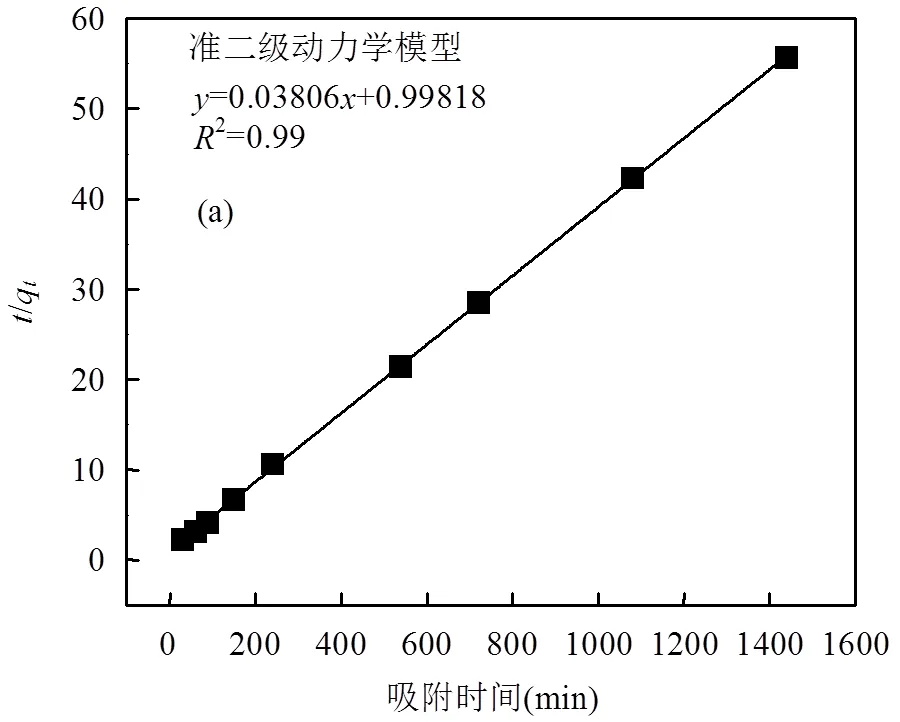
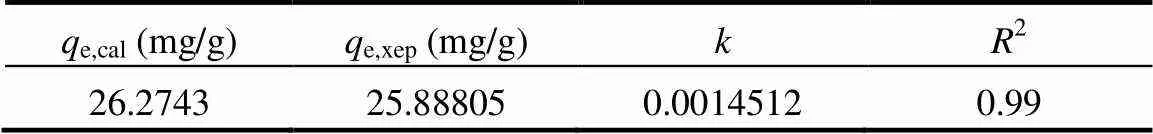
表4 准二级动力学线性拟合相关参数表

为了进一步探究铜渣除砷过程中的主要控速步骤,对实验结果进行颗粒内扩散模型线性拟合.由图5(b)和表5知,铜渣除砷过程分三个阶段,且三个阶段线性拟合斜率大小依次为p1>p2>p2.初始阶段:溶液中砷酸根离子浓度较高,固相与液相表面浓度梯度大,对应较高传质推动力[19],有利于砷酸根离子在铜渣表面发生离子交换吸附,同时铜渣中铁离子释放较快,增加溶液正电位梯度,促进砷化学吸附[28].中期阶段:随反应发生溶液中砷酸根离子浓度逐渐降低,固相与液相表面传质推动力降低并且固相表面内扩散阻力增加[38],导致砷酸根离子去除速率降低.后期阶段:铜渣表面达到物理吸附饱和而变慢[19],此时溶液中H+溶度梯度减小并且铜渣表面被沉淀物覆盖,阻碍了铁离子释放,砷化学吸附速率减慢,而吸附和共沉淀在铜渣表面的砷化物得到进一步化学稳定化.常数边界厚度有关,常数越大表明该阶段膜扩散在吸附速率控制步骤中阻力越大.随着反应进行线性拟合斜率逐渐减小,常数逐渐增大,这意味着随着反应的进行反应速率在减小,边界阻力增大,铜渣对砷的去除率变化平缓.对应的拟合曲线不通过原点,表明铜渣对砷的吸附过程受多方面的影响,颗粒内扩散过程不是唯一的控速步骤[43].
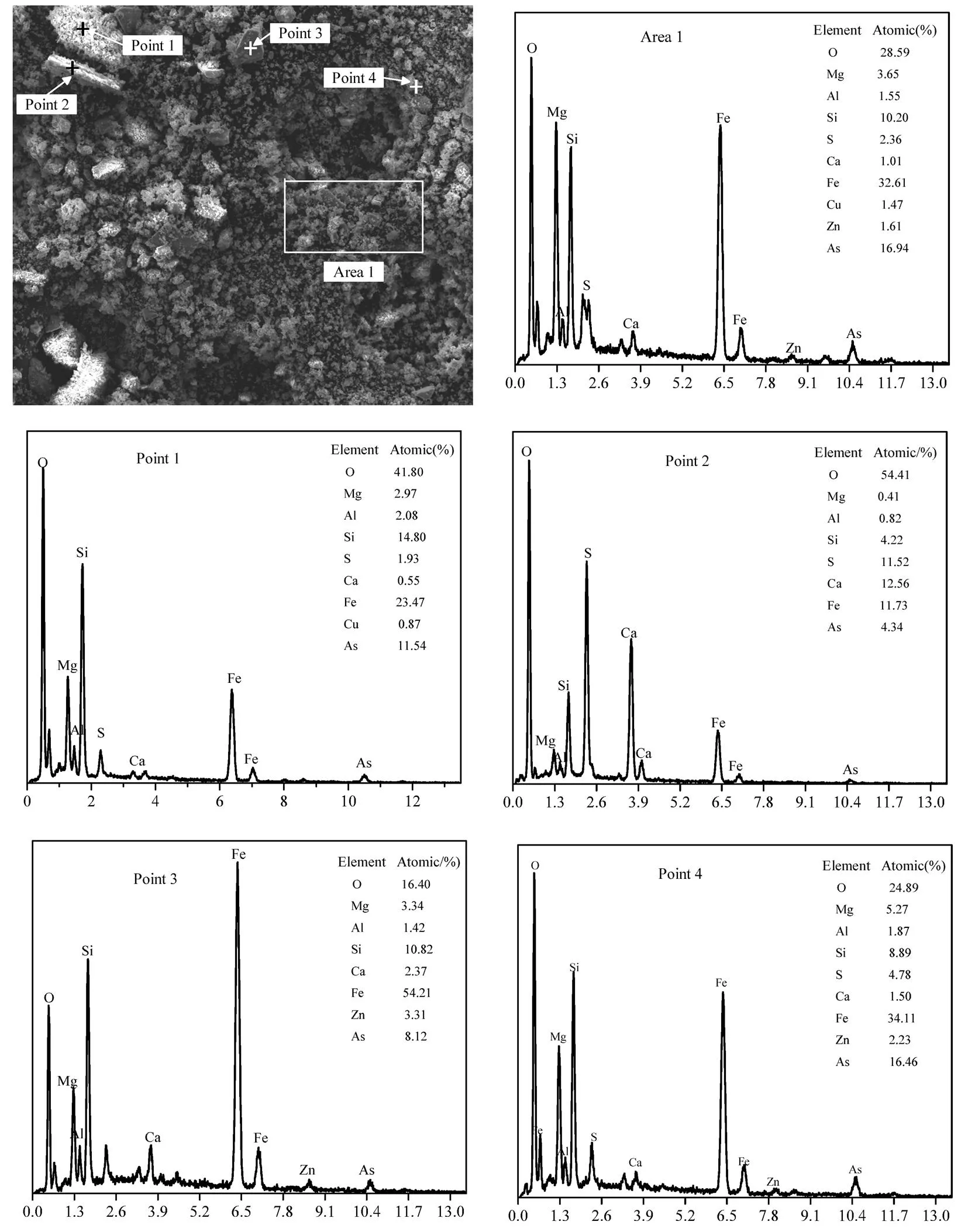
图6 除砷后铜渣的SEM-EDS图
为揭示铜渣除砷机理,对除砷铜渣进行了SEM-EDS和FTIR分析,研究除砷铜渣的微观形貌、元素组成和结构演变规律.基于2.2节铜渣除砷实验条件,选择室温、铜渣用量为0.2g/mL和反应时间为24h作为反应条件.
除砷后铜渣形貌及除砷后铜渣组成如图6所示.取样区域(Sampling Area 1)主要是一些细小颗粒的团聚物和小碎块,物质的原子组成分别O(28.59%)、Fe(32.61%)、As(16.94%)、Ca(1.1%)、Mg(3.65%)、Al(1.55%)、Si(10.2%)、S(2.36%)、Cu(1.47%)和Zn(1.61%),其中O、Fe、As和Si是该颗粒主要组成元素,是除砷后铜渣代表性组成.为获得As在除砷后铜渣中存在形式和分布规律,在SEM图谱所示区域对不同结构和形状的颗粒进行了能谱打点分析.取样点1(Sampling point 1)是一些细小颗粒物质堆叠成的团聚物,原子组成分别为O(41.8%)、Fe(23.47%)、As(11.54%)、Ca(0.55%)、Mg(2.97%)、Al(2.08%)、Si(14.8%)、S(1.93%)和Cu(0.87%),表示这些团聚物主要由O、Fe、As和Si组成,对应物相可能是砷酸铁(FeAsO4)和硅酸盐;取样点2(Sampling point 2)和取样点3(Sampling point 3)为棒状和块状固体,是典型的铁橄榄石玻璃相结构,是未反应的铜渣主要组分,其As含量均小于取样点1,出现少量的砷含量是因为其表层负载有少量的颗粒状砷酸铁;取样点4(Sampling point 4)为一些分散的小可颗粒物质,原子组成分别为O(24.89%)、Fe(34.11%)、As(16.64%)、Ca(1.55)、Mg(5.27%)、Al(1.87%)、Si(8.89%)、S(4.78%)和Zn(2.23%),相比其他三个点,Sampling point 4的As含量最大,进一步说明这些小颗粒是除砷的主要沉淀物,结合图7的表面结构分析,可以推测主要物相为FeAsO4和硅酸盐.
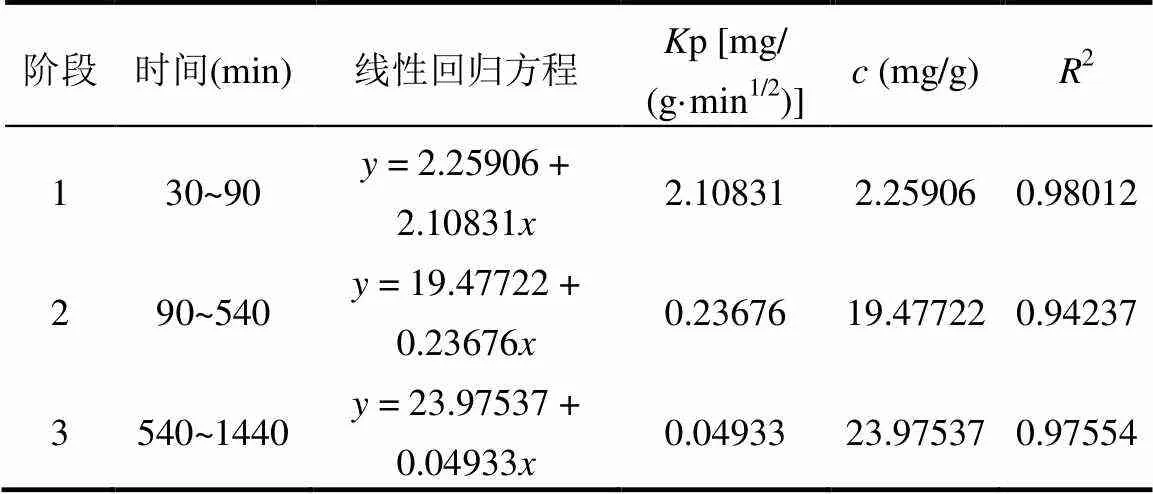
表5 颗粒内扩散模型线性拟合相关参数表
由图7可见,新鲜铜渣FTIR谱图中,3438cm-1处为-OH的伸缩振动吸收峰,1761cm-1、1625cm-1为水分子弯曲振动吸收峰,565cm-1为Fe-O的摇摆震动峰[45],947cm-1和1021cm-1为硅酸盐络阴离子[SiO42-]中Si-O的非对称伸缩峰,474cm-1为H2SiO4对应的Si-O非对称弯曲振动峰[46].与新鲜铜渣谱图相比,除砷后铜渣947cm-1和1021cm-1处峰强减弱,而474cm-1处Si-O产生强而宽的伸缩带,这可能是由于硅酸盐在酸性溶液中溶解形成硅胶[37, 47].在804cm-1处出现了As—O伸缩振动峰,804cm-1的峰很可能是As—O表面络合形成的As—O—Fe基团,在700~950cm-1处峰带加强,铜渣表面发成络合沉淀从而引起As—O的伸缩振动,说明铜渣中的铁与砷发生络合沉淀反应[48-49];并且在565cm-1处的Fe—O摇摆震动峰峰深减小,进一步表明Fe—O在除砷过程中起到有效作用;波段950~1200cm-1之间属于SO42-带,硫酸是污酸的主要的酸性介质,As—O—Fe伸缩振动峰形成的同时SO42-会取代AsO43-,因此1087cm-1为SO42-伸缩峰[49-50].反应过程中铜渣中铁氧化物溶解释放Fe离子导致除砷后铜渣中Fe—O峰减弱,释放的Fe离子及时与砷酸根发生络合沉淀反应[51],同时也会与溶液中的SO42-发生离子吸附,从而引起除砷后铜渣中As—O峰和SO42-伸缩峰强度增强.所以沉淀物中得到了含有硫酸铁的砷酸铁物相.
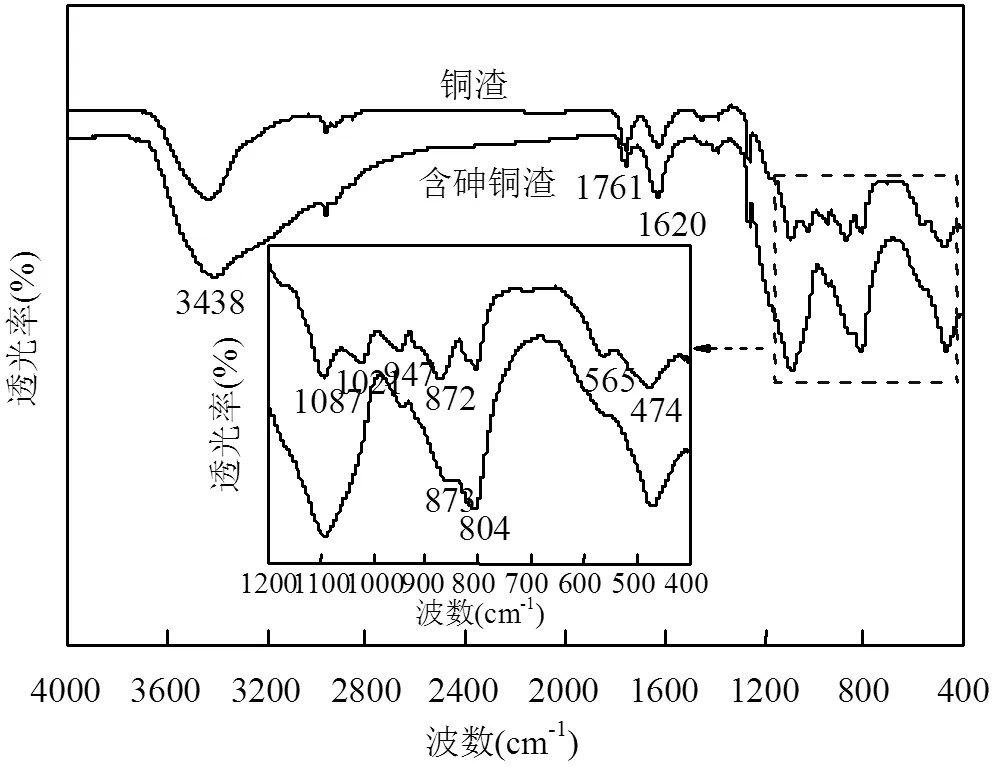
图7 除砷前后铜渣的FTIR图谱
2.4 铜渣处置含砷污酸展望
基于以上研究,提出一种铜渣处置含砷污酸工艺流程图,如图8所示.该工艺装置由污酸池、板框压滤机、中和池和磁选机四部分组成.在污酸池中铜渣表面溶解释放出大量铁离子,铁离子和污酸中砷酸根离子被空气氧化后形成稳定的FeAsO4和硅酸盐沉淀物附着在铜渣表面.反应后的沉淀物流至板框压滤机进行压滤,压滤产生的含砷铜渣送至磁选机破碎磁选得到含砷废渣和铜渣,含砷废渣直接运到渣场堆放,铜渣进行二次循环利用;压滤产生的废水流进中和池,向其中加入中和剂和通入空气,同时检测并控制pH值为8~10,溶液中的铁离子形成氢氧化铁胶体对残余砷酸根离子和重金属离子进行深度脱除,深度处理后的上清液中砷浓度和重金属离子浓度低于国家工业污水处理标准.该工艺充分利用工业固废,以废治废,有望成为一种含砷污酸低成本高效处置新方法.

图8 铜渣处理含砷污酸流程
3 结论
3.1 在铜渣用量为0.2g/ml,反应温度为23℃,反应时间为24h条件下,铜渣对砷的最大去除容量可达到25.89mg/g,除砷率达到99.56%;除砷铜渣中砷的毒性浸出浓度为3.3mg/L,低于《危险废物鉴别标准GB5085.3-2007》规定的5mg/L.
3.2 铜渣除砷动力学和颗粒内扩散模型分析显示铜渣吸附速率受铁离子释放速度限制,吸附过程中伴随化学反应,其过程可以分为三步:铁离子释放、沉砷反应及砷稳定化反应.铁离子释放速率决定了沉砷速率,是反应过程主要控速步骤.
3.3 铜渣通过离子交换吸附和化学共沉淀实现污酸除砷.在酸性条件下,铜渣中铁氧化物溶解释放出大量铁离子与砷酸根离子发生离子交换吸附和共沉淀作用,形成较为稳定的砷酸盐及衍生物.这些含砷颗粒附着在铜渣表面促进砷稳定化,降低除砷铜渣中砷浸出.
[1] Xun L, Xing Z, Qi X, et al. Pyrolysis of arsenic-bearing gypsum sludge being substituted for calcium flux in smelting process [J]. Journal of Analytical & Applied Pyrolysis, 2018,130: S0165237017308707.
[2] Nazari A M, Radzinski R, Ghahreman A. Review of arsenic metallurgy: Treatment of arsenical minerals and the immobilization of arsenic [J]. Hydrometallurgy, 2016,174:S0304386X16307095.
[3] 赵占冲,史谊峰,祝 星,等.含砷石膏渣还原分解行为及砷迁移规律 [J]. 中国有色金属学报, 2017,27(1):187-197. Zhao Z C, Shi Y F, Zhu X, et al. Reductive decomposition behavior of arsenic bearing gypsum sludge with coal and arsenic migration rule [J]. The Chinese Journal of Nonferrous Metals, 2017,27(1):187-197.
[4] 门 玉,李洪枚,张广积.多级沉淀法处理含砷废水 [J]. 过程工程学报, 2017,(2):259-262. Men Y, Li H M, Zhang G J. Removal of arsenic from wastewater by multi-stage precipitation [J]. The Chinese Journal of Process Engineering, 2017,(2):259-262.
[5] Saiz J, Bringas E, Ortiz I. Functionalized magnetic nanoparticles as new adsorption materials for arsenic removal from polluted waters [J]. Journal of Chemical Technology & Biotechnology, 2014,89(6):909- 918.
[6] 许效天,霍 林,左叶颖,等.铝改性粉煤灰漂珠吸附水溶液中砷的性能研究 [J]. 中国环境科学, 2011,31(8):1300-1305. Xu X T, Huo L, Zuo Y Y, et al. Performance research on arsenic adsorption from aqueous solution by aluminum-modified fly ash cenospheres [J]. China Environmental Science, 2011,31(8):1300- 1305.
[7] 张广积,刘小娟,李媛媛,等.含砷废物的无害化处理 [J]. 工程研究-跨学科视野中的工程, 2015,(4):392-397. Zhang G J, Liu X J, Li Y Y, et al. The treatment of arsenic bearing waste [J]. Journal of Engineering Studies, 2015,(4):392-397.
[8] Aranda P R, Llorens I, Perino E, et al. Removal of arsenic(V) ions from aqueous media by adsorption on multiwall carbon nanotubes thin film using XRF technique [J]. Environmental Nanotechnology Monitoring & Management, 2016,5(21-26).
[9] Huisman J L, Schouten G, Schultz C. Biologically produced sulphide for purification of process streams, effluent treatment and recovery of metals in the metal and mining industry [J]. Hydrometallurgy, 2006, 83(1-4):106-113.
[10] 曾辉平,尹 灿,李 冬,等.基于铁锰泥的除砷吸附剂性能比较及吸附机理 [J]. 中国环境科学, 2018,38(9):175-181. Zeng H P, Yin C, Li D, et al. Performance comparison and adsorption mechanism of arsenic removal adsorbents made of backwashing sludge from biofilter for iron and manganese removal [J]. China Environmental Science, 2018,38(9):175-181.
[11] 曾辉平,赵运新,吕育锋,等.水厂反冲洗铁锰泥热处理产物结构及除砷变化 [J]. 中国环境科学, 2017,37(8):2986-2993. Zeng H P, Zhao Y X, Lu Y F, et al. Adsorption behaviors towards As and structural change of iron and manganese oxide sludge by thermal treatment [J]. China Environmental Science, 2017,37(8):2986-2993.
[12] 王翠翠,陈秋玲,刘树根,等.超声铁盐改性黄磷水淬渣的制备及除砷性能研究 [J]. 中国环境科学, 2017,37(6):2187-2193. Wang C C, Chen Q L, Liu S G, et al. Research on the preparation of ultrasonic-assisted ferric salts modified phosphorous slag and its As(Ⅲ) removing capacity [J]. China Environmental Science, 2017, 37(6):2187-2193.
[13] 陈维芳,程明涛,张道方,等.有机酸-铁改性活性炭去除饮用水中的砷 [J]. 中国环境科学, 2011,31(6):910-915. Chen W F, Cheng M T, Zhang D F, et al. Granular activated carbon tailored by organic acid-Fe for arsenic removal [J]. China Environmental Science, 2011,31(6):910-915.
[14] 赵雅光,万俊锋,王 杰,等.零价铁(ZVI)去除水中的As(Ⅲ) [J]. 化工学报, 2015,(2):730-737. Zhao Y G, Wang J F, Wang J, et al. Removal of arsenite from aqueous environment by zero-valent iron (ZVI) [J]. CIESC Journal, 2015,(2): 730-737.
[15] 吴萍萍,曾希柏.人工合成铁、铝矿对As(V)吸附的研究 [J]. 中国环境科学, 2011,31(4):603-610. Wu P P, Zeng X B. Study on arsenate adsorption by synthetic iron and aluminum oxides/hydroxides [J]. China Environmental Science, 2011, 31(4):603-610.
[16] Wang J, Zeng X C, Zhu X, et al. Sulfate enhances the dissimilatory arsenate-respiring prokaryotes-mediated mobilization, reduction and release of insoluble arsenic and iron from the arsenic-rich sediments into groundwater [J]. Journal of Hazardous Materials, 2017,339:409- 417.
[17] 王 震,李 群,王静宜,等.纳米铁系物对三价砷的吸附机理与性能 [J]. 净水技术, 2017,(2):31-39. Wang Z, Li Q, Wang J Y, et al. Mechanism and performance of adsorption for As (Ⅲ) by applied with nanoscale iron materials [J]. Water Purification Technology, 2017,(2):31-39.
[18] 冷迎祥,刘 菲,王文娟,等.小分子有机酸对纳米铁稳定砷的影响[J]. 环境工程学报, 2017,11(5):3195-3203. Leng Y X, Liu F, Wang W J, et al. Effects of small molecule organic acids on nanometer iron for stabilization of arsenic [J]. Chinese Journal of Environmental Engineering, 2017,11(5):3195-3203.
[19] 曾辉平,吕赛赛,杨 航,等.铁锰泥除砷颗粒吸附剂对As(Ⅴ)的吸附去除 [J]. 环境科学, 2018,(1):170-178. Zeng H P, Lu S S, Yang H, et al. Arsenic (V) removal by granular adsorbents made from backwashing residuals from biofilters for iron and manganese removal [J]. Environmental Science, 2018,(1): 170-178.
[20] Baig S A.铁/铁氧化物改性复合吸附材料的制备及其除砷性能和机理研究 [D]. 杭州:浙江大学, 2015. Baig S A. Adsorption performance and mechanism of arsenic from water using iron/iron-oxide amended composite adsorbents [D]. Hangzhou: Zhejiang University, 2015.
[21] 张林楠,张 力,王明玉,等.铜渣的处理与资源化 [J]. 矿产综合利用, 2005,(5):22-27. Zhang L N, Zhang L, Wang M Y, et al. Treatment and resourceful disposal of copper slag [J]. Multipurpose Utilization of Mineral Resources, 2005,(5):22-27.
[22] Jeon C S , Baek K , Park J K , et al. Adsorption characteristics of As(V) on iron-coated zeolite [J]. Journal of Hazardous Materials, 2009, 163(2/3):804-808.
[23] 冯彦房,薛利红,杨 梖,等.载镧生物炭的优化制备及其对水体中砷的吸附 [J]. 中国环境科学, 2015,35(8):2433-2441. Feng Y F, Xue L H, Yang B, et al. Optimized preparation of lanthanum uploaded biochar and its application in adsorbing pentavalent arsenic ions from aqueous solution [J]. China Environmental Science, 2015, 35(8):2433-2441.
[24] Dixit S, Hering J G. Comparison of Arsenic(V) and Arsenic(III) sorption onto iron oxide minerals: Implications for arsenic mobility [J]. Environmental Science & Technology, 2003,37(18):4182.
[25] 国家环境保护总局.《固体废物浸出毒性浸出方法硫酸硝酸法》(HJ/T 299-2007) [R]. 北京:国家环境保护总局, 2007. China Environmental Protection Agency. Solid waste-extraction procedure for leaching toxicity-sulfuric acid & nitric acid method [R]. Beijing: China Environmental Protection Agency, 2007.
[26] 国家环境保护总局.《固体废物腐蚀性测定》(GB/T 15555.12-1995) [R]. 北京:国家环境保护总局, 2007. China Environmental Protection Agency. Identification standards for solid waste-identification for corrosivity [R]. Beijing: China Environmental Protection Agency, 2007.
[27] Mercadoborrayo B M, Schouwenaars R, Gonzálezchávez J L, et al. Multi-analytical assessment of iron and steel slag characteristics to estimate the removal of metalloids from contaminated water [J]. Environmental Letters, 2013,48(8):887-895.
[28] Oh C, Rhee S, Oh M, et al. Removal characteristics of As(III) and As(V) from acidic aqueous solution by steel making slag [J]. Journal of Hazardous Materials, 2012,213-214:147-155.
[29] Guan X H, Su T Z, Wang J M. Quantifying effects of pH and surface loading on arsenic adsorption on NanoActive alumina using a speciation-based model [J]. Journal of Hazardous Materials, 2009, 166(1):39-45.
[30] Jing C, Liu S, Meng X. Arsenic leachability and speciation in cement immobilized water treatment sludge [J]. Chemosphere, 2005,59(9): 1241-1247.
[31] Liu Q, Gao J, Gu F, et al. One-pot synthesis of ordered mesoporous Ni–V–Al catalysts for CO methanation [J]. Journal of Catalysis, 2015,326(JUN):127-138.
[32] 国家环境保护总局.《危险废弃物鉴别标准浸出毒性鉴别》(GB/T 5085. 3-2007) [R]. 北京:国家环境保护总局, 2007. China Environmental Protection Agency. Identification standards for hazardous weastes-identification for extraction toxicity [R]. Beijing: China Environmental Protection Agency, 2007.
[33] Guo Z, Pan J, Zhu D, et al. Mechanism of composite additive in promoting reduction of copper slag to produce direct reduction iron for weathering resistant steel [J]. Powder Technology, 2018,329:55-64.
[34] Lee C G, Alvarez P J J, Nam A, et al. Arsenic(V) removal using an amine-doped acrylic ion exchange fiber: Kinetic, equilibrium, and regeneration studies [J]. Journal of Hazardous Materials, 2017,325: 223-229.
[35] Mohan D, Charles U. Pittman Jr. Arsenic removal from water/ wastewater using adsorbents-A critical review [J]. Journal of Hazardous Materials, 2007,142(1):1-53.
[36] Kim E J, Hwang B R, Baek K. Effects of natural organic matter on the coprecipitation of arsenic with iron [J]. Environmental Geochemistry and Health, 2015,37(6):1029-1039.
[37] Marinkov N, Markova-Velichkova M, Gyurov S, et al. Preparation and characterization of silicagel from silicate solution obtained by autoclave treatment of copper slag [J]. Journal of Sol-Gel Science and Technology, 2018,87(2):331-339.
[38] Yang J Q, Cai L Y, Li Q Z, et al. Redox behavior and chemical species of arsenic in acidic aqueous system [J]. Transactions of Nonferrous Metals Society of China, 2017,27(9):2063-2072.
[39] Thirunavukkarasu O S, T. Viraraghavan, K. S. Subramanian. Arsenic removal from drinking water using iron oxide-coated sand [J]. Water Air & Soil Pollution, 2003,142(1-4):95-111.
[40] Chai L, Yang J, Zhang N, et al. Structure and spectroscopic study of aqueous Fe(III)-As(V) complexes using UV-Vis, XAS and DFT- TDDFT [J]. Chemosphere, 2017:S0045653517307130.
[41] Khoe G H, Robins R G. ChemInform abstract: The complexation of iron(III) with sulfate, phosphate, or arsenate Ion in sodium nitrate medium at 25ºC [J]. Cheminform, 1988,19(45):2015-2021.
[42] 王丹赫,张宏华,林建伟,等.四氧化三铁改性沸石改良底泥对水中磷酸盐的吸附作用 [J]. 环境科学, 2018,39(11):5024-5035. Wang D H, Zhang H H, Lin J W, et al. Adsorption of phosphate from aqueous solutions on sediments amended with magnetite-modified zeolite [J]. Environmental Science, 2018,39(11):5024-5035.
[43] 玛依拉·麦麦提热依木,迪丽努尔·塔力甫,阿布力克木·阿布力孜. 煤质炭制备条件的优化及对酚类吸附性能与吸附动力学 [J]. 环境工程学报, 2016,(3):1281-1288. Mayila Maimaitireyimu, Dilinuer Talipu, Abulikemu Abulizi. Optimization preparation conditions of coal activated carbon and adsorption [J]. Chinese Journal of Environmental Engineering, 2016, (3):1281-1288.
[44] 舒 琳,等.低品位锰矿吸附砷(Ⅲ)的化学机理研究 [J]. 广西大学学报(自然科学版), 2016,41(5):1689-1695. Shu L, et al. Chemical adsorption mechanism of low-grade manganese ore on arsenic [J]. Journal of Guangxi University(Natural Science Edition), 2016,41(5):1689-1695.
[45] 张 昱,豆小敏,杨 敏,等.砷在金属氧化物/水界面上的吸附机制Ⅰ.金属表面羟基的表征和作用 [J]. 环境科学学报, 2006,26(10): 1586-1591. Zhang Y, Dou X M, Yang M, et al. Adsorption mechanism of arsenic on metal oxide adsorbent I. Characterization and the role of metal surface hydroxyl groups [J]. Acta Scientiae Circumstantiae, 2006, 26(10):1586-1591.
[46] 刘慧利,胡建杭,王 华,等.铜渣煅烧过程中的多相转变 [J]. 中南大学学报(自然科学版), 2013,(8):3159-3165. Liu H L, Hu J H, Wang H, et al. Multiphase transformation during process of copper slag calcination [J]. Journal of Central South University of Science and Technology, 2013,(8):3159-3165.
[47] Zhang F S, Hideaki Itoh. Iron oxide-loaded slag for arsenic removal from aqueous system [J]. Chemosphere, 2005,60(3):319-325.
[48] Jia Y, Li Xu, Xin Wang, et al. Infrared spectroscopic and X-ray diffraction characterization of the nature of adsorbed arsenate on ferrihydrite [J]. Geochimica Et Cosmochimica Acta, 2007,71(7):1643- 1654.
[49] Goldberg S, Johnston C T. Mechanisms of arsenic adsorption on amorphous oxides evaluated using macroscopic measurements, vibrational spectroscopy, and surface complexation modeling [J]. J Colloid Interface Sci, 2001,234(1):204-216.
[50] Singhania S, Wang Q, Filippou D, et al. Temperature and seeding effects on the precipitation of scorodite from sulfate solutions under atmospheric-pressure conditions [J]. Metallurgical & Materials Transactions B, 2005,36(3):327-333.
[51] 朱慧杰,贾永锋,吴 星,等.负载型纳米铁吸附剂去除饮用水中As(Ⅲ)的研究 [J]. 环境科学, 2009,30(12):3562-3567. Zhu H J, Jia Y F, Wu X, et al. Removal of arsenite from drinking water by activated carbon supported nano zero-valent iron [J]. Environmental Science, 2009,30(12):3562-3567.
Reaction behavior of copper slag with waste acid and its arsenic removal mechanism.
LI Yong-kui1,2, ZHU Xing1,2*, QI Xian-jin1,2, WANG Hua1,2, ZHANG Xin3, HUI Xing-huan3, HAO Feng-yan1,2, CAI Gui-yuan1,2
(State Key Laboratory of Complex Nonferrous Metal Resources Clean Utilization, Kunming University of Science and Technology, Kunming 650093, China;2.Faculty of Metallurgical and Energy Engineering, Kunming University of Science and Technology, Kunming 650093, China;3.Chuxiong Dianzhong Non-ferrous Metal Co. Ltd, Chuxiong 675000, China)., 2019,39(10):4228~4238
On the basis of composition and phase characteristics of copper slag, the reaction behavior of copper slag with arsenic-containing waste acid and the rule of arsenic removal were investigated, and the reaction kinetics of arsenic removal was also elucidated. Under optimal conditions, including a copper slag dosage of 0.2g/mL, a reaction temperature at 23ºC, and a reaction time of 24hours, a maximum adsorption capacity of copper slag of 25.89mg/g was achieved, following by an arsenic removal efficiency of 99.56%. The leaching toxicity of arsenic-fixed copper slag was lower than 5mg/L that is the standard threshold value of hazardous waste. The arsenic-fixed copper slag could be classified as a general solid waste. The kinetic studies revealed that the arsenic adsorption on the copper slag was described by a pseudo-second-order kinetic equation. The process of arsenic removal was limited by the release rate of iron ion. Arsenic was removedthe ion exchange adsorption and the chemical precipitation, which were also beneficial to the arsenic stabilization. A large number of iron ions were released during the solid-liquid reaction between copper slag and waste acid, which could precipitate arsenicthe ion exchange adsorption and the chemical precipitation, forming relative stable arsenates and their derivatives for the arsenic removal. The copper slag exhibits a superior performance for the arsenic removal from waste acid and provides a high-efficient and low-cost method for the disposal of waste acid from heavy non-ferrous smelting industry.
copper slag;arsenic-containing waste acid;arsenic removal;kinetics
X705
A
1000-6923(2019)10-4228-11
李永奎(1993-),男,云南红河人,昆明理工大学冶金与能源工程学院硕士研究生,主要从事固体废物资源化利用研究.
2019-03-29
国家自然科学基金资助项目(51764036);昆明理工大学校企基金项目(KKZ4201552002)
* 责任作者, 副教授, zhuxing2010@hotmail.com
