不同炒制程度下决明子中11 种成分含量变化研究*
2019-10-22秦昆明李伟东郑艳萍金俊杰蔡宝昌
杨 冰,秦昆明,李伟东,3,郑艳萍,金俊杰,3**,蔡宝昌,**
(1.南京中医药大学国家教育部中药炮制规范化及标准化工程研究中心 南京210023;2.南京海昌中药集团有限公司 南京 210061;3.江苏海昇药业有限公司南京 210061;4.淮海工学院药学院 连云港 222005)
决明子为豆科植物决明Cassia obtusi foliaL.或小决明Cassia toraL.的干燥成熟种子,具清热明目、润肠通便的功效[1]。现代研究表明,决明子具有多种药理作用[2],如降血脂[3]、降血压[4]、抗氧化[5]、保肝[6]及抑菌[7]等。决明子含蒽醌类、萘骈吡喃酮类、脂肪酸类、氨基酸和无机元素等,其主要成分为蒽醌类及萘骈吡喃酮类成分[8]。
炒决明子为决明子的炮制品,决明子炒制后能缓和寒泻之性,具有平肝养目的功效[8]。生、炒决明子功效各异,主要在于炒制过程中决明子内化学成分的含量发生变化。根据2015年版《中华人民共和国药典》,决明子按照清炒法,炒至微鼓起、有香气[1]即可,但没有规定明确的炒制温度及炒制时间。为探究决明子炒制过程中化学成分变化规律,并有效地控制生、炒决明子饮片的质量,本课题组采用高效液相色谱法对生决明子及其不同炒制程度的炒决明子中11 种化学成分进行含量测定,揭示炒制温度及炒制时间对决明子中主要成分的影响,寻找决明子在不同炒制温度及炒制时间下11种成分的含量变化规律,并为炒决明子质量评价及质量标准的制定提供依据。
1 仪器与试药
Shimadzu LC-20AB 高效液相色谱系统(岛津公司,包括在线脱气机、Prominence SIL-20A 自动进样器、SPD-M20A 二极管阵列检测器、CTO-20A 柱温箱);Shimadzu LC-20AD高效液相色谱仪(SPD-20A紫外-可见光检测器,岛津LC-Solusion 工作站);BP121S电子分析天平(梅特勒-托雷多公司);KQ5200DB型数控超声波清洗器(昆山市超声仪器有限公司);DY-20流水式中药打粉机(温岭市奥力中药器械有限公司);YMC-Pack-ODS-A C18色谱柱(250 mm×4.6 mm,5 μm,以十八烷基硅烷键合硅胶为填料)(YMC Co.Ltd,Japan);Fluke 62MAX 红外测温仪(珠海天创仪器有限公司)。
乙腈、甲醇及无水乙醇均为色谱纯,水为超纯水,磷酸、甲酸等均为分析纯,购自南京维之诚化学试剂有限公司。对照品决明素(批号:170813,纯度≥98.0% )、决明子苷(批号:161215,纯度99.0% )、决明子苷B2(批号:161219,纯度98.5% )、决明子苷C(批号:161215,纯度98.8% )及红链霉素-龙胆二糖苷(批号:170312,纯度97.6% )购自成都昂赛思生物科技有限公司,大黄素(批号:140728,纯度98.0% )、大黄酚(批号:130406,纯度98.0% )、橙黄决明素(批号:170304,纯度98.0% )、大黄素甲醚(批号:131227,纯度98.0% )、黄决明素(批号:170306,纯度98.0% )、美决明子素(批号:170326,纯度98.0% )均购自南京森贝伽生物科技有限公司。

图1 混合对照品(A)决明子样品(B)HPLC 色谱图
决明子饮片(批号:20160608)购自铜陵禾田中药饮片股份有限公司,产地为河南洛阳,经南京海源中药饮片有限公司丁斐中药师鉴定,为豆科植物决明Cassia obtusi foliaL.的干燥成熟种子。不同炒制程度的炒决明子饮片于南京海源中药饮片有限公司实验室自制,方法如下:称取6 份决明子饮片,每份200 g,采用红外测温仪测定温度,于140℃热锅下药,不断翻炒,待药温达到140℃开始计时,分别持续此温度3、5、8、10、12、15 min,出锅,制备得到6份140℃不同炒制时间的决明子饮片,上述过程重复3 次,将相同炒制程度下的3份样品混合。160℃及180℃不同炒制时间的决明子饮片均按此法炒制。制备得到的不同炒制程度的炒决明子饮片表面暗棕色,偶见焦斑,整体颜色随着炒制温度升高及炒制时间的延长而加深,均符合2015 版《中华人民共和国药典》中炒决明子的性状特征。生决明子及不同炒制程度的炒决明子饮片粉碎,过50目筛。
2 方法与结果
2.1 色谱条件
色谱柱YMC-Pack ODS-A C18柱(250×4.6 mm,5 μm);流动相选用乙腈(A)-0.1% 甲酸水溶液(B)进行梯度洗脱,洗脱程序:0-10 min,15% -25% (A);10-15 min,25% -26% (A);15-35 min,26% -26% (A);35-45 min,26% -45% (A);45-50 min,45% -45% (A);50-70 min,45% -55% (A);70-90 min,55% -85% (A);90-95 min,85% -100% (A);95-110 min,100% -15% (A);110-120 min,15% -15% (A);流速:0.5 mL·min-1;检测波长:284 nm;柱温:30℃;进样量:10 μL。混合对照品及决明子的色谱图(图1)。
3.2 混合对照品溶液的制备
分别取待测成分的对照品适量,精密称定,加甲醇溶解,配制成质量浓度分别为决明子苷64.80 μg·mL-1,决明子苷B2100.00 μg·mL-1,决明子苷C 99.20 μg·mL-1,红链霉素-龙胆二糖苷131.76 μg·mL-1的苷类混合对照品溶液及浓度分别为决明素10.48 μg·mL-1,黄决明素12.62 μg·mL-1,橙黄决明素26.82 μg·mL-1,美决明子素μg·mL-1,大黄素28.20 μg·mL-1,大黄酚44.00 μg·mL-1,大黄素甲醚13.65 μg·mL-1的苷元类混合对照品溶液,冷藏(4℃),备用。
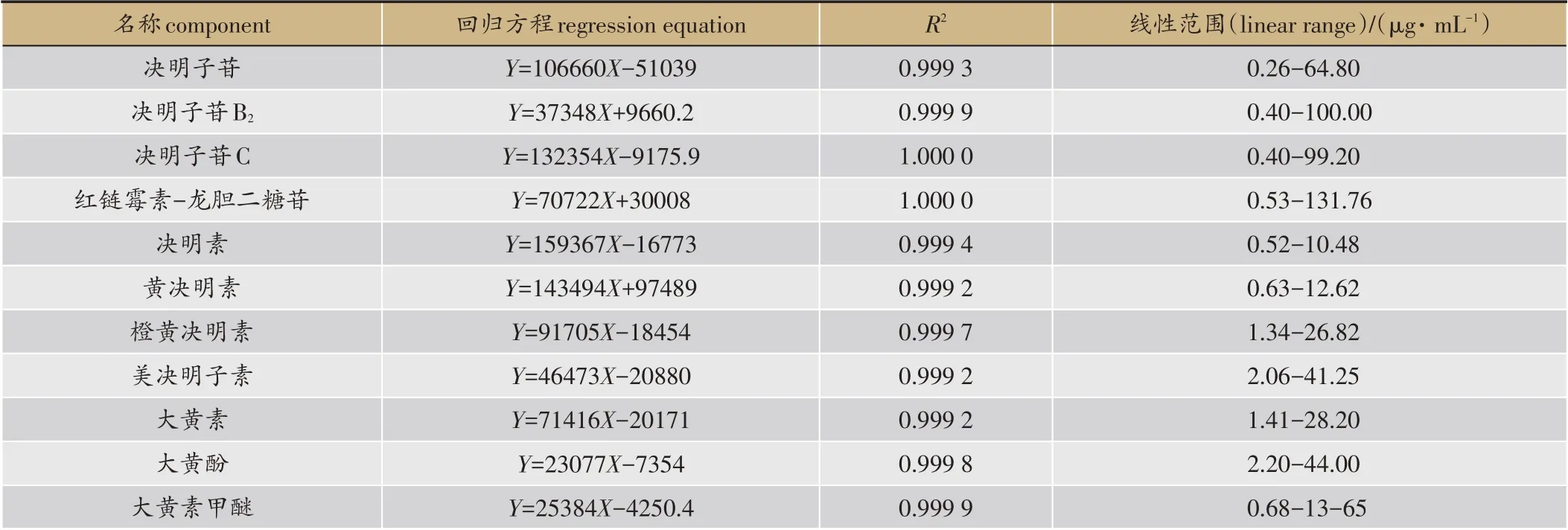
表1 回归方程及线性范围
2.3 供试品溶液的制备
取决明子或炒决明子粉末(50 目)于60℃烘干至恒重,精密称0.5 g,置于锥形瓶中,加85% 乙醇30 mL,超声30 min,过滤,取滤液过0.45 μm微孔滤膜,即得供试品溶液,备用。
2.4 线性关系考察
精密吸取混合对照品贮备液,依次稀释,制备成包括母液在内的7 份不同浓度的混合对照品溶液,并按上述色谱条件测定峰面积,以峰面积(Y)对分析物浓度(X)作线性回归,求回归方程及线性相关系数,结果(表1)。
2.5 精密度试验
精密吸取“2.2”项下的混合对照品溶液10 μL,按照“2.1”项下色谱条件连续进样6次,结果显示:决明子苷、决明子苷B2、决明子苷C、红链霉素-龙胆二糖苷、决明素、黄决明素、橙黄决明素、美决明子素、大黄素、大黄酚、大黄素甲醚的峰面积的RSD 分别为2.02% 、1.39% 、0.72% 、1.72% 、1.91% 、1.17% 、1.23% 、2.04% 、0.36% 、0.53% 、0.52% ,表明仪器的精密度良好。
2.6 稳定性试验
取决明子供试品溶液,分别在0、2、8、16、36、48 h进样测定,记录决明子苷、决明子苷B2、决明子苷C、红链霉素-龙胆二糖苷、决明素、黄决明素、橙黄决明素、美决明子素、大黄素、大黄酚、大黄素甲醚的峰面积,计算峰面积的RSD 分别为0.39% 、0.92% 、2.28% 、0.50% 、0.20% 、1.02% 、1.21% 、0.63% 、1.72% 、0.48% 、1.77% ,表明供试品溶液48 h内稳定。
2.7 重复性试验
精密称取决明子粉末0.5 g,共6 份,分别按照“2.3”项下方法制备供试品溶液,以“2.1”项下的色谱条件进样测定。结果决明子苷、决明子苷B2、决明子苷C、红链霉素-龙胆二糖苷、决明素、黄决明素、橙黄决明素、美决明子素、大黄素、大黄酚、大黄素甲醚的RSD分别为0.99% 、1.05% 、2.33% 、0.94% 、0.98% 、1.14% 、1.25% 、0.85% 、1.35% 、1.46% 、1.28% ,表明方法的重复性良好。
2.8 回收率试验
精密称取决明子粉末0.25 g,共6 份,精密加入对照品适量(与0.25 g 决明子中各成分含量相当),按“2.3”项下方法制备供试溶液,在上述色谱条件下进样分析,计算回收率。结果决明子苷、决明子苷B2、决明子苷C、红链霉素-龙胆二糖苷、决明素、黄决明素、橙黄决明素、美决明子素、大黄素、大黄酚、大黄素甲醚的平均回收率分别为101.44% 、100.66% 、101.33% 、101.15、99.55% 、100.49% 、99.09% 、99.34% 、100.43% ,100.84% 、103.60% ,RSD 分别为2.26% 、2.65% 、2.08% 、1.94% 、2.40% 、2.69% 、2.72% 、2.44% 、2.89% 、1.91% 、1.95% ,表明方法的回收率良好(表3)。
2.9 样品含量测定
精密称取决明子及不同炒制程度的炒决明子粉末约0.5 g,按照“2.3”项下方法制备供试品溶液,以“2.1”项下色谱条件进样测定,按“2.4”项下回归方程计算决明子苷、决明子苷B2、决明子苷C、红链霉素-龙胆二糖苷、决明素、黄决明素、橙黄决明素、美决明子素、大黄素、大黄酚、大黄素甲醚的含量,结果(表2、图2)。

表2 决明子及炒决明子中11个活性成分的含量(mg·g-1,n=3)
由含量测定结果可知,在决明子炒制过程中决明子苷、决明子苷B2、决明子苷C 及红链霉素-龙胆二糖苷4种苷类成分的含量整体呈下降趋势,尤其在160℃及180℃炒制温度下4 种成分的含量下降较为明显。决明素、黄决明素、橙黄决明素、美决明子素及大黄素5种苷元类成分的含量在决明子不同炒制程度下变化较小,但以180℃炒制时含量略高。大黄酚及大黄素甲醚2 种苷元类成分在决明子炒制过程中变化显著,且随着炒制温度升高,大黄酚及大黄素甲醚的含量也逐渐升高。决明素、黄决明素、橙黄决明素、美决明子素、大黄素、大黄酚及大黄素甲醚7 种苷元类成分在药温为180℃下炒制8 min 时均出现含量突增现象,之后其含量保持平稳或缓慢增加。
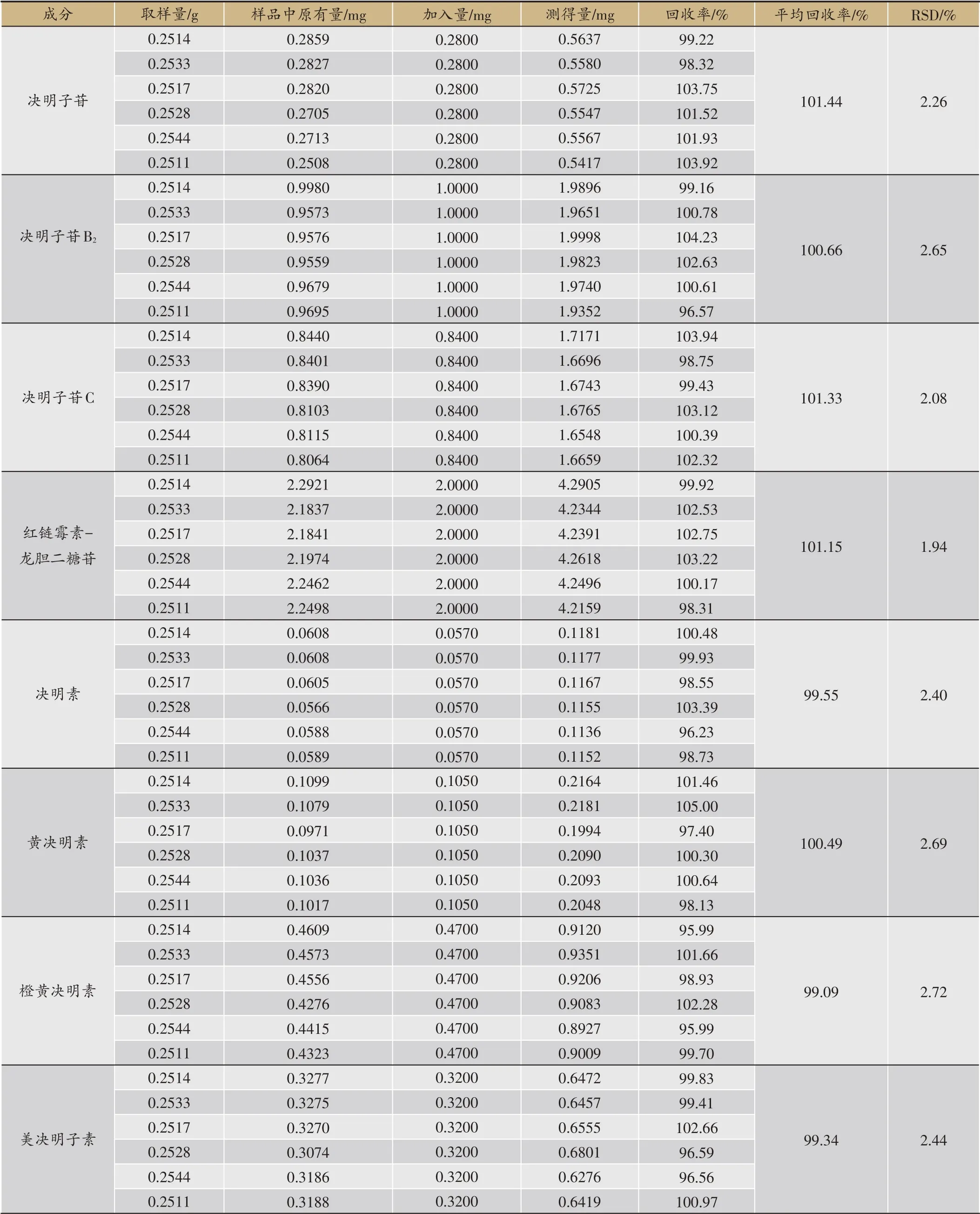
表3 加样回收率试验结果(n=6)

续表3
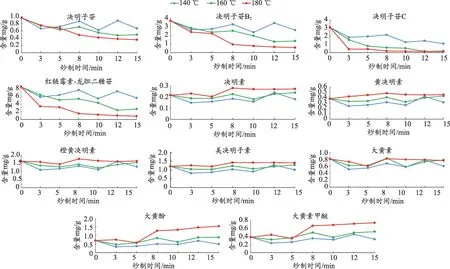
图2 不同炒制程度下决明子中11种成分变化趋势图
纵观11 种化学成分的变化趋势,决明子在180℃炒制时,其内的11种成分变化较为显著,其中180℃变炒制8 min是决明子中11种化学成分变化的关键时间点,8 min后11种化学成分的含量则相对稳定。
3 讨论
2015 版《中华人民共和国药典》中决明子项下并未对炒决明子的炮制工艺进行量化阐述,仅用“取净决明子,照清炒法炒至微鼓起、有香气”表述。本研究在不同炒制温度(药温)及炒制时间下对决明子进行炮制,制备得到18 种不同炒制程度的炒决明子,采用高效液相对其内的11种成分进行含量测定,发现不同炒制程度下的炒决明子中决明子苷、决明子苷B2、决明子苷C、红链霉素-龙胆二糖苷、决明素、黄决明素、橙黄决明素、美决明子素、大黄素、大黄酚及大黄素甲醚11种成分的含量差异显著,整体呈现出苷类成分含量下降及苷元类成分含量上升的趋势,且炒制温度及炒制时间均可影响炒决明子中11种成分的含量,其中炒制温度对成分含量的影响较为明显。此外,有研究发现决明子中含有糖苷酶,但在炮制过程中糖苷酶并未发挥作用,而炮制中的高温条件是造成决明子炮制后苷类成分含量降低、苷元成分含量升高的主要原因,即高温使苷类成分的苷键断裂产生对应的苷元[9],此结果进一步体现在决明子炮制过程中对炒制温度控制的重要性。
物质基础的变化与中药的药效或药性密切相关。在决明子炮制过程中,不同的炮制温度及炮制时间均会导致决明子物质基础的改变,而物质基础不同必然导致药效差异。既往的生/炒决明子药效研究中存在炮制增效、炮制减效及炮制后药效相当等诸多争议,本研究在将决明子于140℃、160℃及180℃分别炒制3、5、8、10、12、15 min,结果发现以上不同程度的炒决明子均符合2015版《中华人民共和国药典》规定的“炒制微鼓起、有香气”,而检测结果显示不同炒制程度下决明子主要成分存在较大差异,故而考虑既往文献中药效争议可能与研究者采用的炒决明子的炮制程度有关。在决明子炮制过程中,物质基础的量变可能会引起药效的质变,故炮制过程化学研究对揭示中药炮制的机制具有重要作用。因此简单地用“炒制微鼓起、有香气”对炒决明子的炮制终点进行判断是不合理的,为规范炒决明子的炮制工艺及保证炒决明子的质量稳定,需对炒决明子的炮制过程进行量化,在炒决明子饮片的实际生产中,在固定投料量的基础上,规范决明子炒制的温度及炒制时间。
