HPLC法测定新型兽用蒿甲醚注射液中蒿甲醚含量
2017-09-01王嗣涵周绪正杨孝朴张继瑜
王嗣涵,李 冰,周绪正,杨孝朴,张继瑜*
(1.甘肃农业大学 动物医学院,甘肃 兰州 730070; 2.中国农业科学院 兰州畜牧与兽药研究所/农业部兽用药物创制重点实验室,甘肃 兰州 730050)
HPLC法测定新型兽用蒿甲醚注射液中蒿甲醚含量
王嗣涵1,2,李 冰2,周绪正2,杨孝朴1,张继瑜1,2*
(1.甘肃农业大学 动物医学院,甘肃 兰州 730070; 2.中国农业科学院 兰州畜牧与兽药研究所/农业部兽用药物创制重点实验室,甘肃 兰州 730050)
为建立新型兽用蒿甲醚注射液中蒿甲醚含量的高效液相色谱测定方法,采用Hypersil ODS C18色谱柱(5 μm,4.6 mm×150 mm),流动相为乙腈-水-四氢呋喃(体积比为62∶37∶1),柱温30 ℃,流速1.0 mL/min,检测波长216 nm。测定结果显示,蒿甲醚在该色谱条件下系统适应性好,在质量浓度为100~800 μg/mL时线性关系良好,回归方程为y=302.36x-682.02,R2=0.999 8;总平均回收率为97.58%,RSD为1.58%;对3批样品的蒿甲醚含量进行测定,RSD为1.42%。表明建立的方法可用于新型蒿甲醚注射液中蒿甲醚含量的测定。
蒿甲醚注射液; 高效液相色谱法; 含量测定
青蒿素于1971年首次从菊科植物黄花蒿(ArmisiaannuaL.)中分离提取,对疟原虫红细胞内裂殖体的杀灭作用较好。随后人们又以青蒿素为先导化合物合成了许多衍生物,蒿甲醚(artemether)是其中之一[1]。1987年9月11日,我国卫生部举行青蒿素及其衍生物新闻发布会,正式宣布批准蒿甲醚注射液作为治疗各种危重疟疾病人的特效药投入大批量生产。同年,世界卫生组织(WHO)对蒿甲醚的药效进行严格验证,并认定蒿甲醚为疗效最好的抗疟药品。蒿甲醚成为我国第一个国际注册的制剂药品[2]。在人药领域蒿甲醚主要用于疟原虫的治疗,能快速消除寄生虫血症[3-4]。
目前,蒿甲醚尚未应用到兽药领域。中国农业科学院兰州畜牧与兽药研究所研制了新型蒿甲醚注射液以用于兽医临床,因此,急需建立测定制剂中蒿甲醚含量的方法。参考人药蒿甲醚制剂含量测定方法[5-8],依据《中华人民共和国药典(二部)》[9]和《兽药研究技术指导原则汇编(2006—2011年)》[10]中的质量控制指导原则,研究蒿甲醚含量的测定方法,旨在为新型蒿甲醚注射液的临床应用奠定基础。
1 材料和方法
1.1 药品、试剂
蒿甲醚标准品(含量99.3%,批号100271-201404)购自中国药品生物制品检定所;蒿甲醚新型注射液(批次20141225、20150121、20150202)、不含蒿甲醚的对照注射液(批次20141223)及80%、100%、120%的蒿甲醚新型注射液(批次20141223、20141224、20141225)均由中国农业科学院兰州畜牧与兽药研究所研制;Watsons纯水为广州屈臣氏食品饮料有限公司产品;乙醇、乙腈、四氢呋喃均为色谱纯,为Fisher Scientific公司产品。
1.2 仪器设备
Waters2695高效液相色谱仪、Waters2489紫外可见光检测器、Empower2色谱工作站均为Waters 公司产品;Hypersil ODS C18色谱柱(5 μm,4.6 mm×150 mm)为大连依利特分析仪器有限公司产品;Sartorius ME235S电子天平为北京赛多利斯天平有限公司产品;KQ-300DE超声波清洗器为昆山市超声仪器有限公司产品;溶剂过滤系统为Phenomen公司产品。
1.3 试验方法
1.3.1 色谱条件 柱温为30 ℃,进样量为10 μL,检测波长为216 nm,流动相为乙腈-水-四氢呋喃(体积比为62∶37∶1),流速为1 mL/min。
1.3.2 供试品溶液的配制 取蒿甲醚注射液(含量10%),精密移取0.4 mL蒿甲醚新型注射液于100 mL容量瓶中,用乙醇(含四氢呋喃10%)溶液稀释并定容至刻度,摇匀,配制成质量浓度为400 μg/mL的蒿甲醚注射液。经0.22 μm滤膜(尼龙)过滤后进样,进样量为10 μL。
1.3.3 系统适应性试验 精密称取蒿甲醚标准品(含量99.3%)0.050 04 g于50 mL容量瓶中,用乙醇(含四氢呋喃10%)溶液溶解并稀释至刻度,摇匀,配制质量浓度为1 mg/mL的蒿甲醚标准品储备液。再精密吸取储备液4.0 mL于10 mL量瓶中,用乙醇(含10%四氢呋喃)溶液稀释至刻度,摇匀,配制质量浓度为400 μg/mL的标准品溶液。进样前用0.22 μm的滤膜过滤,进样量为10 μL,记录色谱图,并计算理论塔板数。
1.3.4 杂质干扰试验 按照1.3.2的方法分别配制蒿甲醚新型注射液样品溶液和不含蒿甲醚的对照注射液样品溶液,进样量10 μL,分析不含蒿甲醚的对照注射液对蒿甲醚色谱峰是否有干扰。
1.3.5 标准品溶液的制备 取1.3.3中蒿甲醚标准品储备液,分别精密吸取储备液1.0、2.0、3.0、4.0、5.0、6.0、8.0 mL于10 mL量瓶中,乙醇(含10%四氢呋喃)溶液稀释至刻度,摇匀,配制质量浓度分别为100、200、300、400、500、600、800 μg/mL的工作液。
1.3.6 线性关系考察试验 在上述色谱条件下分别测定蒿甲醚标准品各质量浓度梯度溶液的峰面积,每个样品测定3次,以平均峰面积(y)为纵坐标,以质量浓度(x)为横坐标,进行线性回归。
1.3.7 精密度试验 将质量浓度为200、500、800 μg/mL的3个样品,在同日内不同时间进样5次,求得日内精密度。将这3个样品连续5 d进样,每天同一时间测定,求得日间精密度。
1.3.8 加样回收率试验 制备相当于蒿甲醚新型注射液含量80%、100%、120%的蒿甲醚新型注射液溶液,每个含量制备3份供试品,测定样品中蒿甲醚含量,计算回收率。
1.3.9 样品含量的测定 取各批次的蒿甲醚注射液按照上述的色谱条件及方法进行测定,每个批次平行测定3次。精密称取0.2 mL蒿甲醚注射液于50 mL容量瓶中,用乙醇(含10%四氢呋喃)溶液溶解并稀释至刻度,此溶液质量浓度为400 μg/mL。记录色谱峰面积,按照外标法以峰面积计算(外标法所用标准品溶液按照1.3.5的方法配制),同时测定其相对密度,计算样品含量。
2 结果与分析
2.1 系统适应性和杂质干扰试验结果
由图1可知,蒿甲醚标准品的保留时间约为8.1 min。由图2可知,不含蒿甲醚的对照注射液对蒿甲醚的HPLC测定无干扰。
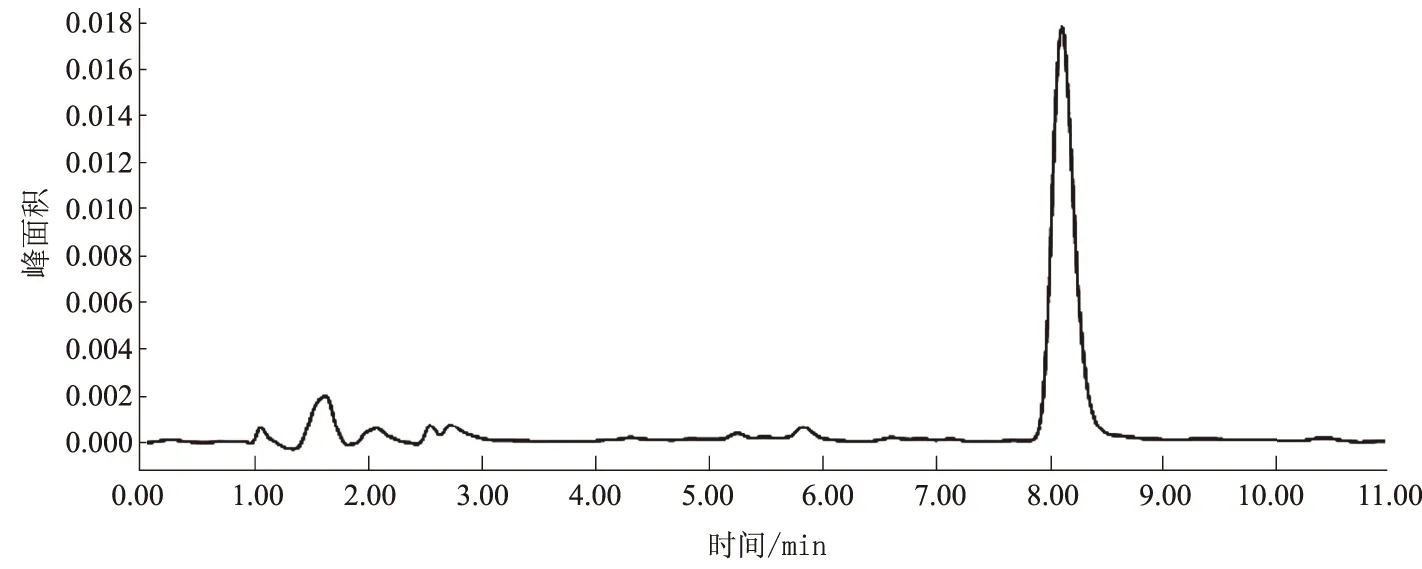
图1 蒿甲醚标准品色谱图
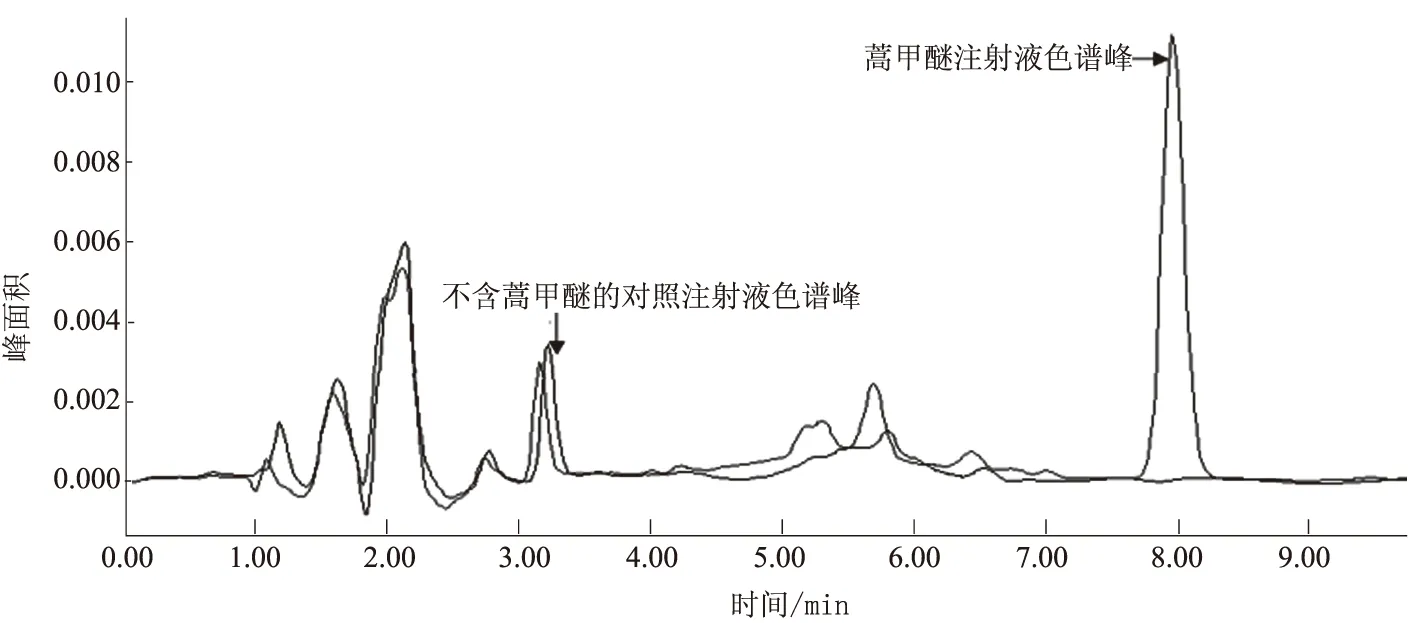
图2 蒿甲醚新型注射液和不含蒿甲醚的对照注射液色谱图
2.2 蒿甲醚的标准曲线
表1为测定的蒿甲醚标准品的质量浓度和平均峰面积,以平均峰面积(y)为纵坐标,以质量浓度(x)为横坐标,进行线性回归,得到回归方程y=302.36x-682.02(图3)。可见,蒿甲醚质量浓度为100~800 μg/mL时,线性关系良好。

表1 蒿甲醚标准品各质量浓度梯度及平均峰面积
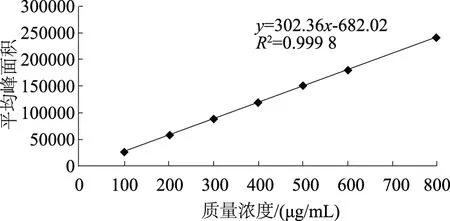
图3 蒿甲醚的标准曲线
2.3 精密度试验结果
由表2、表3可知,蒿甲醚日内精密度、日间精密度的RSD分别为1.29%、0.46%,均小于5%,符合方法学验证对精密度的要求。
2.4 加样回收率试验结果
由表4可知,含量为80%、100%、120%的蒿甲醚新型注射液中,蒿甲醚的回收率在95.87%~98.82%,总平均回收率为97.58%,RSD为1.58%。说明建立的含量测定方法准确度高,且符合回收率在80%~120%的要求。
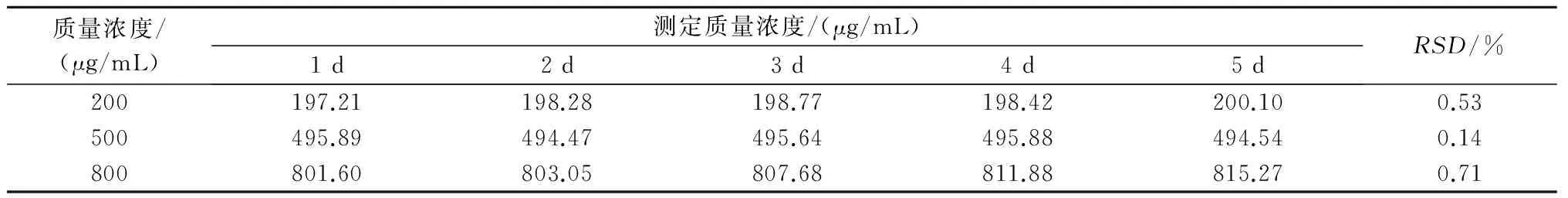
表2 日间精密度试验结果
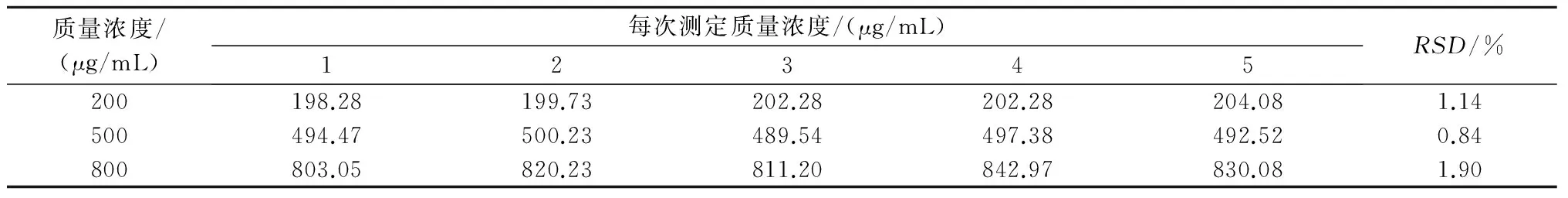
表3 日内精密度试验结果
2.5 样品中蒿甲醚含量测定结果
对3批蒿甲醚新型注射液产品进行含量测定,蒿甲醚的含量在97.27%~99.31%,RSD为1.42%(表5)。
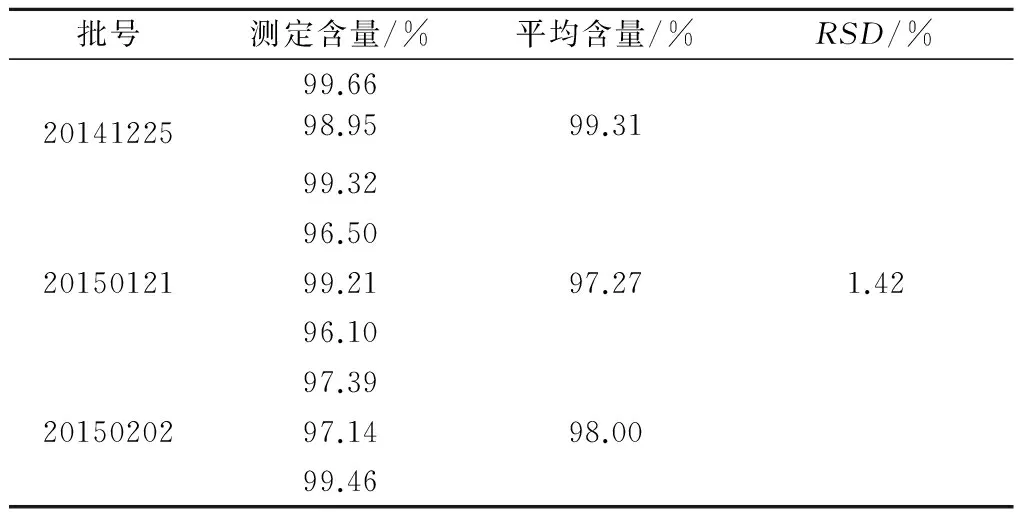
表5 样品中蒿甲醚含量测定结果
3 结论与讨论
本试验色谱条件参考《中华人民共和国药典(二部)》中人药蒿甲醚注射液的色谱条件,并依据药物注射液本身的特点和试验条件进行优化。由于蒿甲醚注射液主要辅料为医用注射茶油,用流动相溶解注射液并不完全,会形成乳浊液,影响含量测定的准确性,有研究报道,使用无水乙醇并超声约2 min能形成澄清的溶液[5]。本试验发现,单一使用无水乙醇并超声只是将乳浊液油滴由大变小,并不能彻底溶解;先用四氢呋喃溶解茶油,再加入乙醇稀释至刻度,可完全溶解注射液中的油剂,且无需超声溶解。同时使用四氢呋喃和乙醇2种溶剂,所以在色谱出峰前2.5 min会有部分溶剂峰。《中华人民共和国药典(二部)》中规定的HPLC法测定蒿甲醚的流动相为乙腈-水(体积比为62∶38),为了溶解注射液中的茶油,溶剂中含有四氢呋喃,故本试验将流动相组分中加入了1%的四氢呋喃,流动相为乙腈-水-四氢呋喃(体积比为62∶37∶1)。加入四氢呋喃后,蒿甲醚出峰时间提前约0.5 min。前人也有研究报道[11-15],适当增大有机相比例,减小水相比例可避免蒿甲醚色谱峰峰形拖尾。
注射液中90%成分是医用注射茶油,茶油属不干性油,主要由油酸甘油酯构成,饱和酸构成的酯(固体酯)含量较少,茶油中容易自动氧化的多不饱和脂肪酸含量较低(碘价较低),比其他液态油稳定,对皮肤的剌激小[16-20]。茶油本身也会出现色谱峰,但色谱出峰时间与蒿甲醚不同,因而不影响后期的蒿甲醚含量测定。
由本试验结果可知,试验中蒿甲醚的含量测定方法的方法学验证符合要求,方法可靠、选择性好、重现性好、操作简便,可用于蒿甲醚注射液中蒿甲醚的含量测定,为注射液的质量评价和质量标准的制定奠定了基础,并为其进一步研究和开发提供了依据。
[1] 屠呦呦.青蒿及青蒿素类药物[M].北京:化学工业出版社,2009:227-235.
[2] 向刚,李南高,王存志,等.试论蒿甲醚技术创新过程及其对我国新药自主创新的启示[J].科研管理,1997(4):30-35.
[3] William T,Menon J,Rajahram G,etal.Severe plasmodium knowlesi malaria in a tertiary care hospital,Sabah,Malaysia[J].Emerging Infectious Diseases,2011,17(7):1248-1255.
[4] 张亚红,王丽娟,甘淋玲,等.蒿甲醚及其制剂的临床应用研究进展[J].重庆医学,2014,43(29):3967-3970.
[5] 姚静,程奇蕾,张启明,等.HPLC法测定蒿甲醚注射液的含量[J].药物分析杂志,2008(1):91-92.
[6] 王效义,王云玲.高效液相色谱法测定蒿甲醚含量方法的研究[J].解放军药学学报,1999,15(4):7-9.
[7] 周琳,张小松.HPLC测定蒿甲醚胶丸的含量[J].华西药学杂志,2005,20(4):341-343.
[8] 钟飞,鲍光明,党明殊.蒿甲醚胶囊的制备及其含量研究[J].海南师范大学学报(自然科学版),2012,25(4):402-406.
[9] 国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:1451-1452.
[10] 农业部兽药评审中心.兽药研究技术指导原则汇编(2006—2011年)[M].北京:化学工业出版社,2012:32-37.
[11] Li B,Zhang J,Zhou X Z,etal.Determination and pharmacokinetic studies of artesunate and its metabolite in sheep plasma by liquid chromatography-tandem mass spectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci,2015,997:146-153.
[12] 李春,邱玉琴,杨国忠,等.超高效液相色谱-质谱联用技术同时检测大鼠血浆中蒿甲醚及其主要代谢产物双氢青蒿素[J].分析化学,2015,43(4):588-593.
[13] 杨华生,王乃婕,梁秉文,等.蒿甲醚贴剂的研制及小鼠体内药效学研究[J].中国药学杂志,2008,43(24):1878-1881.
[14] Sandrenan N,Sioufi A,Godbillon J,etal.Determination of artemether and its metabolite,dihydroartemisinin,in plasma by high-performance liquid chromatography and electrochemical detection in the reductive mode[J].J Chromatogr B Biomed Sci Appl,1997,691(1):145-153.
[15] 程培培,杨亚军,李剑勇.新型复方氟苯尼考注射液中氟尼辛葡甲胺含量测定方法研究[J].河南农业科学,2014,43(3):142-146.
[16] 杨华,谭先杰.青蒿素及其衍生物的抗肿瘤特性研究进展[J].中国医学科学院学报,2013,35(4):466-471.
[17] 许春燕,刘希望,杨亚军,等.银翘蓝芩口服液中绿原酸含量测定方法的建立[J].河南农业科学,2016,45(11):126-129.
[18] El-Beshbishi S N,Taman A,El-Malky M,etal.Invivoeffect of single oral dose of artemether against early juvenile stages ofSchistosomamansoniEgyptian strain[J].Experimental Parasitology,2013,135(2):240-245.
[19] 钟丹,蒋孟良,王霆.茶油的化学成分、药理作用及临床应用研究进展[J].中南药学,2012,10(4):299-303.
[20] 吴雪辉,周薇,李昌宝,等.茶油的氧化稳定性研究[J].中国粮油学报,2008,23(3):96-99.
Determination of Artemether Content in Artemether Injection by HPLC
WANG Sihan1,2,LI Bing2,ZHOU Xuzheng2,YANG Xiaopu1,ZHANG Jiyu1,2*
(1.College of Veterinary Medicine,Gausu Agricultural University,Lanzhou 730070,China; 2.Lanzhou Institute of Husbandry and Pharmaceutical Sciences,Chinese Academy of Agricultural Sciences/Key Laboratory of New Animal Drug Discovery,Ministry of Agriculture,Lanzhou 730050,China)
To establish high performance liquid chromatography(HPLC)detection method for the determination of artemether in the artemether injection,the Hypersil ODS C18 chromatographic column(5 μm,4.6 mm×150 mm) was used.The component of mobile phase,column temperature,flow rate and the detection wave length were optimized.The results showed that the acetonitrile-water-tetrahydrofuran(62∶37∶1,V/V)was as mobile phase,the column temperature was 30 ℃,the flow rate was 1.0 mL/min and the detection wavelength was set at 216 nm.The HPLC detection system adaptability of artemether was good.In 100—800 μg/mL concentration range,the linearity was well,the regression equation wasy=302.36x-682.02,R2=0.999 8.Overall average recovery was 97.58% andRSDwas 1.58%.RSDof 3 batches of samples of artemether content determination was 1.42%.The method could be used to detect the content of artemether in artemether injection.
artemether injection; HPLC; content determination
2017-02-20
甘肃省科技支撑计划项目(1604NKCA069-02);国家现代农业产业技术体系专项(CAR-38);公益性行业(农业)科研专项(301303038-4)
王嗣涵(1991-),男,甘肃兰州人,在读硕士研究生,研究方向:兽医药理学。E-mail:wangshjaz@hotmail.com
*通讯作者:张继瑜(1967-),男,甘肃庆阳人,研究员,博士,主要从事兽医药理学研究。E-mail:infzjy@sina.com
S859.1
A
1004-3268(2017)08-0156-05
