佛手苷内酯对H9C2心肌细胞缺氧复氧损伤的保护作用及机制研究❋
2019-10-21黄莉婷王丽岳张博方
黄莉婷,王丽岳△,张博方,郭 鑫,陈 静
(1. 武汉科技大学医学院, 武汉 430065; 2. 武汉市普仁医院心内科, 武汉 430081; 3. 武汉大学人民医院心内科,武汉 430060)
据统计,心血管疾病的患病率和死亡率持续升高,冠心病已逐渐成为世界范围内的主要致死原因[1]。目前临床通过血运重建改善心肌缺血性损伤的预后,已经成为冠心病的主要治疗手段,然而再灌注后,会引起心肌细胞凋亡、炎症及氧化应激反应等进一步损伤[2]。大量研究表明,心肌缺血再灌注损伤可能与钙超载、氧自由基增多、心肌纤维能量代谢障碍、炎症反应、酸中毒等机制有关[3],但针对上述1种或几种机制缓解再灌注损伤,目前还缺乏系统有效的治疗方法。
近年来许多研究表明,黄酮类化合物在治疗和预防心血管疾病中发挥着重要作用[4],其中PI3K/Akt信号通路是参与保护心肌再灌注损伤的经典通路之一[5]。研究证实,该通路能通过调节细胞增殖和凋亡来对抗心肌缺血再灌注损伤。佛手苷内酯(BG:C12H8O4)作为一种黄酮类化合物,是天然的抗炎和抗氧化剂[6]。Daniela等发现,佛手苷内酯能通过抑制肠道炎症和氧化应激反应减轻肠缺血再灌注损伤[7],但目前佛手苷内酯对心肌缺血再灌注损伤治疗的潜在效用还缺乏相关研究。本实验通过构建H9C2心肌细胞缺氧复氧模型,模拟心肌缺血再灌注过程,研究佛手苷内酯对心肌缺血再灌注损伤的作用。同时本实验将进一步探讨对PI3K/Akt信号通路的影响。
1 材料
1.1 药物与试剂
佛手苷内酯(上海阿拉丁生化科技股份有限公司),DMEM/HIGH GLUCOSE培养基(Hyclone,USA),胎牛血清(FBS,GIBICO,USA),青-链霉素溶液(美国Hyclone),0.25%胰酶溶液(Hyclone,USA),二甲基亚砜(DMSO,Sigma-Aldrich,USA),Cell Counting Kit-8(CCK-8)细胞增殖-毒性检测试剂盒(日本同仁化学研究所),超氧化物歧化酶测试盒(Nanjing Jian Chen biotechnology),肌酸激酶同工酶(CK-MB)检测试剂盒(Nanjing Jian Chen biotechnology),乳酸脱氢酶(LDH)测试盒(Nanjing Jian Chen biotechnology),BCA检测蛋白浓度试剂盒(Beyotime biotechnology),丙二醛测试盒(ASPEN), RIPA总蛋白裂解液(ASPEN), 0.45 μm PVDF膜(Millipore),Annexin V-FITC细胞凋亡检测试剂盒(天津三箭生物技术有限公司)。
1.2 仪器
倒置相差显微镜(Nikon Eclipse TS100,日本 Nikon 公司),酶标仪(Diatek公司),流式仪(碧迪医疗器械有限公司),转移电泳仪槽(北京市六一仪器厂),垂直电泳槽(北京市六一仪器厂)。
2 方法
2.1 H9C2细胞系传代与培养
将武汉大学心血管病研究所长期传代培养和规范冻存的H9C2心肌细胞按2×107cells密度接种于10 cm培养皿中,用含10%胎牛血清和1%的青-链霉素溶液的高糖DMEM培养基培养,置于37 ℃ 5% CO2培养箱(95%空气)中培养,细胞融合度到达90%左右时进行传代,每2~3 d用0.25%胰酶消化传代1次,取对数生长期的细胞接种于培养皿中进行后续实验。
2.2 缺氧复氧模型的构建
向三气培养箱中通入1% O25% CO2的混合气体,当氧气浓度为1%时,将H9C2心肌细胞放入三气培养箱中缺氧培养4 h, 4 h后停止通气,取出心肌细胞更换为等体积的含10%胎牛血清的高糖培养基,置于正常培养箱中复氧培养24 h。
2.3 实验分组及处理
将2 mg佛手苷内酯(BG)溶于200μLDMSO,加入高糖DMEM培养基稀释至5 μmol/L、10 μmol/L、20 μmol/L。把H9C2心肌细胞按随机数字表法分为5组。正常对照组(control 组):加入适量正常培养液一直在37 ℃、含5%CO2的培养箱中培养,定期换液;缺氧/复氧组(H/R组):加入等量正常培养液培养24 h,缺氧4 h、复氧24 h; 5 μmol/L 佛手苷内酯+缺氧/复氧组:(BG-5+H/R组):用含5 μmol/L佛手柑内酯培养液培养24 h,缺氧4 h、复氧24 h;10 μmol/L 佛手苷内酯组+缺氧复氧组(BG-10+H/R组):用含10 μmol/L佛手苷内酯培养液培养24 h,缺氧4 h、复氧24 h;20 μmol/L 佛手苷内酯+缺氧复氧组(BG-20+H/R组:用含20 μmol/L佛手苷内酯培养液培养24 h,缺氧4 h、复氧24 h。
2.4 CCK-8法检测细胞活性
将各组细胞接种于96孔培养板中,在培养箱(37 ℃ 5% CO2)中培养24 h,正常组和模型组更换普通培养液,加药组分别加入不同浓度含佛手苷内酯培养液培养24 h,各组做相应处理后,每孔加入10 μL CCK-8试剂,置于正常培养箱孵育4 h后,用酶标仪检测各孔吸光度(A)值(检测波长为450 nm)。
2.5 细胞损伤释放血清心肌酶检测
复氧24 h后抽取各组心肌细胞培养液,加入2 mmol/L标准液、基质缓冲液和辅酶Ⅰ应用液,混匀后置于37 ℃水浴锅中静置15 min,再加入2,4-二硝基苯肼混匀,水浴15 min,最后加入0.4 mol/L NaOH溶液室温下放置3 min,用分光光度计于440 nm波长测定各管吸光度,计算LDH活性。按照试剂盒方法,用自动分光光度计检测CKMB活性。
2.6 细胞氧化应激反应检测
复氧24 h后抽取各组心肌细胞培养上清液,按照丙二醛(MDA)试剂盒和超氧化物歧化酶试剂盒(SOD)方法,用自动分光光度仪检测MDA、SOD活性。
2.7 细胞凋亡水平检测
复氧24 h后弃去各组心肌细胞培养液,用不含EDTA的0.25%胰酶消化细胞,收集悬浮细胞于流式管中,1500 rpm离心5 min去除上清液,用4 ℃预冷的PBS溶液洗涤2次,再次离心取细胞沉淀。按照Annexin V/PI细胞凋亡检测试剂盒操作说明,各组均加入5 μL Annexin V-FITC,混匀后避光孵育10 min,然后加入5 μL PI,混匀后避光孵育5 min,1h内通过流式细胞仪进行检测,最后在流式二维图中计算凋亡率。
2.8 Western blot法检测蛋白表达
将各组心肌细胞在含有50 mmol/L Tris-HCl (pH 7.4)、150 mmol/L NaCl,5 mmol/L EDTA,1 mmol/L二硫苏糖醇,1% Triton X-100和1% 蛋白酶抑制剂的裂解液中进行匀浆。将匀浆物离心5 min(12 000×g,4 ℃)后取上清液。采用BCA蛋白定量试剂盒测定蛋白质浓度,取50 μg蛋白样品进行15% SDS-PAGE(10%分离胶,5% 浓缩胶) 电泳分离,经湿转80 min,将蛋白转移至硝酸纤维素膜上,用5% 脱脂牛奶封闭2 h,在4 ℃中将TNF-α抗体、IL-6抗体、PI3K抗体、p-PI3K抗体、Akt抗体、p-Akt抗体孵育过夜,用TBST 3×10 min洗膜后加入二抗(在室温下孵育2 h),用化学发光检测试剂盒检测,以GADPH为内参对照,采用Image-pro Plus处理软件分析图像信息。
2.9 统计学方法

3 结果
3.1 佛手苷内酯对H/R心肌细胞活力的影响
表1显示,与正常组比较,H/R组心肌细胞活性明显下降(P<0.05),差异有统计学意义。而加入浓度为5、10、20 μmol/L的佛手苷内酯的实验组心肌细胞活性比H/R组明显增加(P<0.05),且随着浓度升高细胞活性逐渐增加,表明佛手苷内酯可显著提高心肌细胞活性。
3.2 佛手苷内酯对H/R心肌细胞氧化应激水平的影响
表1显示,H/R损伤后相较于对照组,心肌细胞内MDA活性升高,SOD水平下降。加药组心肌细胞MDA活性明显下降,SOD水平明显升高,与H/R组比较差异有统计学意义(P<0.05)。
3.3 佛手苷内酯对H/R心肌细胞LDH、CKMB漏出量的影响
表1显示,心肌细胞缺氧4 h、复氧24 h后,心肌细胞内心肌酶LDH、CKMB漏出量比正常组明显增加。与H/R组比较,加药组LDH、CKMB漏出量明显减少(P<0.05),且呈浓度依赖性。
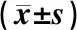
表1 不同浓度佛手苷内酯对氧化应激反应、炎症因子及心肌细胞活性影响比较
注:与control组比较:*P<0.05;与HR组比较:#P<0.05;与BG-5+HR比较:&P<0.05
3.4 佛手苷内酯对H/R心肌细胞凋亡的影响
图1显示,缺氧复氧后心肌细胞凋亡水平明显提高,正常细胞明显减少(P<0.05);给予佛手苷内酯(5、10、20 μmol/L)预处理后,心肌细胞凋亡率明显降低(P<0.05)。
注:与control组比较:*P<0.05;与HR组比较:#P<0.05;与BG-5+HR比较:&P<0.05图1 不同浓度佛手苷内脂对缺氧复氧心肌细胞凋亡率影响比较
3.5 佛手苷内酯对心肌细胞缺氧复氧后释放炎症因子的影响
图2显示,心肌细胞缺氧复氧后,炎症因子TNF-α、IL-6释放相比正常组显著增加,而加药组则呈剂量依赖性抑制炎症因子的释放(P<0.05)。
3.6 佛手苷内酯对H/R心肌细胞p-PI3K、p-AKT蛋白表达的影响
图2显示,各组心肌细胞PI3K、AKT蛋白表达量无明显差异。与正常组比较,H/R组p-PI3K、p-AKT蛋白表达量显著下降,5、10、20 μmol/L佛手苷内酯处理组可显著增加2种蛋白的表达(P<0.05)。
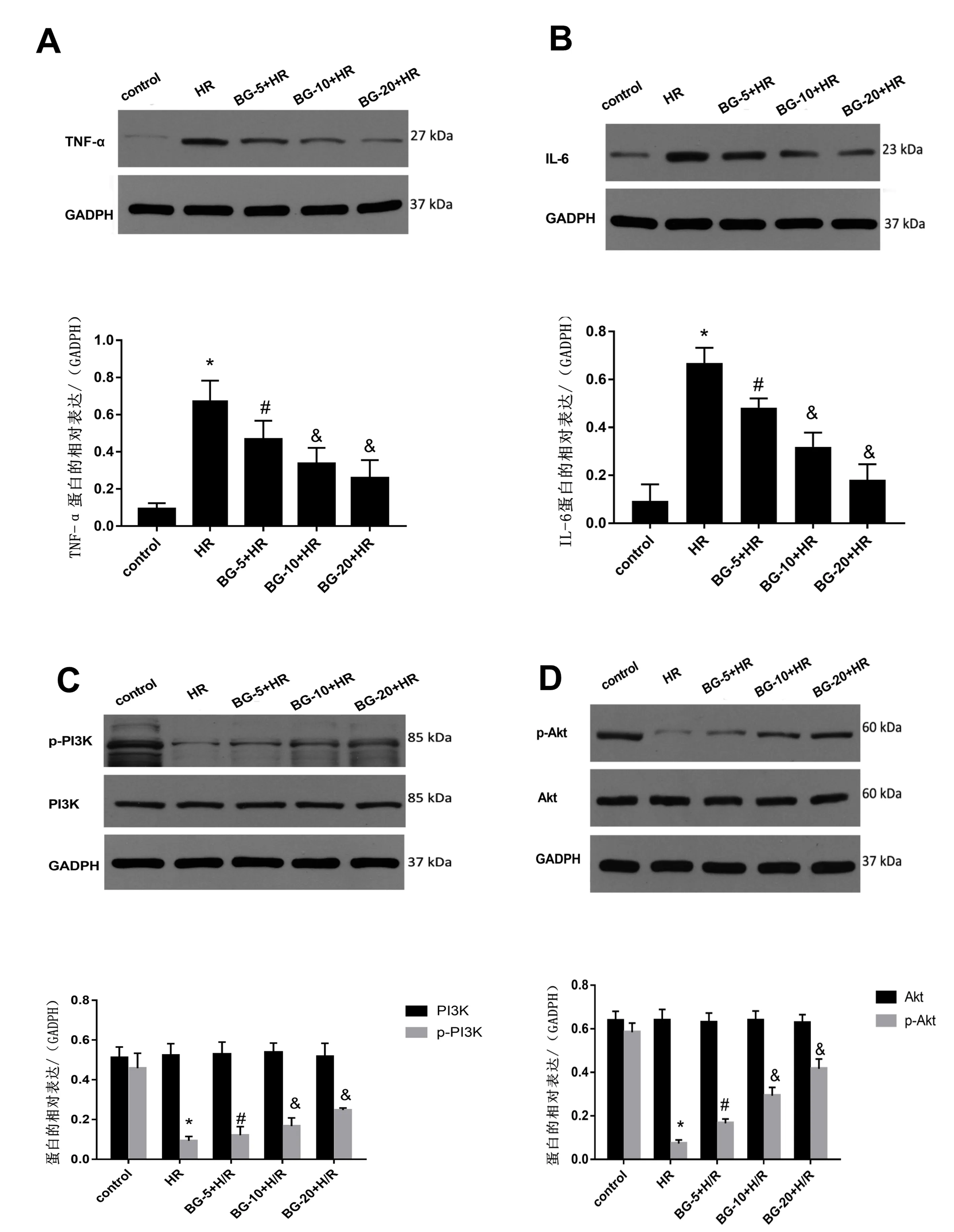
注:与control组比较:*P<0.05;与HR组比较:#P<0.05;与BG-5+HR比较:&P<0.05图2 不同浓度佛手苷内酯对TNF-α(A)、IL-6(B)、p-PI3K(C)、p-Akt(D)蛋白水平影响比较
4 讨论
本实验通过缺氧复氧处理模拟心肌细胞缺血再灌注过程,从细胞水平探讨佛手苷内酯对其保护作用及可能机制。
心肌细胞在缺血缺氧状态下,清除氧自由基系统包括过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)等含量下降,氧自由基增多;血供恢复后,氧自由基进一步爆发性增长,加重对心肌细胞的损害[3,8]。同时丙二醛(MDA)含量升高,反映了氧自由基引发脂质过氧化的情况[9]。本实验中,药物处理组检测SOD含量较模型组明显升高,而MDA含量明显降低,表明佛手苷内酯能加强清除氧化自由基的能力,从而减轻氧自由基损伤。另外,心肌缺血损伤会引起细胞损伤并增加细胞膜和线粒体性膜通透性,使乳酸脱氢酶(LDH)、肌酸激酶(CK)、肌酸激酶同工酶(CKMB)等心肌酶释放增多[10]。佛手苷内酯能减少CK-MB、LDH的释放,说明它能减轻细胞膜的损伤程度而发挥膜稳定作用。心肌细胞膜损伤释放大量炎性介质,吸引中性粒细胞聚集,而进一步堵塞血管加重无复流现象[11]。实验中,佛手苷内酯通过显著抑制白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)等促炎因子的释放来减轻炎症反应。
心肌缺血能诱导细胞凋亡,并在缺血及再灌注中产生大量氧自由基加快细胞凋亡过程,导致心肌损伤和心功能下降。本实验用CCK-8法检测细胞活性,提示0~10 μmol/L的佛手苷内酯对细胞活性逐渐增高,当浓度在20 μmol/L时细胞活性最高。通过流式细胞仪检测细胞凋亡情况,随着药物浓度升高,细胞凋亡率呈下降趋势,提示佛手苷内酯对心肌细胞有明显保护作用,能够抑制细胞凋亡,并且有浓度依赖性。
佛手柑是意大利南部的一种特产水果,主要用于生产精油,作为许多香水的成分,还可用于芳香疗法。中药学研究发现,佛手柑有理气化痰、治疗心下气痛、缓解胃痛、胸胁痛、呕吐和抗癌的功效[12]。Bose等研究发现,麻黄根中的佛手苷内酯能抑制肿瘤坏死因子-α(TNF-α)和白介素-6(IL-6)2个炎症因子的分泌[13]。Impellizzeri D等研究证明,佛手苷内酯能抑制脂质过氧化(MDA水平),增加抗氧化剂含量,如MnSOD酶等氧化应激反应指标[14]。MingXia Zheng等在BG对脂多糖(LPS)介导的破骨细胞形成、骨吸收和体外破骨细胞存活的影响研究中,发现BG能通过破骨细胞及其前体的凋亡反应,有效地阻止LPS诱导破骨细胞的发生、骨吸收和存活[15]。而XueJu Li等证实,BG能通过调节PI3K/Akt、JNK/MAPK和NF-κB信号通路保护骨小梁结构,减少破骨分化,抑制糖尿病相关骨质疏松症的进展[16]。结合上述研究及本实验研究结果表明,佛手苷内酯具有较强的抗炎、抗氧化应激、调节细胞凋亡等作用,并可能与PI3K/Akt途径有关。
PI3K是一类包含许多脂质激酶的家族,由磷脂酰肌醇(phosphatidylinositol,PI)的肌醇环第3位点碳原子磷酸化形成,可被受体酪氨酸激酶的配体激活。 Akt又名蛋白激酶B(protein kinase B,PKB),是PI3K信号传导通路下游的一个重要靶点。活化的PI3K催化Akt从胞膜释放下来在胞质内继续传递生物学信号,调节细胞的生存、增殖和代谢[17]。另外,通过减少线粒体通透性转换孔(mPTP)的开放,调控线粒体产生能量,进一步清除细胞内活性氧,抑制细胞凋亡,减少中性粒细胞的活化和聚集[18]。Okumura H等通过结扎左冠状动脉构建大鼠心肌I/R模型,发现急性期注射肾上腺髓质素(AM)可明显减轻再灌注损伤,并且依赖于PI3K/Akt途径发挥保护作用,表明PI3K/Akt信号通路参与心肌再灌注损伤中的保护作用[19]。Zhao等也发现,二氧化硫预处理组大鼠心肌梗死面积相比对照组明显缩小,心肌磷酸化Akt和PI3K明显增多,且能被LY294002(PI3K抑制剂)阻断,表明PI3K/Akt信号通路在心肌缺血再灌注中发挥重要作用[20]。本实验发现,佛手苷内酯能显著提高PI3K和磷酸化Akt的表达量,与上述研究相符,表明佛手苷内酯对心肌细胞缺氧复氧损伤的保护作用与PI3K/Akt信号通路相关。
综上所述,佛手苷内酯能通过抗氧化应激、抗炎、抗凋亡等作用保护心肌细胞缺氧复氧损伤,并与激活PI3K/Akt信号通路有关。但心肌缺血再灌注损伤发生机制比较复杂,且涉及多种信号通路的作用。关于佛手苷内酯具体如何影响PI3K/Akt信号通路,以及是否与其他通路存在相互作用,还有待于进一步的深入研究。
