静力运动对2型糖尿病大鼠胰岛素抵抗的影响❋
2019-10-21桑佳佳陈莉莉王贤娇方朝晖吴云川
桑佳佳,陈莉莉,王贤娇,方朝晖,吴云川△
(1. 南京中医药大学附属医院,南京 210029; 2. 南京中医药大学第二临床医学院,南京 210023; 3. 安徽省中医院,合肥 230031)
2型糖尿病(type2 diabetes mellitus,T2DM)是一组由多种原因引起的以高血糖、高胰岛素血症为特征的慢性代谢性疾病,临床并发症众多,严重影响患者的生活质量,给国家和个人造成较重的经济负担[1]。近年来,本病发病率呈年轻化和逐年上升趋势,目前多项临床及实验研究均表明胰岛素抵抗(iInsulin resistance,IR)是本病发病的中心环节[2],逆转或减轻IR是治疗T2DM的关键途径。
运动是预防和治疗T2DM的重要手段。Reynolds TH等[3]发现,适当的有氧运动可以增加骨骼肌细胞内GLUT4的含量,加速葡萄糖的跨膜转运,从而达到减轻IR、降低血糖的目的。静力运动集低氧、耐力和高强度间歇等特点于一体,符合美国糖尿病学会(ADA)最新提出的运动干预方案[4]。因此本实验以2型糖尿病大鼠胰岛素抵抗为模型并合理分组,研究静力运动对高脂膳食诱导的2型糖尿病大鼠胰岛素抵抗的影响。
1 材料与方法
1.1 动物与分组
SPF级SD大鼠28只,雄性,体质量200±20 g,由北京维通利华实验动物技术有限公司提供,动物合格证号:[SCXK(京)2012-0001],饲养于南京中医药大学SPF级实验动物中心。随机分为正常组、模型组、有氧组和静力组各7只。实验前适应性饲养1周,自然照明,自由取食、饮水,室温(23±2)℃,湿度40%~50%。
1.2 主要试剂与仪器
10%水合氯醛(上海西唐生物科技有限公司),ZH-PT动物实验跑台(安徽正华生物仪器有限公司),大鼠静力运动装置(自制),数码相机(日本NIKON 公司),光学显微镜(日本OLYMPUS 公司),离心机(美国THERMO公司),酶标仪(美国BIO TEK公司);血糖仪(日本QRKRAY公司),GLUT4检测试剂盒(南京建成生物科技有限公司),5 ml无菌注射管带针(江苏华达医疗器械有限公司)。
1.3 动物模型制备
参照都健等[5]提出的方法,给予模型组、有氧组和静力组高脂膳食喂养方法建立IR模型。高脂膳食配方:脂肪热比为59%(其中猪油占39%),蛋白质热比为21%(其中酪蛋白占31%),碳水化合物热比为20%(其中玉米淀粉占30%),此外附加必需的维生素及矿物质,正常组喂饲普通饲料。各组大鼠隔日换水、垫料并增加食料。4周高脂膳食喂养后取前趾血检测血糖,以不同时间测3次空腹血糖均≥7.8 mmol/L作为造模成功标准,造模成功为28只。
1.4 有氧运动训练
有氧运动训练方案参照Bedford[6]的报道并进行改进,在高脂膳食喂养4周出现IR后,有氧组进行为期4周的跑台训练,跑速30 m/min,跑台坡度0度,每周训练5 d休息2 d,前2周每天训练40 min,之后每天训练60 min。
1.5 静力运动训练
根据静力运动的特点自制装置,将静力组大鼠双后足捆绑倒挂于横杆,在横杆上放置食物诱使其行前屈以便双前肢和头部靠拢后肢,使其全身肌肉处于静止性用力状态,大鼠肌肉疲劳后自行恢复倒挂,再行食物诱惑,反复持续30 min后把大鼠放下,参照此法训练4周。
1.6 观察指标及检测方法
1.6.1 糖代谢指标检测 4周干预后,各组大鼠均禁食12 h过夜,次日空腹于眼眶静脉窦处采血,收集约5 ml血液样品,放入试管中并以3500 r/min离心15 min,温度至-4 ℃分离红血细胞与血浆。取1 ml血清为检测FPG和FINS含量的原料,胰岛素抵抗指数(HOMA-IR)参照Haffner SM等[7]改良的HOMA-IR=FPG× FINS/22.5方法计算。
1.6.2 骨骼肌组织形态学观察及GLUT4含量测定 4周干预后,给予各组大鼠约5 ml麻醉药,待大鼠进入深麻醉期后迅速分离双侧前后肢骨骼肌,放入密闭容器并送置于-70 ℃液氮罐中,后转移至-70 ℃冰箱中,待集齐所有标本后将组织匀浆,用ELISA试剂盒检测GLUT4含量。每组大鼠处死前取两侧长约1 cm的骨骼肌,置于10%福尔马林液中固定,用于HE染色,行镜下形态学观察。
1.7 统计学方法
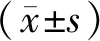
2 结果
2.1 各组大鼠干预后糖代谢相关指标及GLUT4含量比较
表1显示,实验选用SPF级雄性健康SD大鼠28只,正常组大鼠不明原因死亡2只,进入结果分析共计26只。运动干预4周后,有氧组和静力组大鼠FPG、FINS及HOMA-IR与模型组比较差异有统计学意义(P<0.05),且静力组在改善FPG和HOMA-IR方面较有氧组具有优越性(P<0.05)。运动干预后正常组和模型组的GLUT4含量无明显差异,有氧组和静力组的GLUT4表达量明显高于模型组(P<0.01),且以静力组更为显著(P<0.01)。
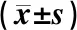
表1 干预后各组大鼠FPG、FINS、HOMA-IR、GLUT4值比较
注:与模型组比较:#P<0.05,##P<0.01;与有氧组比较:^P<0.05,^^P<0.01
2.2 各组大鼠光镜下骨骼肌组织形态学比较
图1显示,正常组大鼠光镜下骨骼肌肌束排列紧密,粗细一致,细胞未见增生肥大、萎缩、变性及坏死,间质无水肿及炎性细胞浸润,胞膜完整圆润,胞核充盈清晰;模型组、有氧组和静力组大鼠骨骼肌组织较正常组均出现细胞萎缩退行性改变。与正常组比较,模型组大鼠骨骼肌肌纤维区域性坏死,胞核固缩,核质比缩小;与模型组比较,有氧组大鼠骨骼肌组织细胞虽有肌纤维区域性坏死、胞核固缩、核质比缩小等变化,但损伤较小;与有氧组比较,静力组大鼠骨骼肌组织细胞虽存在萎缩退行性改变,但肌束排列较为紧密,粗细相对一致。
3 讨论
FPG是糖尿病最常用的筛查指标,是判断血液中血糖浓度的重要标准,正常个体的FPG应处于3.89~6.11 mmol/L,FINS由体内胰岛β细胞分泌,作为机体内降低血糖的主要激素,正常机体FINS<24 mU/L,二者常作为糖尿病诊断与分型的参考指标,若检测结果高于正常值则提示有糖尿病的可能。HOMA-IR是用于评价IR的重要指标,数值随着IR水平的升高而增加。本实验模型组、有氧组和静力组大鼠给予高脂膳食喂养造模后,FPG、FINS及HOMA-IR均明显高于正常组,提示造模成功。
运动疗法作为T2DM防治的重要手段,主要通过增加骨骼肌对葡萄糖的摄取起到改善糖代谢的作用[8]。本次实验研究发现,有氧运动与静力运动干预均可使2型糖尿病大鼠胰岛素抵抗模型FPG、FINS下降,HOMA-IR增加,其中静力运动调控作用更强,在改善FPG和HOMA-IR方面较有氧运动更具优越性,这主要与静力运动低氧、耐力和高强度间歇的优点相关联。现代实验研究发现,低氧、耐力及高强度间歇运动较常氧、持久无间歇运动对糖尿病大鼠葡萄糖转运影响更显著[9-11]。此外,静力运动可以加大动静脉氧差,增加单位时间内的肌肉血流量,提高组织细胞的氧化能力,并通过增加骨骼肌线粒体体积、数目等途径增强骨骼肌肌细胞形成ATP的能力[12]。
骨骼肌作为运动与维持葡萄糖稳态的纽带,与葡萄糖转运密切相关。本实验研究也证实了糖代谢、骨骼肌与运动三者的紧密联系性。通过镜下骨骼肌形态学观察发现,糖代谢紊乱可表现有骨骼肌组织细胞萎缩退行性改变,而运动对损伤的骨骼肌有明显的改善作用,且静力组较有氧组肌束排列更为紧密,粗细相对一致。GLUT4作为GLUT族群中对胰岛素最为敏感的转运体,其转运功能正常与否是限制骨骼肌肌细胞利用葡萄糖的关键步骤[13]。本实验IR动物模型中,有氧组和静力组大鼠运动干预后骨骼肌组织细胞中GLUT4的含量均明显高于正常组,提示当GLUT4处于高表达状态时,糖代谢指标也得到一定改善。与Kelly KR[14]等研究结果相似。本实验结果表明,运动可以增加骨骼肌细胞内的GLUT4含量,提高胰岛素与细胞受体的结合力,减轻胰岛素抵抗,促进葡萄糖进入骨骼肌等周围组织,纠正糖代谢紊乱,且静力组的GLUT4表达量明显高于有氧组。Andrew JS等[15]也提出相似观点。
综上所述,静力运动依靠骨骼肌的纽带作用,主要通过改善骨骼肌组织形态及增加骨骼肌细胞内GLUT4的表达,起到减轻胰岛素抵抗、纠正糖代谢紊乱的作用。本实验仅选取固定强度下的静力运动对2型糖尿病大鼠胰岛素抵抗的影响研究,对静力运动干预强度和时间的深入探索,将进一步有利于2型糖尿病患者的恢复和个体化运动方案的制定。
