三黄益肾胶囊对糖尿病肾病大鼠肾组织IGF-1表达的影响❋
2019-10-21路菲菲王元松吕树泉苏秀海
路菲菲,王元松,吕树泉,苏秀海
(1. 河北中医学院研究生学院, 石家庄 050200; 2. 河北中医学院附属河北省沧州中西医结合医院,河北 沧州 061001)
糖尿病肾病(diabetic nephropathy, DN)是糖尿病(diabetes mellitus, DM)最常见的微血管并发症,也是导致终末期肾病(ESRD)最常见的病因[1]。早期肾脏病变具有可逆性,一旦进入显性蛋白尿期,其病变即为不可逆,患者不得不接受透析甚至肾移植治疗,所以如何采取有效措施抑制DN的进展成为目前的研究重点[2-3]。
前期临床研究发现,三黄益肾胶囊可明显减少早期糖尿病肾病患者尿蛋白,改善患者症状[4]。动物实验发现,该中成药可能通过影响TGF-β1、VEGF[5]、MMP-9、TNF-α[6]、NO、NOS[7]等在肾脏的表达,发挥对糖尿病肾病的保护作用。研究表明,胰岛素样生长因子-1(IGF-1)参与糖尿病肾病的发生发展过程[8]。本研究通过建立糖尿病肾病大鼠模型,旨在探讨三黄益肾胶囊对IGF-1表达的影响及可能的作用机制,为临床应用进一步提供实验依据。
1 材料与方法
1.1 试验药物
三黄益肾胶囊组成:黄芪、西洋参、山药、山茱萸、菟丝子、黄精、地黄、芡实、金樱子、益母草、丹参、川芎、苍术、赤芍、王不留行,为河北省沧州中西医结合医院院内制剂(冀药制字Z 20050795);雷米普利片由昆山龙灯瑞迪制药有限公司生产(批号H 20030725)。
1.2 动物
70只健康清洁级雄性SD大鼠,体质量(250±50) g,由北京华阜康生物科技股份有限公司提供(动物合格证号11401300065459)。
1.3 试剂和仪器
链脲佐菌素(STZ)、柠檬酸钠(美国sigma公司);Trizol(Invitrogen);氯仿、异丙醇、无水乙醇(天津市永大化学试剂有限公司);DEPC水(北京索莱宝科技有限公司);TIANScript RT KIT、SuperReal PreMix Plus(SYBR Green,天根生物科技有限公司)。显微镜、CMOS(日本奥林巴斯);多功能真彩色细胞图像分析管理系统(美国Media Cybernetics公司);石蜡切片机(德国莱卡RM 2015);离心机(德国Eppendorf-5430);低温冰箱(日本三洋MDF-382 E型);恒温水浴箱(江苏太仓医用仪器厂DSHZ-300型);荧光定量PCR仪(Applied Biosystems);生物分光光度计(Eppendorf)、罗氏活力型血糖仪(德国罗氏)。
1.4 方法
70只大鼠适应性喂养1周,随机取10只大鼠作为正常对照组(NC),余60只作为造模组。造模前禁食10 h,一次性腹腔注射链脲佐菌素60 mg/kg(STZ临用前溶于0.1 mmol/L,pH4.2柠檬酸-柠檬酸钠缓冲液中),NC组腹腔注射等容量柠檬酸-柠檬酸钠缓冲液。造模组72 h后尾静脉取血测血糖,血糖值≥16.65 mmol/L作为DN大鼠成模标准[9]。稳定1周后,从造模成功的54只大鼠中随机抽取50只分为糖尿病肾病组(DN)、三黄益肾低剂量组(SL)、三黄益肾中剂量组(SM)、三黄益肾高剂量组(SH)、雷米普利组(RP)每组各10只。SL组、SM组、SH组大鼠分别给予三黄益肾胶囊0.4 g/kg/d、0.8 g/kg/d、1.6 g/kg/d灌胃,RP组大鼠给予雷米普利片0.5 mg/kg/d灌胃,NC组、DN组大鼠给予等剂量蒸馏水灌胃,连续灌胃8周。观察过程中,死亡10只,最终成功纳入结果分析的为50只。
1.5 指标检测及方法
1.5.1 生化指标 治疗8周末将大鼠置于代谢笼中,收集24 h尿液,用3%戊巴比妥80 mg/kg腹腔注射麻醉大鼠。腹主动脉采血,采集血液后将大鼠处死,将采集血液在离心机上高速离心3000 r/min,持续15 min,收集上清液,采用全自动生化分析仪进行血甘油三酯(TG)、血胆固醇(TC)、血尿素氮(BUN)、血肌酐(Scr)检测。24 h尿微量白蛋白水平的测定应用免疫透射比浊法。
1.5.2 HE染色法观察大鼠肾组织结构 大鼠取血后摘取双肾,并去除肾包膜、肾门结缔组织,用生理盐水洗净后置于4%中性多聚甲醛液中固定,石蜡包埋、切片并行HE染色。具体步骤如下:二甲苯脱蜡(10’)→无水乙醇洗去二甲苯(1’×2次)→95%酒精(1’)→90%酒精(1’)→85%酒精(1’)→自来水洗(2’)→苏木精染色(1-5’)→自来水洗(1’)→1%盐酸酒精分化20 s→自来水洗(1’)→稀氨水(1%)反蓝30 s→自来水或蒸馏水洗(1’)→伊红染色(20 s-5 min)→自来水洗(30 s)→85%酒精脱水(20 s)→90%酒精脱水(30 s)→95%酒精(1’)→95%酒精(1’)→100%酒精(2’)→100%酒精(2’)→二甲苯(2’)→中性树胶封片,光学显微镜下观察大鼠肾组织结构的变化。
1.5.3 免疫组化 采用免疫组化法检测肾组织中IGF-1的表达:大鼠取血后摘取双肾,并去除肾包膜、肾门结缔组织,用生理盐水洗净后取小于0.5 cm×0.5 cm×0.1 cm组织块;固定于4%多聚甲醛,经70%乙醇30 min、80%乙醇30 min、90%乙醇30 min 2次,95%乙醇30 min 2次,100%乙醇30 min 2次,二甲苯透明30 min 2次,55 ℃石蜡中30 min 2次,用铜制模具包埋组织块;将组织切片,厚度为3~5 μm,附于经多聚赖氨酸附膜的载玻片上,60 ℃烘烤过夜;将切片浸于二甲苯中5 min 2次,100%乙醇5 min 2次,95%乙醇5 min 2次,90%乙醇5 min 2次,85%乙醇5 min 2次,75%乙醇5 min 2次,自来水冲洗PBS洗 2次;1%甲醇双氧水,室温10 min,蒸馏水洗1次,0.1 MPBS洗3次×5 min;0.01 M柠檬酸盐缓冲液中放入切片,在微波炉内微波辐射10 min,待修复液降至室温后,0.1 MPBS洗3次×5 min;切片上滴加正常山羊血清封闭液,室温20 min,甩去多余液体不洗;切片上滴加一抗,4 ℃过夜,0.1 MPBS洗3次×5 min;切片上滴加生物素化二抗(IgG),37 ℃ 20 min,0.1 MPBS洗3次×5 min;切片上滴加辣根酶标记链霉卵白素工作液,37 ℃ 20 min,0.1 MPBS洗3次×5 min;使用DAB显色试剂盒1 ml蒸馏水加显色剂A、B、C各1滴,混匀加到标本上,显色6 min后充分水洗;苏木素复染细胞核1 min充分水洗,1%盐酸酒精分化,1%胺水反蓝充分水洗,经70%乙醇5 min、80%乙醇5 min、90%乙醇5 min 2次,95%乙醇5 min 2次,100%乙醇5 min 2次脱水,二甲苯透明5 min 2次,中性树脂封片;选择对照组和实验组的阴性和阳性组织相进行显微照相,倍数为400×。
IGF-1阳性表达为出现棕黄色颗粒,强度大于非特异性背景为准。结果判断参考文献[10],按照染色深度和阳性细胞数占总细胞数的比例进行分级评分。A为阳性细胞数分级0~1%=0、1~10%=1、10~50%=2、50~80%=3、80~100%=4、B为阳性细胞显色强度分级0(阴性)、1(弱阳性)、2(阳性)、3(强阳性),IHS=A×B。
1.5.4 实时荧光定量PCR法检测大鼠肾组织IGF-1mRNA的表达 (1)提取样本总RNA:用Trizol提取组织样本中总RNA,步骤如下:用研钵研磨组织样品,在加有1 ml Trizol的离心管中静置5~10 min;加入0.2 ml氯仿进行15~30 s的上下剧烈混匀,然后冰浴静置3 min;4 ℃ 12000 rpm离心15 min;将水相加至新的EP管中,然后加入0.5 ml异丙醇使其混匀,冰浴10 min;4 ℃ 12000 rpm离心10 min;将上层液体倒出,用75%冰乙醇沉淀使其混匀,4 ℃ 12000 rpm离心5 min干燥。加入DEPC处理水使RNA溶解,然后检测浓度,-80 ℃保存。
(2)反转录:采用TIANScript RT KIT进行反转录,按产品说明书进行步骤操作,首先向反应管中加入如下所示50 μL反应体系的第一部分,使其混匀。试剂50 μL反应体系,总RNA1 μg,Oligo(dT)2 μL,Super Pure dNTP2 μL,RNase-Free ddH2O定容至14.5 μL。然后70 ℃加热5 min后,迅速在冰上冷却2 min,简短离心收集反应液后加入如下所示的各组分:试剂50 μL反应体系,混合物14.5 μL,5 xFirst-StrandBuffer0.5 μL,RNasin0.5 μL,TIANScrip M-MLV1 μL。轻轻吸打混匀后进行10 min的25 ℃温浴,50 min的42 ℃温浴,然后用95 ℃的温度加热5 min。最后用RNase-Free ddH2O将反应体系稀释至50 μL,-20 ℃保存。
(3)实时荧光定量PCR
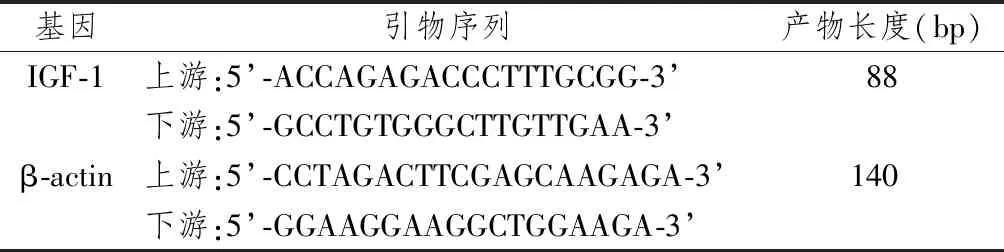
引物设计
反应体系:按照产品说明书操作实验,试剂20 μL反应体系,2*SuperReal PreMix Plus 10 μL,上游引物(10 μM) 0.6 μL,下游引物(10 μM) 0.6 μL,cDNA 100 ng,50*ROX Reference Dye△ 0.4 μL,RNase-Free ddH2O至20 μL。

反应程序
结果分析:用荧光定量PCR仪,用2-△△Ct法进行分析,参照正常对照组的目的基因表达量。
1.6 统计学方法

2 结果
2.1 生化指标检测结果
表1显示,与NC组大鼠比较,DN组大鼠血糖、甘油三酯、胆固醇、肌酐、尿素氮、24 h尿微量白蛋白均升高(P<0.05);与DN组大鼠比较,SM组、SH组、RP组大鼠肌酐、尿素氮、24 h尿微量白蛋白均降低,差异有统计学意义(P<0.05)。
2.2 各组大鼠肾组织光镜下变化
图1显示,NC组大鼠肾组织结构正常,肾小球大小正常,未见肾小球基底膜增厚,也无系膜基质增生,肾间质无浸润的炎性细胞;DN组大鼠肾组织结构呈现混乱状态,可见增大的肾小球体积和增生的系膜基质,还可见一些空泡样变性,其部位在部分肾小管上皮细胞上,肾间质有浸润的炎性细胞;与NC组大鼠比较,各造模组大鼠肾脏体积变大明显,与DN组大鼠比较,各治疗组大鼠肾脏体积略小于DN组大鼠肾脏体积。SM组、SH组大鼠的病理结构改变相似,其病理改变程度均较DN组大鼠减轻,可见轻度肥大的肾小球、轻度增厚、增生的基底膜及系膜基质肾间质没有明显浸润的炎性细胞;SL组大鼠病理改变较SM组、SH组大鼠重,肾小球、肾小管和肾间质病变程度略优于DN组大鼠。RP组大鼠肾小球未见明显肥大,其结构较清晰,未见明显增生的系膜基质,肾间质未见明显浸润的炎性细胞。
2.3 免疫组化、实时荧光定量PCR法检测肾组织IGF-1蛋白、基因表达
图2表2显示,IGF-1在肾小球、肾小管细胞中表达,免疫组化结果显示,与NC组比较DN组IGF-1表达增强(P<0.05),与DN组比较SM组、SH组、RP组表达减弱(P<0.05)。实时荧光定量PCR结果显示,与NC组比较DN组IGF-1mRNA升高(P<0.05),与DN组比较SL组、SM组、SH组、RP组降低(P<0.05)。

表1 各组大鼠血糖、甘油三酯、胆固醇、肌酐、尿素氮、24 h尿微量白蛋白水平变化比较
注:与NC组比较:*P<0.05;与DN组比较:#P<0.05
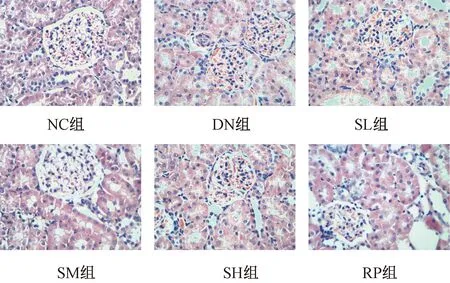
图1 各组大鼠肾组织病理改变(HE×400)

组别鼠数IGF-1IGF-1mRNANC60.15±0.061.13±0.22DN60.92±0.22∗23.27±1.78∗SL60.70±0.04∗10.93±1.09∗#SM60.50±0.02∗#5.39±0.64∗#SH60.48±0.06∗#8.10±1.19∗#RP60.43±0.04∗#2.48±0.69∗#
注:与NC组比较:*P<0.05;与DN组比较:#P<0.05
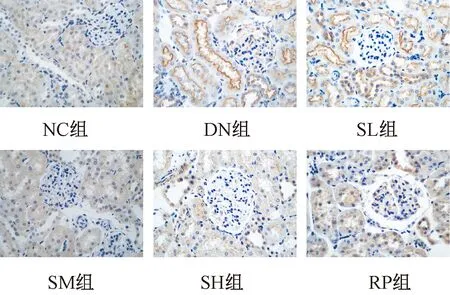
图2 免疫组化法检测各组大鼠肾组织IGF-1蛋白表达(×400)
3 讨论
近年来,DN的发病率呈升高趋势,我国约有20~40%的糖尿病患者并发此病[11]。DN的病理改变主要为肾小球细胞外基质堆积、系膜增宽、基底膜增厚,继而发展为肾小球硬化病变。研究表明,IGF-1可以通过内分泌、旁分泌等形式在细胞的分化、增殖、生长发育中发挥重要促进作用[12-13]。IGF-1是一种能够促进细胞生长、具有胰岛素样代谢效应的细胞因子,与DN病变密切相关。IGF-1有胰岛素样作用,能促进葡萄糖在细胞内的运输,使系膜细胞对葡萄糖的摄取增加,促进系膜细胞的代偿性增生,刺激系膜细胞合成蛋白而致细胞外基质堆积,使肾小球硬化加速[14]。在高浓度葡萄糖环境下,IGF-1可以导致肾小球血流动力学改变[15],一氧化氮(NO)在DN肾组织中血流动力学改变、细胞外基质的形成起着重要作用,而IGF-1能促进NO的产生。在DN中,高血糖可以导致肾小球系膜细胞损伤,进而使肾脏局部IGF-1旁分泌合成增多、降解减少,最终导致肾脏IGF-1水平升高[16]。由此可知,IGF-1在DN进展中起着重要作用。本研究结果显示,SM组、SH组大鼠肾组织中IGF-1蛋白及IGF-1mRNA较DN组降低,说明IGF-1可能是三黄益肾胶囊改善DN肾功能分子机制中的重要通路。
DN基本病机为本虚标实,脾肾亏虚为本、血瘀为标。三黄益肾胶囊以益气养阴、活血化瘀固精为主要功效,由黄芪、西洋参、山药、山茱萸、菟丝子、黄精、地黄、芡实、金樱子、益母草、丹参、川芎、苍术、赤芍、王不留行组成,临床观察对早期DN疗效肯定[17]。现代药理研究表明,黄芪有利尿、消除蛋白尿、保护肾小管的作用,黄精有提高机体免疫功能、抑制血糖过高、保护肾脏的作用,生地黄有强心、利尿、改善肾功能的作用,西洋参有抗疲劳、降血糖、抗利尿作用,山药、山茱萸有降糖、抗氧化作用,益母草有利尿、改善肾功能作用,丹参有改善肾功能作用,川芎有改善微循环、抑制血小板凝集作用,王不留行有减轻氧化应激作用,赤芍有改善早期肾功能作用,金樱子、芡实有保护肾功能作用,菟丝子有抗氧化、免疫调节等作用,苍术有降糖等作用,诸药联用共奏益气养阴、活血化瘀固精之功。
本研究结果显示,三黄益肾胶囊中、高剂量组能降低肌酐、尿素氮、24 h尿微量白蛋白水平,改善肾组织病理学变化,其机制可能与三黄益肾胶囊调节IGF-1表达,从而改善糖尿病肾病大鼠肾功能有关,此可能是三黄益肾胶囊治疗DN的另一有效作用机制。
