脑胶质瘤MRI特征与IDH基因表型的相关性
2019-10-19梅东东罗燕彭全洲成志强龚静山
梅东东,罗燕,彭全洲,成志强,龚静山*
1.深圳市人民医院(暨南大学附属第二临床医学院)放射科,广东深圳 518020;2.深圳市人民医院(暨南大学附属第二临床医学院)病理科,广东深圳 518020; *通讯作者 龚静山 .jshgong@sina.com
脑胶质瘤是一种常见的原发性神经系统肿瘤。WHO根据组织病理学表现将胶质瘤分为Ⅰ~Ⅳ级,级别越高,肿瘤的恶性程度和预后越差[1]。WHO组织病理学分级存在一定的局限性,如同属Ⅳ级的胶质瘤母细胞瘤预后存在较大差异。近年研究表明,异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)是影响胶质瘤预后的重要因素之一[2]。IDH突变型的胶质母细胞瘤预后优于IDH野生型。因此,明确胶质瘤的IDH基因表型对指导患者预后判断和治疗方案的选择十分重要[3-5]。目前临床缺乏安全、简便的在体评价胶质瘤分子特征的方法。MRI是胶质瘤诊断与评估的首选影像学检查手段,具有无创、无辐射的优点,同时可以获得肿瘤结构和功能信息。既往研究表明,脑胶质瘤的MRI特征与IDH基因表型相关[6-8]。由于胶质瘤患者术前行MRI时肿瘤分级并不明确,故采用MRI特征在体预测不同级别的胶质瘤IDH基因表型具有广泛的临床意义。本研究通过比较脑胶质瘤的MRI特征与IDH基因表型的相关性,为临床治疗方案的制订和预后判断提供参考。
1 资料与方法
1.1 研究对象 回顾性分析2010年1月8日—2017年8月6日深圳市人民医院行 MRI检查和病理证实的脑胶质瘤患者的临床资料。纳入标准:①术前1个月内行MRI平扫、扩散加权成像(DWI)/表观扩散系数(ADC)及增强扫描,且图像可完整从PACS系统中读取;②行 MRI检查前未接受任何治疗;③病理标本保存完好,可满足IDH基因表型的检测(符合IDH1/IDH2基因突变的荧光PCR检测条件)。最终共纳入37例胶质瘤患者,其中男17例,女20例;年龄17~71岁,平均(38.9±14.0)岁。
1.2 MRI检查 采用 Siemens Magnetom 3.0T Skyra和1.5T Avanto MR系统,分别为20通道、8通道相控阵头颅线圈。常规MRI扫描参数:T1WI:TR 500 ms,TE 9.7 ms,视野(FOV)201 mm×230 mm,层厚5 mm;T2WI:TR 5000 ms,TE 112 ms,FOV 200 mm×230 mm,层厚5 mm;T2 FLAIR:TR 9000 ms,TE 87 ms,FOV 201 mm×230 mm,层厚 5 mm;DWI:TR 3400 ms,TE 105 ms,FOV 230 mm×230 mm,层厚5 mm。以0.1 mmol/kg静脉注射钆喷酸葡胺后行T1WI扫描。
1.3 图像分析 由1名影像科住院医师和1名主治医师在未知临床及病理诊断结果的情况下,通过协商评估病灶部位、最大径、瘤周水肿(peritumoral edema,PTE)程度、强化方式、强化率,并测量 ADC值。PTE判定参照文献[9]方法。在增强扫描后的横断位T1WI肿块最大层面上勾画肿瘤感兴趣区(ROI)时尽量避开病灶坏死、血管走行、出血和钙化,然后将ROI拷贝到平扫相应层面图像上测量增强扫描前后的病灶信号强度。取2位医师测量的平均值,根据公式(1)计算肿瘤的强化率(enhanced percentage,EP)。在横轴位扩散加权成像(DWI)上参照T2WI肿瘤实性部分勾画ROI测量ADC值获取ADC的最小值、平均值及最大值,取2名医师测量的平均值。

1.4IDH基因突变检测 参照IDH1/IDH2基因突变检测试剂盒说明书(北京鑫诺美迪基因检测技术有限公司)提取每例患者肿瘤组织石蜡包埋样品中的基因组DNA,然后采用荧光PCR-毛细管电泳测序法检测肿瘤组织标本IDH1/IDH2基因状态。
1.5 统计学方法 采用SPSS 13.0软件。采用χ2检验分析IDH突变和IDH野生型脑胶质瘤的性别、恶性程度、强化方式、水肿程度之间的差异;采用Fisher确切概率法检验肿瘤部位与IDH基因状态的关系;采用 Mann-WhitneyU检验分析强化率、ADC值与IDH基因状态的关系。P<0.05表示差异有统计学意义。
2 结果
2.1 脑胶质瘤IDH基因表型与临床和病理组织学分级之间的关系 37例胶质中,18例(48.6%)为IDH基因突变型,其中14例(77.8%)为低级别胶质瘤、4例(22.2%)为高级别胶质瘤;19例(51.4%)IDH为野生型,其中6例(31.6%)为低级别胶质瘤,13例(68.4%)为高级别胶质瘤。IDH突变型好发于低级别胶质瘤,差异有统计学意义(P<0.05)。IDH基因突变型和IDH野生型胶质瘤患者年龄和性别差异无统计学意义(P>0.05)。见表1。2.2 脑胶质瘤不同IDH基因表型的 MRI特征IDH野生型和IDH突变型胶质瘤的部位分布差异有统计学意义(P=0.029),IDH突变型胶质瘤好发于额叶,其次是颞叶;而IDH野生型胶质瘤无分布优势。IDH突变型胶质瘤的增强率低于IDH野生型肿瘤,差异有统计学意义(P<0.05)。两组MRI强化方式差异有统计学意义(P<0.05)。IDH突变型胶质瘤常表现为条片状强化,而IDH野生型胶质瘤多为环形强化。IDH突变型和IDH野生型胶质瘤在直径和PET程度及ADC值方面差异无统计学意义(P>0.05),见表2。IDH基因突变型和IDH野生型胶质瘤典型病例见图1、2。

表1 37例脑胶质瘤临床和组织病理学分级与IDH基因表型的特征
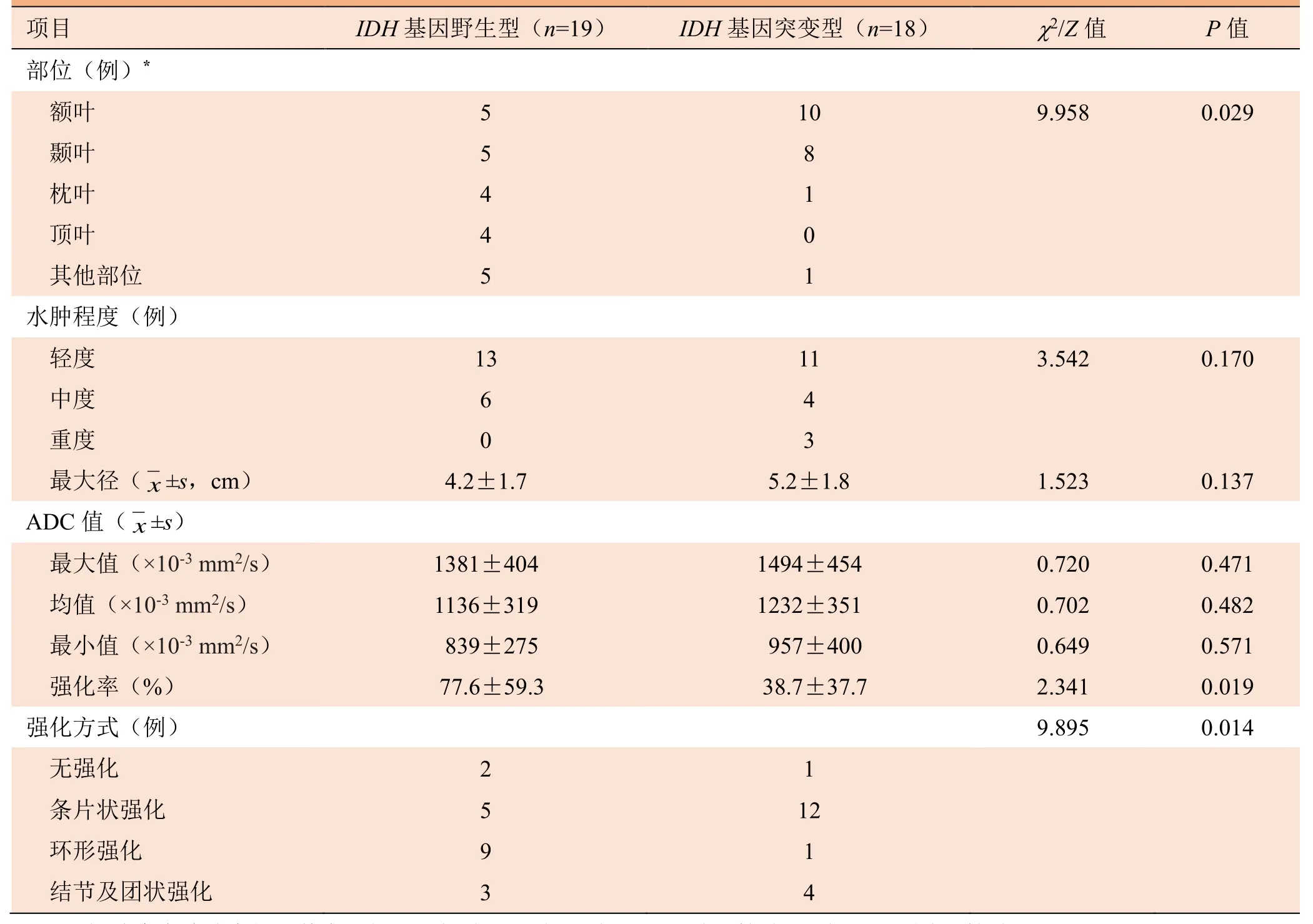
表2 37例脑胶质瘤不同IDH基因表型的MRI特征
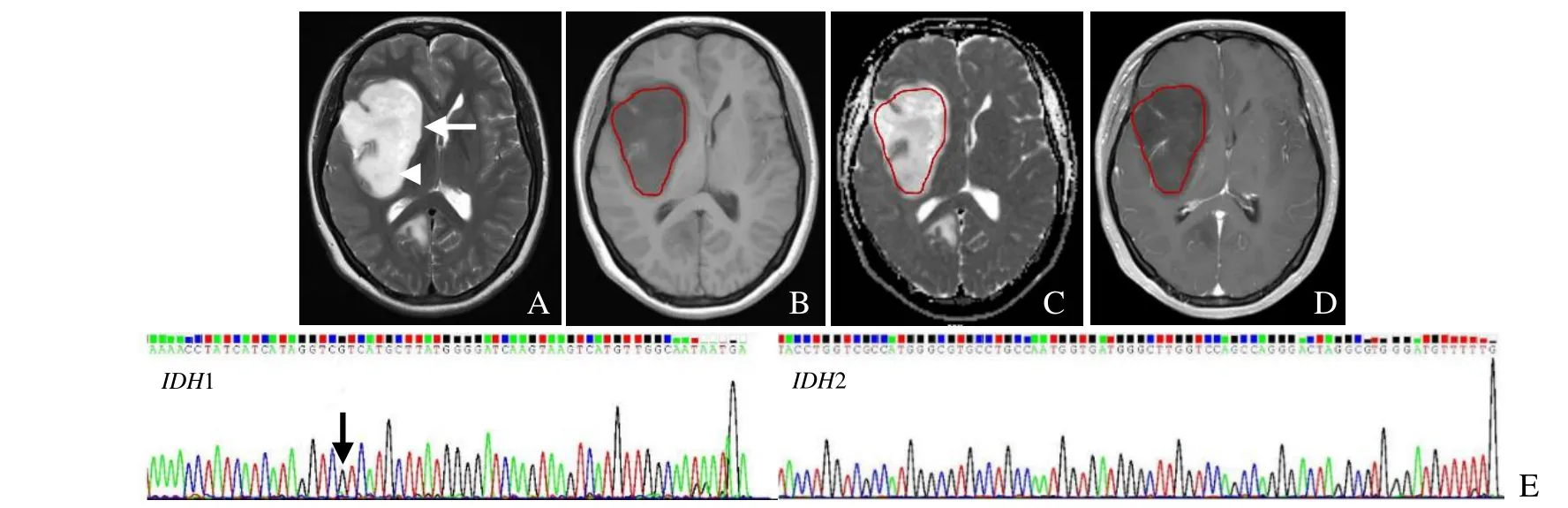
图1 女,29岁,右侧额颞叶及基底节区WHO Ⅱ级星型细胞瘤,IDH突变型。横断位T2WI边界清晰高信号肿块(箭头)伴左侧带状高信号水肿带(箭,A);横断位T1WI显示肿瘤呈均匀低信号(B);横断位ADC图显示肿块ADC值增高(最大值2450×10-3 mm2/s、平均值1655×10-3 mm2/s、最小值805×10-3 mm2/s,C);增强横断位T1WI条片状轻度强化,强化率为17%(D);IDH基因检测图,突变位点(箭,E)

图2 女,49岁,右侧额叶WHO Ⅳ级胶质母细胞瘤,IDH野生型。横断位T2WI边界欠清,高信号肿块(箭头)伴周围带状高信号水肿带(箭,A);横断位T1WI显示肿瘤信号低信号周围少许水肿带(B);横断位ADC图显示肿块ADC值降低(最大值1009×10-3 mm2/s、平均值852×10-3 mm2/s、最小值739×10-3 mm2/s,C);增强横断位T1WI示明显环形强化,强化率为107%(D);IDH基因检测图,无突变(E)
3 讨论
脑胶质瘤的IDH基因表型是影响患者预后的重要因素,伴有IDH突变型的脑胶质瘤较IDH野生型有较好的预后和治疗反应,如组织病理学级别相同的胶质母细胞伴IDH基因突变的中位生存时间为IDH野生型的2倍,间变型星形细胞瘤IDH突变型是IDH野生型的3倍[10-12]。同时,IDH基因表型也影响患者对化疗的反应。Houillier等[13]研究认为IDH突变型胶质瘤患者得益于肿瘤对化疗较好的反应。因此,明确胶质瘤IDH基因表型对患者预后、治疗反应判断和治疗方案的选择至关重要。目前临床主要通过组织标本的基因检测明确IDH基因表型,但对胶质瘤组织标本获得存在较大困难;特别是异质性较高的胶质母细胞瘤依赖组织标本检测存在一定的取样误差。
IDH是三羧酸循环中的重要限速酶,IDH基因突变改变肿瘤细胞的代谢途径和生物学行为,包括甲基化、细胞分化和缺氧诱导因子-1的活性等,从而影响患者的预后[14]。这种代谢和生物学行为的改变可能会引起肿瘤微结构和代谢底物的改变,上述改变可能被MRI结构和功能成像所检出。围绕这一假设,诸多学者广泛开展了利用MRI在体预测IDH基因表型的研究。Metellus等[15]及张劲松等[16]均研究发现IDH突变型胶质瘤好发于额颞叶,单侧生长模式,有锐利的肿瘤边缘,均匀的信号强度和较轻的强化程度。Barajas等[17]通过MR灌注成像发现高血容量肿瘤区域与血管生成和肿瘤侵袭性相关的基因谱,其中就表示IDH突变体有较高的rCBV值。还有学者尝试利用MR波谱分析检测胶质瘤细胞中增高的 2-羟基戊二酸,并表示有望通过MR波谱分析检测2-羟基戊二酸含量以达到反映IDH基因表型的目的[18-20]。本研究通过对比分析MRI特征与IDH基因表型的相关性,发现IDH基因突变的胶质瘤好发于额颞叶,以条片状强化为主,且强化率较低;同时观察到IDH基因突变主要发生于低级别胶质瘤,好发于容易手术切除的额颞叶,与文献报道相似[21-22]。与Metellus等[15]研究中IDH突变型低级别胶质瘤的体积较小和 Carrillo等[22]的IDH突变型胶质母细胞瘤的体积较大不同,本组资料并未观察到病灶的大小及瘤周水肿程度与IDH基因表型的相关性,可能与本组样本量较小有关。
本研究发现,IDH基因突变型的胶质瘤强化方式主要为条片状强化,且其强化率低于IDH野生型,与张劲松等[16]及Qi等[23]利用轻、中、重度划分强化程度不同,本研究测量并计算肿瘤实性部分的强化率,从而避免主观评价一致性不佳的缺点。强化率大的组织具有较快的血管增生或血管生成的速度[17]。Stadlbauer等[24]研究发现肿瘤氧代谢和新生血管与低级别和高级别胶质瘤有关,并进一步发现IDH基因突变型低级别胶质瘤中的脑代谢氧率降低和微血管类型指标增高。此外,强化明显的组织内有较高的血管内皮生长因子水平,而血管内皮因子水平与血管的通透性呈正相关[25]。利用 MR灌注成像测量脑血容量(cerebral blood volume,CBV)和血管通透性等参数,发现IDH突变型胶质瘤的rCBV较高[17]。本研究采用常规MR增强,主要反映血-脑屏障的破坏程度;IDH野生型的肿瘤强化率较高,提示对血-脑屏障破坏较严重,进一步证明IDH野生型胶质瘤的侵袭性及恶性程度越高。
Xiong等[26]利用DTI发现少突胶质细胞瘤中IDH基因突变与最大各向异性分数(fraction anisotropy,FA)较低和最小ADC值较高有关。联合IDH突变状态和最小ADC值可更准确地预测Ⅱ级弥漫性脑胶质细胞瘤患者的预后[27]。理论上,恶性度越高的肿瘤,其细胞越密集,细胞外间隙越小,ADC值越低,故在IDH野生型肿瘤中由于细胞密集而表现为ADC值较低[7]。本研究中并未观察到ADC值的最小值、平均值及最大值与IDH基因表型有相关性,可能与病例数量较少以及并未进行多b值DWI有关。另外,与以往发现IDH野生型常见于年龄偏大的男性不同,本组不同IDH基因表型间患者的年龄和性别差异无统计学意义[15-16]。
本研究存在一定的局限性:①本研究为回顾性分析,病例选择存在偏倚,且扫描采用常规技术,并未采用高级成像如灌注成像和多b值DWI结合非Gaussian模型获取肿瘤多参数特征;②纳入的样本量较小;③在判断某些影像特征时易发生主观判断失误,如在某些情况下,区分水肿与非增强型肿瘤存在困难。
总之,脑胶质瘤的MRI特征与IDH基因表型有关。IDH基因突变型胶质瘤好发于额叶和颞叶、以条片状强化为主、强化率较低。通过定量多模态MRI获得反映胶质瘤微结构和功能改变的信息有望成为在体评价IDH基因表型的影像学标记。
