微量元素锌对牛卵母细胞体外成熟及其体外受精胚胎发育的影响
2019-10-17阮子芸沈朋雷石德顺陆凤花
俸 云,赵 鑫,阮子芸,沈朋雷,石德顺,陆凤花
(广西大学动物科学技术学院,亚热带农业生物资源保护与利用国家重点实验室,广西南宁 530004)
卵母细胞体外成熟(in vitroMaturation,IVM)可以为动物克隆、转基因动物生产提供充足的卵源,尽管人们对卵母细胞的体外成熟体系进行了大量研究,但卵母细胞的体外成熟效率仍然显著低于体内成熟。由于培养环境中氧含量存在差异,体外成熟的卵母细胞会承受更高的氧压,从而导致活性氧(Reactive Oxygen Species,ROS)过量产生。当ROS 的产生速度超过其清除速度时会产生氧化应激,破坏生物大分子的正常结构,从而对体外成熟效率产生影响。
目前研究在体外成熟过程中普遍采用添加抗氧化剂来清除过量ROS。研究表明,通过使用褪黑素[1]、白藜芦醇[2]等抗氧化物质可以降低卵母细胞中的ROS 含量,提高后续胚胎的发育效率。锌作为哺乳动物必需的微量元素,在配子生成、胎儿发育等生理过程中起关键作用[3]。同时,锌还具有抗氧化功能。有研究表明,在培养液中补充适量的锌可以保护细胞免受氧化应激的危害[4]。
尽管锌在哺乳动物正常生理活动的调控过程中起到了关键作用,但其在牛卵母细胞体外成熟过程中发挥的作用尚不明确。本研究以牛卵母细胞为研究对象,通过在体外成熟过程中添加不同浓度的硫酸锌初步探究其对牛卵母细胞体外成熟和抗氧化作用的影响,为提高牛卵母细胞IVM 效率提供基础。
1 材料与方法
1.1 实验样品 牛卵巢购自南宁市肉联厂屠宰场。卵巢在离体后迅速保存于37℃左右经高压灭菌的生理盐水中,并在4 h 内送回实验室;牛冷冻精液(麦管冷冻,250 μL/管)购买自南宁市品改站;卵泡液样本取自直径为2~6 mm 的健康牛卵泡,血液样本采集自体况健康的成年雌性牛颈静脉。
1.2 主要试剂及仪器设备 除特殊说明外,本实验所用试剂均购自美国Sigma-Aldrich 公司。TCM199 粉末和胎牛血清购自美国Gibco 公司,TRIzol Reagent 购自美国Invitrogen 公司,微量反转录相关试剂购自美国Ambion 和Invitrogen 公司;实时荧光定量PCR 试剂购自日本TaKaRa 公司;本试验所用液体由三蒸水配制,经0.22 μm 过滤器过滤灭菌后使用。
体视显微镜和荧光倒置显微镜购买自日本Nikon 公司;实时荧光定量PCR 仪购自美国Applied Biosystems公司;超净工作台购自苏州佳德净化科技公司;培养箱和培养耗材购自美国Thermo Fisher 公司。
1.3 牛卵泡液、颈静脉血清和体外成熟液中锌含量的测定 分别收集健康牛的卵泡液和颈静脉血液各5 个样品,经12 000 r/min 离心10 min 后,取上清并使用0.22 μm过滤器过滤后,保存于-20℃冰箱中。培养液样本选取本实验室所使用的卵母细胞体外成熟液(9.5 g/L TCM 199+2.2 g/L NaHCO3+0.11 g/L 丙酮酸钠+1.2 g/L Hepes+0.009 g/L EDTA+0.06 g/L 青霉素+0.1 g/L 链霉素)。所有样本采集完毕后,尽快送至广西壮族自治区分析测试研究中心,使用电感耦合等离子体质谱仪(ICPMS,美国)对样品中的锌元素含量进行检测。
1.4 牛卵母细胞的收集和体外成熟 牛卵巢经消毒清洗后,使用带有12 号针头的注射器抽取直径为2~6 mm 的卵泡内容物。在体视显微镜下挑选胞质完整均匀、具有完整卵丘细胞的卵丘-卵母细胞复合体(Cumulus-Oocyte Complex,COCs),依次使用洗卵液(CCM:9.5 g/L TCM 199+0.9 g/L NaCl+1.2 g/L Hepes+0.06 g/L 青霉素+0.1 g/L 链霉素+0.4 g/L NaHCO3+2% 胎牛血清)、体外成熟液清洗后,移入含有不同浓度硫酸锌(0、0.4、0.8、1.2、1.6 μg/mL)的体外成熟液中,置于38.5℃、5%CO2、饱和湿度的培养箱中进行体外成熟,24 h 后统计第一极体排出率。
1.5 牛卵母细胞的体外受精和胚胎体外培养 牛卵母细胞经24 h 的体外成熟后,使用移液枪轻轻吹打COCs使卵丘细胞与卵母细胞分离,选取胞质均匀且排出第一极体的卵母细胞,移入由受精液(F 液:TALP 基础液+0.6%牛血清白蛋白+50 mg/L 肝素+2.5 mmol/L 咖啡因)制成的微滴中(每滴25 μL),用石蜡油覆盖,每滴15个卵母细胞。37.5℃水浴解冻牛冷冻精液,将镜检合格的精液转移至含2 mL F 液的圆管底部,置于培养箱中上游30 min,完成精子获能。接着吸取上清,1 500 r/min离心5 min 后,弃上清,将约5 μL 高活力精子均匀加入到含有成熟卵母细胞的微滴中,调整密度为5×106个/mL左右,随后置于38.5℃、5% CO2、饱和湿度的培养箱中共孵育。
体外受精24 h 后,使用移液枪轻轻吹去黏附在合子表面的精子,使用胚胎培养液(CM:9.5 g/L TCM199+2.2 g/L NaHCO3+1.19 g/L Hepes+0.06 g/L 青霉素+0.1 g/L链霉素+3% 胎牛血清)清洗1 次后,移入由CM 制成的微滴中(每滴25 μL),并用石蜡油覆盖,每滴15个早期胚胎,并置于38.5℃、5% CO2、饱和湿度的培养箱中进行培养。隔天换液,并于受精完成后的24 h后统计卵裂率,144 h 后统计囊胚率。
1.6 缺锌处理 参考前人的实验方法[5]对体外成熟液进行缺锌处理。使用10 μmol/L 锌螯合剂N,N,N',N'-tetrakis-(2-pyridylmethyl)-ethylenediamine(TPEN)来诱导缺锌。将卵母细胞分为3 组:①常规体外成熟设为对照组;②10 μmol/L TPEN 处理;③10 μmol/L TPEN+10 μmol/L 硫酸锌处理。随后,通过使用10 μmol/L TPEN 处理不同时间(0、3、5、7 h)以检测缺锌时间对牛卵母细胞体外成熟的影响。
1.7 卵母细胞cDNA 的合成 使用无Ca2+、Mg2+的PBS将体外成熟后的卵母细胞清洗3 次后,移入10 μL cell lysis Buffer 中裂解,每组20 个卵母细胞;置于PCR 仪中75℃孵育15 min 以灭活RNA 酶并释放出卵母细胞中的基因组;之后加入1 μL DNase I 和10 μL 的10×reaction Buffer,37℃孵育30 min,用以消化基因组DNA;再加入1 μL EDTA,2 μL Random Primer,1 μL dNTP,65℃孵育10 min以灭活DNase I;最后加入10 IU Recombinant Rnase inhibitor,4 μL 5×First-Strand Buffer,2 μL dithiothreitol 和0.25 μL的SuperScripTM ⅡRT 进行反转录反应。反应程序:25℃,5 min;42℃,90 min;95℃,5 min;4℃,终止反应。实验所得cDNA 保存于-20℃冰箱中备用。
1.8 总RNA 提取和cDNA 第1 链的合成 应用TRIzol法提取卵丘细胞的总RNA,对纯度和完整性符合要求的RNA 立刻进行cDNA 第1 链合成。反应体系:混合2 μL 5×gDNA Eraser Buffer,1 μL gDNA Eraser 和2 000 ng RNA 模板,再加入RNA-free H2O 补足 10 μL,置于PCR仪中42℃孵育2 min;随后向上一步的混合液中加入4 μL 5×Primerscript Buffer,1 μL Primerscript Enzyme Mix,1 μL RT Primer Mix,最后加入RNA-free H2O;反应程序:37℃,15 min;85℃,5 s。所得cDNA 存于-20℃冰箱中备用。
1.9 卵母细胞内ROS 含量的检测 使用2',7'-Dichloroflu orescin diacetate(DCHFDA)对体外成熟后卵母细胞内的ROS 水平进行检测,每组30 个卵母细胞。使用PBS将卵母细胞清洗3 次后,将卵母细胞移入含有10 μmol/L DCHFDA 的PBS 中,38.5℃避光孵育15 min,接着使用PBS 清洗3 次后置于荧光显微镜下观察并使用软件Image J 对其荧光强度进行分析。
1.10 实时荧光定量PCR(RT-qPCR) 根据NCBI 上已公布的引物序列,使用引物设计软件Primer 5.0 进行引物设计并交由生工生物工程(上海)股份有限公司合成,引物见表1。分别以卵丘细胞和卵母细胞的cDNA 为模板,β-actin为内参,使用相对定量的方法对基因表达的情况进行分析。反应体系为20 μL:SYBR Premix Ex Taq Ⅱ10 μL,ROX Ⅱ 0.4 μL,上、下游引物(10 nmol/L)各0.3 μL,模 板cDNA 1 μL,RNA-free H2O 8 μL。反应程序:95℃,10 min;95℃,30 s;55℃,1 min,共40 个循环。每次检测重复3 次,并根据2-ΔΔCt法计算相关基因的表达差异。
1.11 统计分析 每组实验至少重复3 次,并应用SPSS 17.0 软件,使用单因素方差分析中的Tukey 检验对所得数据进行分析。P<0.05 表示差异显著,P>0.05 表示差异不显著。
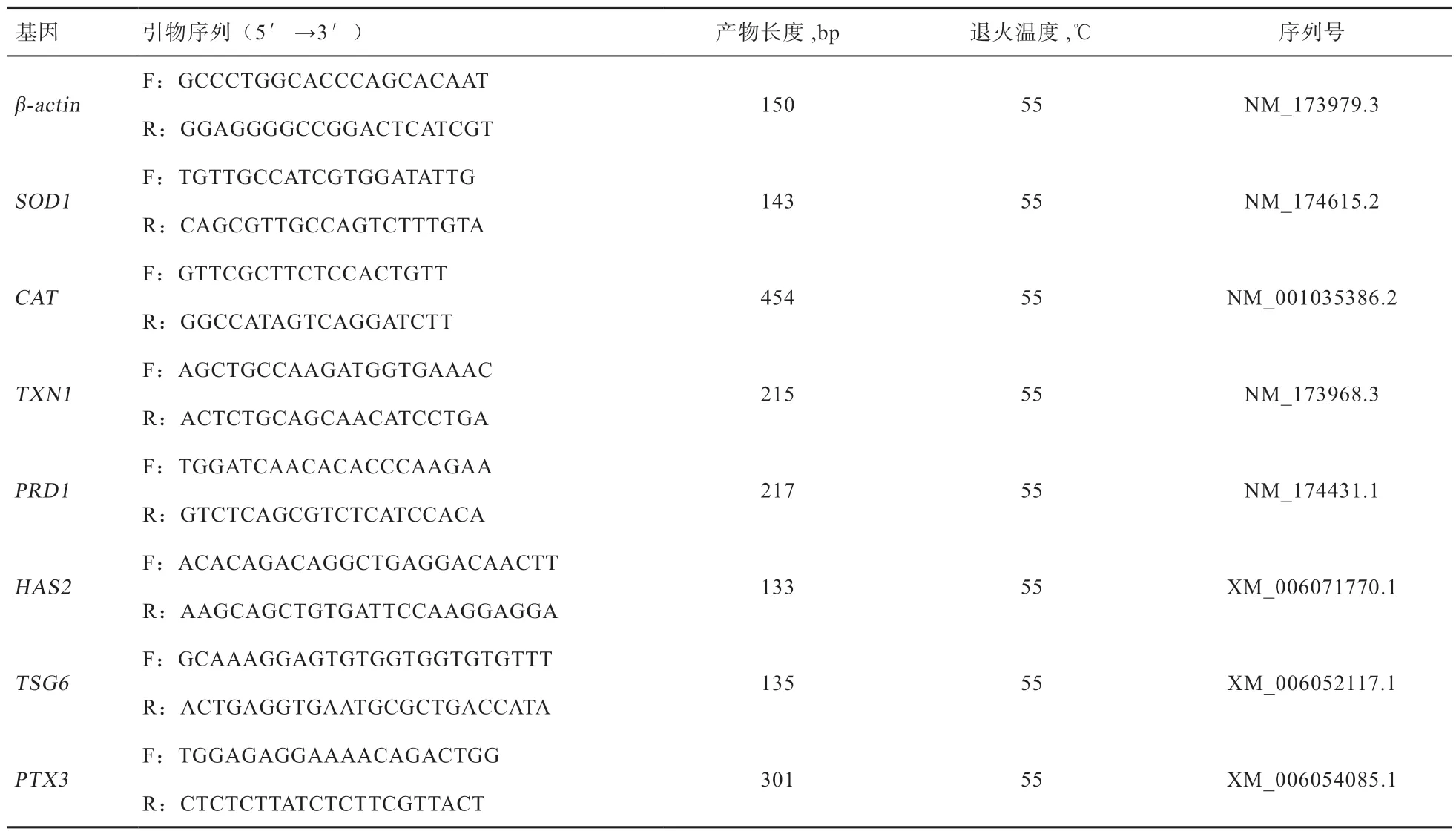
表1 RT-qPCR 引物信息
2 结果与分析
2.1 牛卵泡液、颈静脉血清和IVM 液中的锌元素含量表2 结果表明,体外成熟液中锌元素显著低于牛卵泡液和颈静脉血清。

表2 锌元素含量的检测 μg/mL
2.2 缺锌对卵母细胞体外成熟的影响 表3 结果表明,使用锌螯合剂TPEN 去除体外成熟液中的锌元素后,卵母细胞第一极体排出率显著下降,而补充10 μmol/L 硫酸锌后有所回升。表4 结果表明,缺锌时间超过5 h,卵母细胞的第一极体排出率显著下降,且具有时间依赖性。

表3 缺锌对卵母细胞体外成熟的影响

表4 缺锌时间对卵母细胞体外成熟的影响
2.3 不同浓度硫酸锌对卵母细胞体外成熟及后续发育的影响 表5 结果表明,各处理卵母细胞第一极体排出率无显著差异。表6 结果表明,对添加硫酸锌成熟后的卵母细胞进行体外受精,各组间卵裂率无显著差异;但与对照组相比,添加浓度为0.8 μg/mL 组的囊胚率显著提高。

表5 不同浓度硫酸锌对牛卵母细胞体外成熟的影响
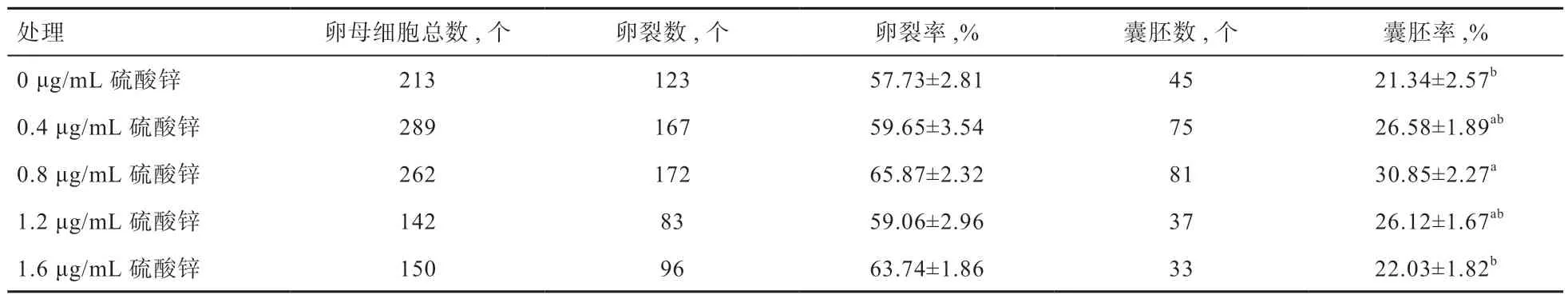
表6 不同浓度锌对牛胚胎体外发育的影响
2.4 锌对成熟后卵母细胞中ROS 含量的影响 图1 表明,与对照组相比,在体外成熟过程中添加0.8 μg/mL硫酸锌可以下调卵母细胞中ROS 水平(P<0.05)。
2.5 锌对相关基因表达的影响 图2 结果表明,与对照组相比,添加0.8 μg/mL 硫酸锌提高了成熟后的牛卵母细胞中抗氧化酶相关基因SOD1、CAT、TXN1和PRD1的mRNA 表达水平(P<0.05)。图3 结果表明,与对照组相比,0.8 μg/mL 硫酸锌组卵丘扩展相关基因PTX3和TSG6mRNA 的表达水平提高(P<0.05),HAS2mRNA 的表达水平有所提高但差异不显著。

图1 添加0.8 μg/mL 硫酸锌成熟后的牛卵母细胞ROS 水平

图2 添加0.8 μg/mL 硫酸锌成熟后的牛卵母细胞抗氧化相关基因的表达变化

图3 添加0.8 μg/mL 硫酸锌成熟后的牛卵母细胞卵丘扩展基因的表达变化
3 讨 论
作为哺乳动物必需的微量元素之一,锌可以与蛋白质、氨基酸、维生素等相互作用,对机体正常的生理活动产生影响。本研究发现,体外成熟液中的锌元素含量显著低于体液,这很可能会对卵母细胞体外成熟及胚胎的发育产生影响。
为确定锌元素是否会对牛卵母细胞的IVM 产生影响,本研究使用锌螯合剂TPEN 去除体外成熟液中的锌元素后进行体外成熟,发现牛卵母细胞的体外成熟效率显著下降,且具有时间依赖性,而补充适量的硫酸锌后成熟效率则出现了部分回升。这表明锌参与了牛卵母细胞的体外成熟。有研究发现,斑马鱼卵泡液中锌元素含量会随着卵母细胞的生长而升高,并在排卵时达到最高[6]。还有研究发现,锌在排卵前和排卵期会影响卵母细胞的成熟和颗粒细胞的功能,缺锌会导致卵丘细胞分化、扩张和卵泡破裂异常,并对卵母细胞体外和体内的发育产生不良影响[7]。这些研究均表明,锌在卵母细胞的发育和成熟过程中发挥了重要作用。有研究发现,极微量的锌就能够参与调控猪卵母细胞的第1 次减数分裂,保证卵母细胞完成核成熟[8]。而在本研究中,在体外成熟液中添加不同浓度硫酸锌(0、0.4、0.8、1.2、1.6 μg/mL)的各组间卵母细胞的第一极体排出率并无显著差异。由于卵母细胞中储存了大量的蛋白质、mRNA 和各种早期胚胎发育必需的微量元素,所以推测本实验中各组卵母细胞第一极体排出率无显著差异的主要原因很可能是牛卵母细胞中已经储存的锌足够用来调控减数第1 次分裂。为进一步探讨不同浓度硫酸锌对牛卵母细胞IVM 质量的影响,本研究对添加不同浓度的硫酸锌成熟后的卵母细胞进行体外受精并统计早期胚胎的发育能力,结果发现,与对照组相比,各组胚胎卵裂率无显著差异,但添加0.8 μg/mL 硫酸锌组的囊胚率显著提高。这表明在体外成熟过程中添加适量的锌元素能够提高卵母细胞的体外成熟质量。另外,有研究报道,添加0.5 μg/mL和1.0 μg/mL 硫酸锌能显著提高牦牛早期胚胎的卵裂率,而添加2.0 μg/mL 硫酸锌则能使牦牛的囊胚率显著提高[9]。本研究的结果与前人的研究结果存在差异,推测与卵母细胞的培养环境以及物种差异有关。
作为抗氧化酶的组成成份之一,锌元素含量很可能会对卵母细胞的氧化还原水平产生影响。本研究发现,添加0.8 μg/mL 硫酸锌后进行体外成熟,卵母细胞中ROS 含量显著降低。由于ROS 在卵母细胞成熟过程中可以通过改变氧化还原途径而导致卵母细胞凋亡及胚胎死亡[10],推测在体外成熟液中添加适宜浓度硫酸锌能降低ROS 含量,减少凋亡,促进成熟质量,进而显著提高牛体外受精胚胎的囊胚率。
抗氧化酶是动物机体内重要的代谢酶,可以去除超氧化物自由基并减少细胞损伤。有研究发现,缺锌会导致抗氧化酶Cu/Zn-SOD 活性位点的三级结构被扰乱,抗氧化能力减弱,从而诱发严重的氧化应激[11],而氧化应激又是参与诱导细胞损伤的一个主要机制[12]。本研究结果表明,经过0.8 μg/mL 硫酸锌处理后,卵母细胞中抗氧化酶基因SOD1、CAT、TXN1和PRD1的表达水平显著提高,这表明在IVM 过程中添加硫酸锌增强了卵母细胞的抗氧化能力。有研究也发现,在神经元细胞的体外培养基中添加锌可以提高神经元细胞中抗氧化酶的活性,促进细胞发育,并提高细胞的存活率[13]。
另外,作为在卵母细胞成熟过程中的关键因素之一,卵丘细胞也发挥了关键作用。卵丘细胞的扩展程度能够对卵母细胞的发育能力产生影响,从而影响卵母细胞的成熟质量[14]。目前学界普遍将卵丘细胞的扩展水平视为评判卵母细胞体外成熟质量的指标之一[15]。本研究发现,在体外成熟过程中添加硫酸锌后卵丘细胞扩展基因PTX3、TSG6的mRNA 的表达水平出现显著上调,提高了卵母细胞的成熟质量。
4 结 论
本研究发现,在牛卵母体外成熟过程中添加0.8 μg/mL硫酸锌可以提高卵母细胞内抗氧化酶基因和卵丘扩展基因的表达水平,降低卵母细胞内ROS 水平,从而提高卵母细胞的成熟质量和体外受精胚胎的发育效率。
