SIRT1/FoxO1通路对奶山羊乳腺上皮细胞脂质合成的影响
2019-10-17梁文双赫秋亚杨芳慧王笑笑邓红雨
李 君 ,梁文双,赫秋亚,杨芳慧,权 凯,王笑笑,邓红雨*
(1.河南牧业经济学院动物科技学院,河南省反刍动物营养与饲料资源开发国际联合实验室,河南郑州 450046;2.西北农林科技大学动物科技学院,陕西杨凌 712100)
羊乳中总脂肪含量高且脂肪酸种类丰富,其短链脂肪酸、中链脂肪酸、不饱和脂肪酸和共轭酸等含量均显著高于牛奶。脂肪含量及脂肪酸组成是影响羊乳风味的主要原因,因此,深入了解奶山羊乳腺乳脂代谢调控机制对改善羊乳品质具有重要意义。沉默信息调节因子1(Silent Information Regulator 1,SIRT1)是 一种烟酰胺腺嘌呤二核苷酸依赖的组蛋白脱乙酰酶,且SIRT1 是调节脂质代谢的关键上游调控因子。在机体内,SIRT1 调节转录因子的活性是通过去乙酰化作用实现,进而调控众多基因转录、能量代谢及细胞衰老[1]。研究表明,SIRT1 通过去乙酰化作用调节叉头蛋白O1(Fork Head Box O 1,FoxO1)转录因子的活性,进而抑制过氧化物酶体增殖物激活受体γ(Peroxisome Proliferator Activated Receptorγ,PPARγ)转录因子的活性[2-3]。PPARγ作为成脂分化因子,可促进脂肪酸合成,加快脂肪沉积的速度。SIRT1 的激活剂白藜芦醇(RES)是一种多酚类物质,可以促进SIRT1 表达,增强其酶活性,并抑制固醇调节元件结合蛋白1(Sterol Regulatory Element Binding Protein 1,SREBP1)下游基因的表达[4]。肌肉中SIRT1 不仅通过去乙酰化作用来参与细胞糖脂代谢,也可通过去乙酰化激活PGC-1α的活性,增强PGC-1α的表达水平,从而加快线粒体中脂肪酸的氧化速度[5]。由此可见,SIRT1/FoxO1 参与调控脂质代谢。PPARγ和SREBP1 是经证实的奶山羊乳腺乳脂合成关键调控因子[6-7]。因此,研究SIRT1/FoxO1 激活对下游乳脂合成基因表达变化和调控机制可以进一步完善奶山羊乳腺泌乳分子机制。
本实验采用SIRT1 激动剂RES 处理奶山羊乳腺上皮细胞,SIRT1/FoxO1 激活后检测乳脂代谢相关基因的表达及甘油三酯(TG)含量,观察细胞中脂滴积累情况,为进一步研究该基因在泌乳过程中脂质代谢的调控奠定基础,为改善羊奶营养价值和风味提供基础资料。
1 材料与方法
1.1 实验材料 RES、油红O、氢化可的松、胰岛素、表皮生长因子、催乳素和牛血清白蛋白(BSA)均购自Sigma 公司;胎牛血清(FBS)购自Gibco 公司;DMEM/F12 培养基购自HyClone 公司;细胞总RNA 提取试剂盒购自北京天根生化科技有限公司;反转录试剂盒和SYBR 荧光定量试剂盒均购自TaKaRa 公司;组织细胞甘油三酯酶法检测试剂盒购自北京普利莱基因技术有限公司。
1.2 细胞培养与处理 奶山羊乳腺上皮细胞由西北农林科技大学奶山羊研究室馈赠,采用含10% FBS、100 U/mL青霉素、100 μg/mL 链霉素、10 ng/mL 表皮生长因子、5 μg/mL 氢 化可得松和5 μg/mL 胰岛素 的DMEM/F12细胞培养基,于37℃、5% CO2培养箱中培养24 h,更换新鲜培养基,倒置显微镜下观察细胞汇合度达90%以上时,即可进行传代培养。将细胞接种于12 孔培养板中,培养至细胞汇合度达60%~70%时,分别添加含有 0(对照)、50、100、150 μmol/L 的 RES 诱导培养基,培养48 h 后收集细胞,用于后续实验检测乳脂合成相关基因的表达,从而确定最佳的处理浓度。
1.3 细胞总RNA 的提取与cDNA 的合成 SIRT1 激动剂处理48 h 后,收集细胞,采用北京天根生化科技有限公司细胞/ 组织总RNA 提取试剂盒提取细胞总RNA,按照说明书进行操作。RNA 样品用紫外分光光度计(NANODROP 2000)测定RNA 样品A260/A280吸收比率值,检测浓度及纯度合格后,以提取的RNA为模板,按照TaKaRa 公司反转录试剂盒说明书步骤,将所有检测合格的RNA 反转录成cDNA。
1.4 实时荧光定量PCR 乳脂合成基因及内参基因实时定量引物见表1,根据GenBank 已公布的山羊基因序列,利用Primer Premier 5.0 和Oligo 6 软件分别设计特异实时荧光定量引物,采用跨内含子的方法,每对定量引物的上、下游引物分布在不同的外显子上,扩增产物长度约200 bp,各引物序列由上海生工生物工程有限公司合成。以GAPDH和UXT基因作为内参进行实时荧光定量PCR 反应。PCR 反应体系20 μL:2×SYBR Premix ExTaqMix 10.0 μL,cDNA 模板1.0 μL,上、下游 引物(10 μmol/ L )各0.8 μL,加RNase free H2O 补足体系。于ABI 7500 荧光定量PCR 仪上进行反应,反应条件:95℃ 30 s,95℃ 5 s,60℃ 30 s,40 个循环;添加熔解曲线。采用2-△△Ct法对数据进行分析,其中△Ct=Ct目的基因-Ct内参;△△Ct=△Ct试验组-△Ct对照组。每个样品设置3 个重复。
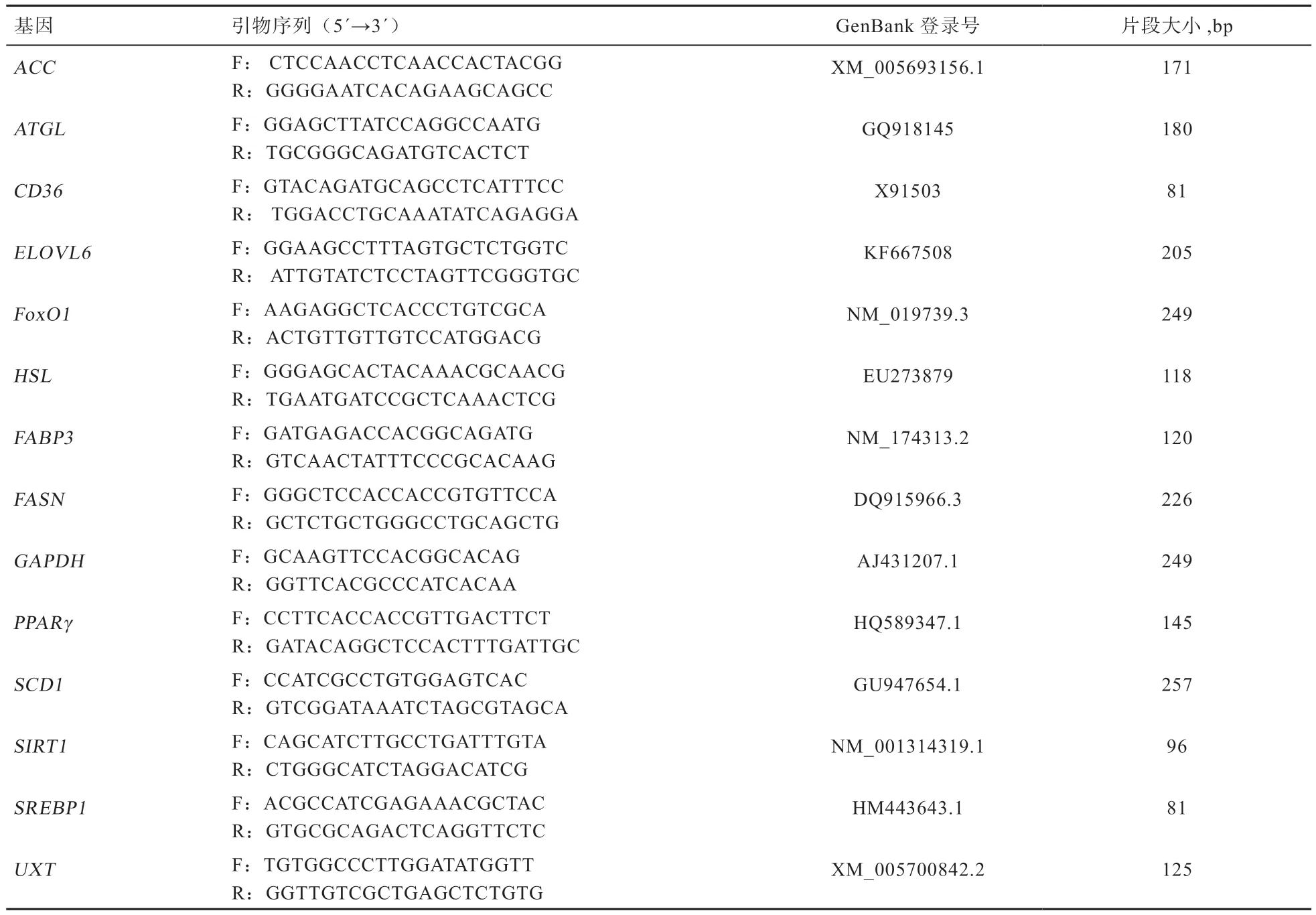
表1 实时定量引物序列
1.5 TG 含量测定 最适浓度的RES 处理奶山羊乳腺上皮细胞48 h,用0.25%胰蛋白酶/EDTA 混合液消化并收集细胞沉淀,用PBS 清洗沉淀2 遍,再将细胞转移至1.5 mL 离心管中,每管加入200 μL PBS 后将细胞超声破碎,按照细胞甘油三酯酶法检测试剂盒给出的操作方法检测细胞内TG 含量,取适量裂解液70℃水浴加热10 min,室温下2 000 r/min 离心 5 min,保留上清用于酶学测定,将10 μL 上清液与190 μL 工作液37℃反应 10 min,用全自动酶标仪于550 nm 波长处测吸光度(OD550nm)[6]。
1.6 油红O 染色 细胞用激动剂RES 处理48 h 后,弃去培养基,用PBS 清洗2 遍;10% 中性甲醛加入到培养板上,固定细胞45 min;每孔细胞加入1 mL 油红O染色30 min;最后用PBS 清洗3 遍,于倒置显微镜下进行观察拍照。
1.7 统计分析 运用SPSS 22.0 统计学软件进行数据分析,采用t检验和One-Way ANOVA 进行方差分析,结果以平均值±标准差表示,以P<0.05 表示差异显著性判断标准。
2 结果
2.1 不同浓度RES 对SIRT1/ FoxO1 通路关键因子mRNA表达的影响 如图1 所示,与对照组相比,不同浓度的RES 处理均能使SIRT1基因的mRNA 表达量上升,其中最佳RES 处理浓度为100 μmol/L(P<0.05)。与对照组相比,100 μmol/L RES 处理组的FoxO1基因mRNA表达量上调(P<0.05)。
由图2 可见,RES 处理浓度为100 μmol/L 时,SREBP1的相对mRNA 表达量较对照组下降(P<0.05);PPARγ的表达量在RES 处理浓度为100 μmol/L 和150 μmol/L时均显著下降(P<0.05)。由此得出,RES 的最佳处理浓度为100 μmol/L。
2.2 SIRT1/FoxO1 激活后对乳代谢相关基因表达的影响由图3 可见,与对照组相比,SIRT1/FoxO1 通路激活后,脂肪酸合酶(FASN)和硬脂酰辅酶A 去饱和酶1(SCD1)基因(P<0.01)和脂肪酸转运基因(CD36)的mRNA 表达量(P<0.05)下降;而脂解相关基因激素敏感脂酶(HSL)(P<0.01)和甘油三酯水解酶(ATGL)基因上调(P<0.05);乙酰辅酶A 羧化酶(ACC)、脂肪酸结合蛋白(FABP3)和超长链脂肪酸延伸酶6(ELOVL6)基因则无显著变化。
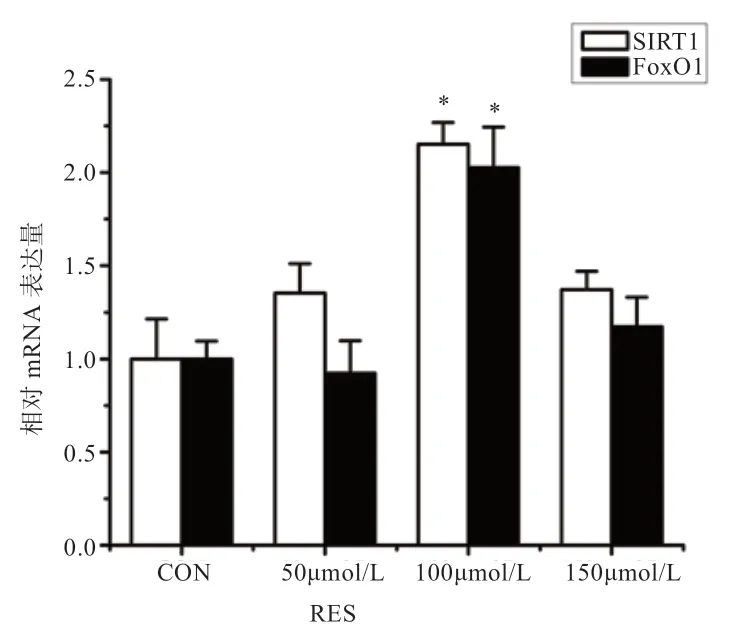
图1 不同浓度RES 对SIRT1 和FoxO1 基因表达的影响
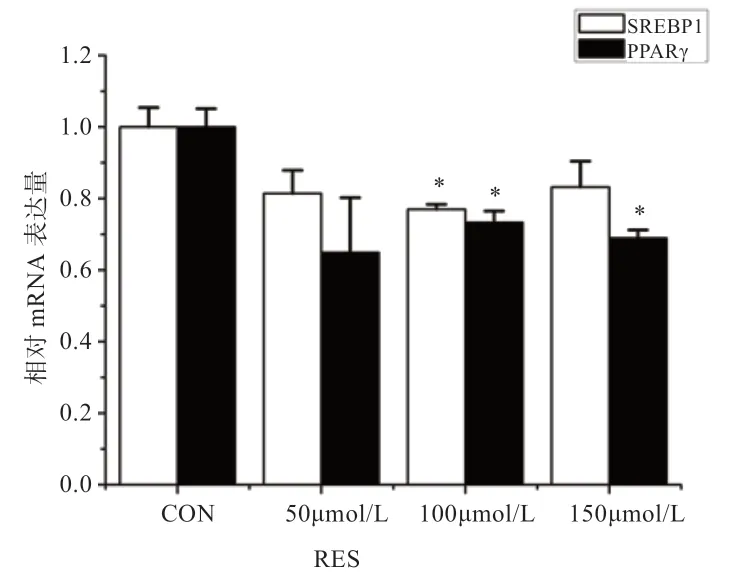
图2 不同浓度RES 对SREBP1 和PPARγ 基因表达的影响
图3 SIRT1/FoxO1 激活后对乳脂合成相关基因表达的影响
2.3 SIRT1/FoxO1 对细胞TG 含量的影响 如图4 所示,SIRT1/FoxO1 通路激活后,RES 处理组细胞中TG 含量下降(P<0.05)。
2.4 SIRT1/FoxO1 对细胞中脂滴积累的影响 由图5 可见,与对照组相比,SIRT1 激活后细胞核周围脂滴积累明显减少,表明SIRT1基因抑制脂滴的积累。
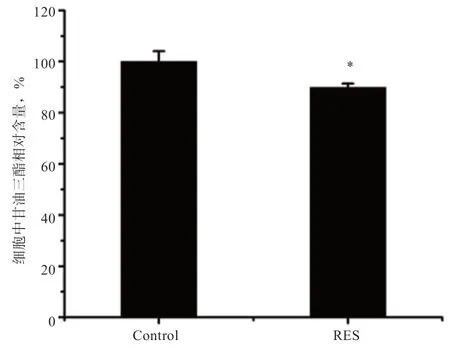
图4 SIRT1/FoxO1 激活对细胞中TG 含量的影响
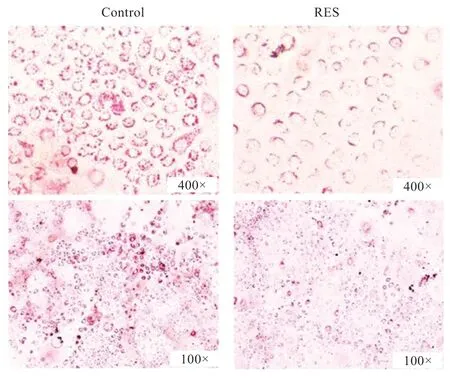
图5 SIRT1/FoxO1 激活对细胞中脂滴积累的影响
3 讨 论
SIRT1 是调控脂质代谢的关键上游因子,关于SIRT1 的研究主要集中在肥胖等疾病方面,但也发现SIRT1 通过一系列信号通路发挥作用调控脂质代谢基因表达[8]。SIRT1 通过去乙酰化作用激活FoxO1,而FoxO1 通过调节不同的靶基因发挥其功能,PPARγ是其中的一个重要靶基因,二者结合可抑制脂肪细胞的分化,而PPARγ本身是促进脂肪沉积,说明FoxO1 抑制PPARγ的表达。因而,SIRT1/FoxO1 与脂肪代谢密切相关。本研究发现,100 μmol/L RES 的处理浓度细胞生长状态良好,并且能够上调SIRT1和FoxO1基因的mRNA 表达,从而确定奶山羊乳腺上皮细胞的最佳处理浓度为100 μmol/L,为后续实验提供科学依据。
在脂肪组织中的研究表明,SIRT1 可通过与核受体以及视黄酸受体协同抑制PPARγ,削弱其对脂质合成的促进作用[3]。利用RNAi 技术沉默小鼠前体脂肪细胞中的SIRT1基因以后,PPARγ转录因子活性发生改变[3]。在肝脏中发现,SIRT1 活化后上调丝氨酸-苏氨酸蛋白激酶表达,进而抑制ACC和FASN表达,从而减少肝脏脂肪的沉积[9]。在奶山羊乳腺中,乳脂的合成主要包括脂肪酸从头合成、TAG 生成和脂滴形成3 个阶段,由多个转录因子及功能基因协作完成,并与脂肪酸运输、脂肪酸氧化、脂解作用等相关[10]。研究表明,SREBP1和PPARγ是调控泌乳过程的关键因子,通过结合功能基因启动子上诱导基因的转录[11]。本研究中,SIRT1/FoxO1 激活后,SREBP1和PPARγ表达量下降,同时细胞内FASN表达量也随之下降,推测奶山羊乳腺上皮细胞中脂肪酸从头合成受阻,细胞内短中链脂肪酸含量降低。本实验中,SIRT1/FoxO1 激活促进脂解相关基因HSL和ATGL的表达,由于脂肪酸的从头合成过程受阻,细胞内脂滴合成原料生成受限,HSL和ATGL基因表达上调,通过脂解提供脂肪酸,有利于乳腺泌乳功能的维持。转录因子FoxO1 可被脱磷酸作用/脱乙酰作用调节,导致其核转位而诱导脂解限速酶ATGL的转录,SIRT1 对脂类代谢的作用是建立在FoxO1 调节ATGL表达的基础上[12]。在奶山羊乳腺细胞中,Yao 等[13]研究表明PPARγ调控SCD1基因的表达,通过结合在SCD1基因的启动子上调控其转录。本实验中,由于SIRT1/FoxO1 的激活抑制了PPARγ表达,从而导致其靶基因SCD1表达下降。可见,SIRT1/FoxO1 通过调控关键转 录 因 子SREBP1和PPARγ进 而 调 控SCD1、FASN和ATGL的表达。本实验中,SIRT1/FoxO1 激活后,ACC、FABP3和ELOVL6的表达没有发生变化,具体的调控机制还需进一步深入研究。
SIRT1 可通过一系列信号通路抑制转录因子PPARγ和SREBP1的活性,而SIRT1 对PPARγ和SREBP1的抑制作用可减少脂质的合成与沉积[12]。在培养的小鼠3T3-L1 脂肪细胞中,敲除SIRT1后,FoxO1的乙酰化和磷酸化水平提高,ATGL表达减少,从而导致细胞中TG 的水解作用降低[12]。Picard 等[3]研究发现,大鼠3T3-L1 成纤维细胞过表达SIRT1时,细胞内脂肪含量降低,而SIRT1的低量表达引起TG 增加。研究还发现,人类肝癌细胞 Hep G2 中莫纳可林 K 通过激活SIRT1-AMPK 通路,使 FoxO1 产生脱磷酸和核转运作用,造成细胞内脂肪含量降低[14]。SIRT1-AMPK 通路的激活通过对FoxO1 的脱磷酸作用/脱乙酰基作用来调节下游基因ATGL的转录,进而调节动物脂类分解代谢作用。本研究中,RES 激活SIRT1 后,奶山羊乳腺上皮细胞中TG 含量降低,脂滴积累减少,结合乳脂合成相关基因表达结果,推测其原因是SIRT1 激活后,使FoxO1 脱磷酸和核转运作用,抑制了脂肪沉积转录因子SREBP1和PPARγ的转录活性,进而抑制了FASN的表达,促进了脂解基因ATGL和HSL的表达,最终使细胞中TG 含量下降,脂滴积累减少。由此说明,SIRT1对SREBP1和PPARγ介导的乳脂肪生成途径具有拮抗作用,SIRT1 通过对SREBP1和PPARγ的负调节作用抑制乳脂生成基因的表达,从而抑制乳脂肪的合成。
4 结 论
本研究中,最适宜浓度100 μmol/L RES 激活SIRT1/FoxO1 通路,抑制乳脂调控转录因子(SREBP1、PPARγ)和乳脂合成相关基因(FASN、CD36和SCD1)的表达,上调脂解基因(HSL和ATGL)的表达。SIRT1/FoxO1 通路激活后,细胞中TG 含量显著降低,细胞中脂滴积累减少。表明SIRT1/FoxO1 负调控奶山羊乳腺上皮细胞脂质合成。
