猪重要经济性状QTLs定位研究进展
2019-10-17贺艳娟郑恩琴刘德武吴珍芳洪林君蔡更元
周 臣,胡 群,贺艳娟,顾 婷,郑恩琴,刘德武,吴珍芳,洪林君,蔡更元
(华南农业大学动物科学学院,国家生猪种业工程技术研究中心,广东广州 510642)
数量性状基因座(Quantitative Trait Loci,QTL)概念最早由Geldermann[1]于1975 年提出,即控制数量性状的基因座位,QTL 是指对复杂数量性状有较大影响的单一基因或紧密连锁的基因簇在基因组中的位置。传统数量遗传学理论是基于孟德尔遗传定律在宏观上以种群表型性状程度差异来推测其可能的多基因效应,即2 个或更多基因的产物及其环境。近十几年来随着分子遗传学的发展和应用,通过鉴定的分子标记(如SNP 或AFLP)与观察到的性状相关来映射QTL 成为主要的研究方式。在猪的育种工作中,最初经济选育的需求主要体现在生产力上,1994 年Andersson 等[2]首次对猪的生长和肥胖的QTL 进行了定位,揭开了在猪分子育种上的序幕。之后许多科学家投身于猪分子遗传育种工作,大量QTL 逐渐被发现和定位。基于这些QTL 的定位和猪全基因组测序,猪的基因遗传图谱逐渐成形。目前的研究一方面完善该图谱,另一方面在猪育种上利用已定位QTL 有重要的实践指导意义,且在该基因图谱基础上开辟新的可行育种途径。
1 QTL 定位方法
QTL 定位就是利用标记辅助选择(MAS)或标记辅助导入等数理统计的方法,分析整个基因组DNA 分子标记和数量遗传性状表型值的关系。检测QTL 的存在并将其定位在遗传图谱上,确定遗传标记与QTL 间的遗传距离(以重组率表示),并估测QTL 的遗传效应。根据标记数目的不同可分为单标记、双标记和多标记几种方法。根据统计分析方法的不同可分为方差与均值分析法、最小二乘多元回归分析法、矩估计及最大似然法等。根据标记区间数可分为零区间作图、单区间作图和多区间作图。此外,还有将不同方法结合起来的综合分析方法,如QTL 复合区间作图(CIM)、多区间作图(MIM)、多QTL 作图、多性状作图(MTM)等。下面以候选基因法(Candidate Gene Approach)、标记-QTL连锁分析(Mark-QTL Linkage Analysis)、比较基因组学(Comparative Genomics) 和SNP 芯片遗传标记4 种定位检测方法进行比较分析。
1.1 候选基因法 候选基因法的原理是根据已有的生理生化背景知识来假设所标记的基因或验证其是影响某经济性状的主基因。该方法是直接从已知或潜在的基因系统中挑选出可能对该性状有影响的候选基因,然后采用分子生物学、全基因组关联分析等技术检测其候选基因的多态性。基本步骤:首先选择合适的标记性状及种质群体,然后进行系间杂交获得F2代,再检测各世代的数量性状及其相关染色体上的基因型,最后通过遗传标记与数量性状之间是否存在连锁关系,并利用数学统计方法确定其效应大小[3]。
1.2 标记-QTL 连锁分析 标记-QTL 连锁分析也称为基因组扫描法(Genomic Scanning Approach),即利用微卫星标记进行连锁分析,其分为单标记分析和群体标记。前者使用标记平均值不能获得QTL 效应的单独估计值和QTL 与标记的重组频率,因此不能区分标记连锁是QTL 大效应松散还是小效应紧密。后者是在整个基因组内进行,首先根据侧翼标记信息对某一个区间内的QTL 基因型的条件概率进行计算,然后将连续若干区间使用最小二乘法或最大释然法进行分析,计算每个区间的检验统计量,根据最大检验统计量存在的区间即为QTL 可能存在的位置。
1.3 比较基因组学 比较基因组学是基于基因组图谱和测序基础,对已知的基因和基因组结构进行比较,来了解基因的功能、表达机理和物种进化的学科。比较基因组学分为种内比较和种间比较。在猪的性状定位研究上,则利用种间比较即印记QTL 法,该方法利用模式动物(如小鼠、猴等)的基因组与猪基因组之间编码顺序和结构上的同源性并结合其他辅助标记来定位其相关性状与基因位点的连锁关系及效应大小[4]。
1.4 SNP 芯片遗传标记 单核苷酸多态性(Single Nucleotide Polymorphism,SNP)主要是指在基因组水平上由单个核苷酸的变异所引起的DNA 序列多态性。在基因组上单个核苷酸的变异包括置换、颠换、缺失和插入。从1996 年美国学者Lander 提出的第3 代DNA 遗传标记开始,SNP 研究越来越迅速,已经成为畜禽育种中重要的研究工具。由于多数方法只能将QTL 定位到一个区间而非具体位置,且具有较高的假阳性。为此,提出利用全基因组上的SNP 标记,通过emBayesB 方法和性状-标记回归区间分析相结合的组合方法进行QTL 定位研究。组合方法能够筛选出与QTL 存在较强关联的SNP 标记,具有较高的计算速度和计算效率;通过性状-标记区间检测,能够较为精确地计算出QTL 的位置[5]。
2 猪遗传图谱分析
猪的QTL 研究涵盖众多具有经济价值的数量性状,相关文献报道了27963 个QTL(表1、2),包括滴水损失、背膘面积、眼肌面积、胴体长、平均日增重、瘦肉率、乳头数、第10 根肋骨处背膘厚、腿臀重、最后肋骨处背膘厚、屠宰后pH24h、肌内脂肪含量、背最长肌pH、黑瘤易感性、肉色-L、屠宰率、应激能力、肩部皮下脂肪厚度、屠宰重、出生重等(图1);每年发现的QTL 数量不断增加;相关QTL 的文章数量也不断增长(图2);近年来越来越多QTL 已运用到动物生产中,产生了巨大经济价值。
3 猪QTL 定位应用
迄今为止已鉴定出众多影响家畜数量性状的基因,其育种和生产具有极大的应用价值,且许多基因已投入应用,包括雌激素受体基因、肥胖相关基因、生长激素基因、自然抗病力有关的大噬菌体蛋白 1 基因等,由于QTL 数量众多,对生猪的经济性状按其功能大致可分为繁殖性状、生长性状、肉质性状、抗病性状等4 类,以下分别介绍影响这4 类数量性状的主效/候选基因。

表1 猪已检测QTL 在染色体上分布情况

表2 按猪表现性状分类的QTL 数量

图1 猪检测到QTL 最多的前15 个性状排名
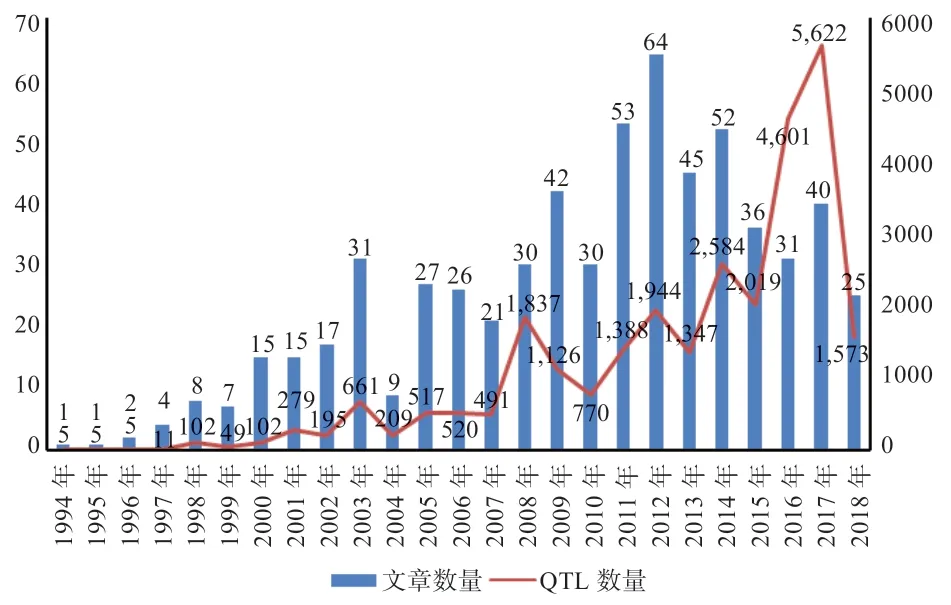
图2 1994—2018 年猪QTL 研究文章和QTL 数量
3.1 繁殖性状 猪的繁殖过程包括卵子和精子的发育以及受精卵在母体子宫发育,激素在该过程中起到重要的调控作用。影响猪繁殖性状的因素有很多,包括产仔数、黄体数、子宫长度等。在产仔数方面,Rothschild 等[6]把该主效基因-雌激素受体(ESR)定位于1p2.4~2.5,通过候选基因法对中国梅山猪杂交显示,含有50%梅山背景的合成系的母猪得益于该纯合等位基因,比来自同一合成系的母猪在第1 胎次中多产2.3 头;Jiang 等[7]研究表明,GnRH基因、LHR基因在对黄体生成数方面有重要作用;Sato 等[8]研究发现,猪FSHR基因与卵泡产生及其数量有重要联系,从而影响繁殖性能。影响繁殖性状方面的QTL 基因目前已经发现了2 129 种(表2),除上述对繁殖有重要影响的基因之外,其他部分相关影响基因见表3。

表3 影响猪繁殖性状的部分主效基因或候选基因
3.2 肉质性状 影响猪肉品质的因素很多,包括营养、遗传、环境等。在遗传方面,其肉质性状存在如酸肉基因、氟烷基因之类的主效基因,但肉质性状大多是多基因控制的数量性状。随着人们生活水平的提高,对猪肉品质要求也越来越高,如何提高瘦肉率并在此基础上提高肌内脂肪含量、不饱和脂肪酸水平等指标显得尤为重要。Kim 等[20]研究显示,存在于猪6 号染色体上的LEPR基因对肉中胆固醇水平、二十碳烯酸含量、亚油酸含量、胴体脂肪面积百分比等有影响;瘦素基因在动物生长、肥胖和身体组成中起着基础性的作用;Pérez-Montarelo 等[21]在研究伊比利亚×长白猪实验杂交猪LEP基因序列,以鉴定与生产力和品质性状相关的基因多态性结果显示,在伊比利亚猪中固定的LEP g.1387C>T 和LEPR c.1987C>T 的T 等位基因将导致脂肪生长、脂肪含量和饱和脂肪酸含量增加,同时这可以通过增加采食量来解释其影响。常见的猪肉品质还包括色泽、酸肉(AP)、质地以及滴水损失等,而这些都与氟烷基因和酸肉基因的表达有关;Salas 等[22]研究表明,PSE肉与隐性氟烷(Hal)等位基因Haln的表达有关。隐性Hal 猪的肌质网内含有缺陷的Ca2+释放通道(CRC)或Ryanodine 受体(RYR1),其允许Ca2+在应激反应中不受控制地释放。屠宰前应激引起的乳酸代谢异常导致死后肌肉pH 突然下降,产生PSE 猪肉。相反,AP 是由Rendement Napole基因的显性RN等位基因引起的。RN-猪具有高糖酵解潜力,由于死后过量的乳酸产生导致较低的pH。PSE 和AP 肌肉细胞的持水能力,容易导致过度的滴水损失进而影响烹饪及肉制品的加工。与更准确的基因标记物测试相比,评估Hal和RN基因型的常规方法效果较差,通过针对Haln和RN等位基因的基因组选择可以在更短的时间内降低缺陷基因的频率[22]。随着更多QTL 的确定,育种工作者能够更有效地选择性状,以提高养猪生产效率,提高猪肉品质。影响肉质的部分基因见表4。
3.3 生长性状 生长性状也称生长胴体性状,如何提高和改善生长性状是目前动物育种工作者重要的研究热点。提高动物群体中生长优势基因的频率、降低劣势基因是该育种选择的主要方向。衡量生猪生长性状的指标有平均日增重、出生重、背膘厚、肋骨形态、体宽等。Casas-Carrillo 等[34]的研究集中证明了IGF-1基因型与断奶后平均日增重(ADG)存在连锁(LOD=2.3)。Tu 等[35]测定了杜洛克猪MSTN 基因的435 G/447A 等位基因会增加杜洛克猪的ADG 和饲料效率(FE),并缩短体重达到110 kg 的日龄,该基因并可用于猪育种计划中。同时,肥胖基因、类胰岛素生长因子-Ⅰ基因、类胰岛素生长因子-Ⅱ基因等均对出生日增重等生长性状产生影响,其他影响生长性状的部分基因见表5。

表4 影响猪肉质性状的部分主效基因或候选基因
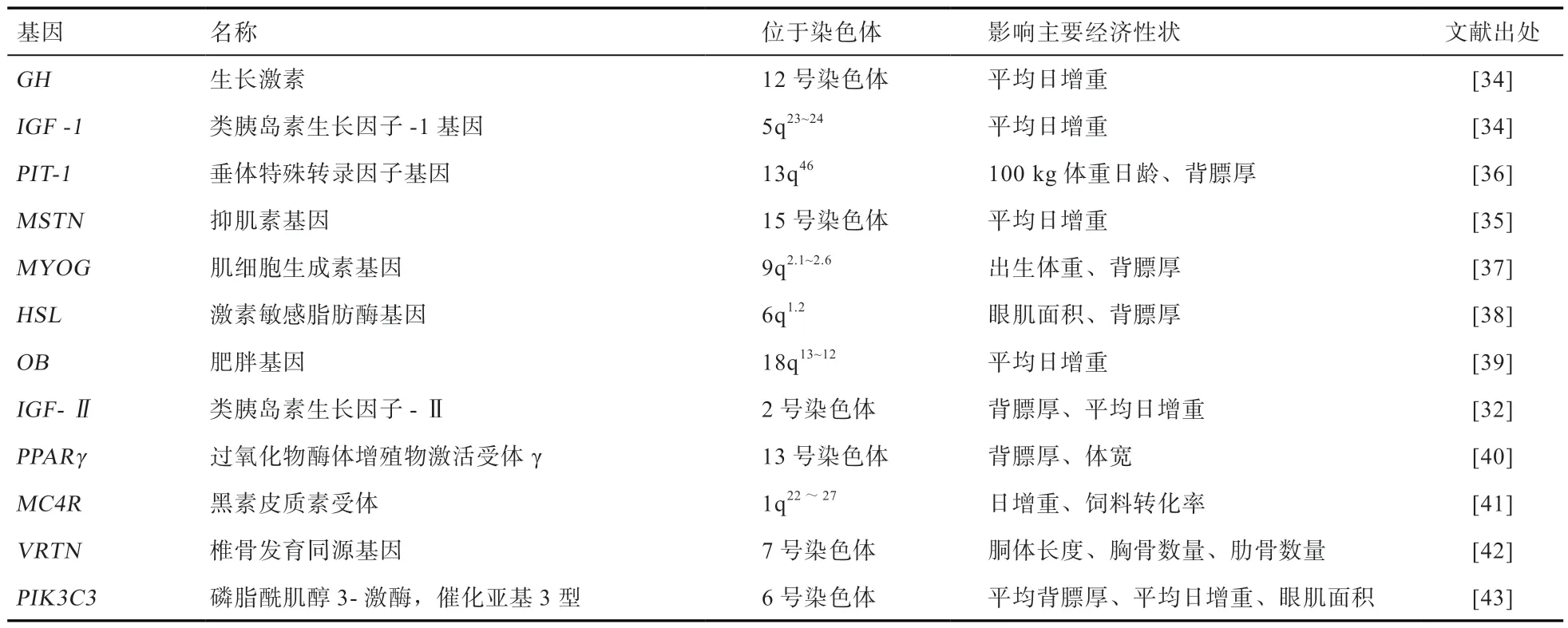
表5 影响猪生长性状的部分主效基因或候选基因
3.4 抗病性状 在生猪养殖过程中,面临最大的生产风险就是疾病防控。疾病防控一方面可在饲养管理层面进行,如环境管理、添加药物预防;另一方面则可从提高动物本身体质来抵抗疾病的侵入,除了营养搭配外,抗病基因的筛选和研究受到育种工作者重视。Sun 等[44]把天然抗性相关巨噬细胞蛋白1(NRAMP1)基因定位到猪15 号染色体上,研究表明NRAMP1是猪对沙门氏菌感染的潜在候选基因[44]。Sun 等[45]研究将猪TAP1基因定位于7 号染色体(SSC7),并与标记SSC2B02(保留率=43%,LOD=15.18)紧密连锁。半定量基因表达(RT-PCR)分析表明,TAP1在免疫组织及免疫相关组织中有选择性表达[45]。除此,SLA基因、FUT1基因、ETEC的受体基因等都与猪的抗病性状有关,部分抗病基因见表6。
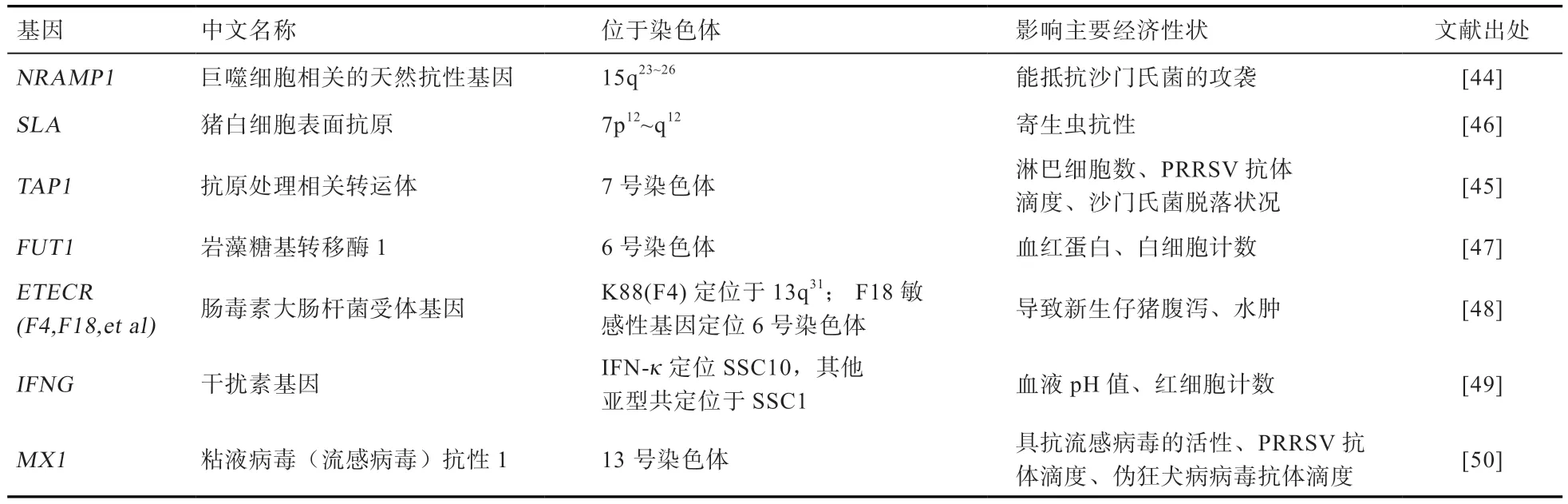
表6 影响猪抗病性状的部分主效基因或候选基因
4 展 望
近二十年来对猪的数量性状的基因研究越来越深入、发现数量越来越多,除了进行辅助标记选择育种之外,从基因组水平上利用基因编辑技术来修改数量性状基因座以提高动物的经济效益开始受到重视。但许多基因的影响不仅仅是体现在某一单一性状上面,如定位于6 号染色上的猪骨骼肌兰尼定受体基因,该基因在对肉质(酸肉)、生长胴体(背最长肌pH、背膘厚、日增重)、抗病性(软骨病)等性状方面都有重要的影响;同时,某一性状不是仅由一种基因决定,如数量性状产仔数是由下丘脑-垂体-性腺轴上多个基因决定。所以某一性状具有多个QTL 和多个候选基因,同一性状的不同基因或QTL 间关系十分复杂,其关系也常存在协同或拮抗作用,因此进行标记辅助选择的研究投入较大,且研究停留在对单个基因的针对性研究上;如果运用基因编辑进行动物育种也可能面临着基因改变导致非特异性状改变的威胁。因此在猪的QTLs 基因定位数量越来越多时,其基因功能解析也显得越发重要。
