急性缺血性脑卒中患者CYP2C 19基因分型与临床预后的相关性分析
2019-10-17唐晓刚姚蓓蓓杜雯雯曹小峰吴明华
胡 鑫,朱 清,唐晓刚,姚蓓蓓,杜雯雯,夏 鑫,曹小峰,吴明华
缺血性脑卒中具有高致残、致死风险,长期服用抗血小板药物是治疗本病的主要有效手段。但是,近年来有越来越多的报道都指出[1],部分卒中患者在长期规律性应用抗血小板药物(如氯吡格雷、阿司匹林等)后,再发卒中的几率仍较高,患者的预后并不满意。相关学者指出[2],一些患者在规律性应用氯吡格雷后并未产生抗血小板作用,这类患者发生了氯吡格雷抵抗。基因学层面的研究指出[3],人体内相关过程蛋白基因的多态性是诱发氯吡格雷抵抗的重要因素,氯吡格雷代谢基因的点位基因突变是影响氯吡格雷药效发挥的关键因素。CYP2C19是参与氯吡格雷代谢所不可或缺的基因,若CYP2C19发生基因突变,将会对氯吡格雷代谢过程产生重大影响,进而影响到药物疗效。CYP2C19基因的突变等位基因多达25个,其中至少有10个点位基因突变会对酶活性表达产生影响,其中*2、*3是亚洲人CYP2C19基因突变频率较高的两个位点,CYP2C19*2和CYP2C19*3基因突变均为功能缺失型等位基因,即表现为降低药物浓度的弱代谢型。本研究旨在明确CYP2C19*2和CYP2C19*3基因突变对急性缺血性脑卒中患者临床预后的影响,以指导弱代谢型基因患者的临床用药,为缺血性脑卒中的抗血小板药物治疗提供理论依据。
1 资料与方法
1.1 一般资料 选取2015年6月~2017年6月在本院神经内科住院治疗的156例急性缺血性脑卒中患者作为研究对象。根据CYP2C19基因型检测结果分为野生型组(GG)和突变型组(GA/AA):野生型组80例,男36例,女44例,年龄42~83岁,平均年龄(63.36±7.60)岁,合并高血压34例、糖尿病18例、高脂血症36例、缺血性心脏病12例,吸烟33例、饮酒41例;突变型组76例,男32例,女44例,年龄48~80岁,平均年龄(64.69±8.56)岁,合并高血压30例、糖尿病17例、高脂血症27例、缺血性心脏病9例,吸烟34例、饮酒36例。两组患者的一般资料比较,差异不具有统计学意义(P>0.05)。
入组标准:(1)符合《中国急性缺血性脑卒中诊治指南》[4]制定的急性缺血性脑卒中诊断标准;(2)经头部MRI或CT检查确诊;(3)入院后口服氯吡格雷,剂量75 mg/d,持续用药时间>1 w;(4)发病时间<14 d;(5)卒中发生后未酗酒或吸烟;(6)非心源性因素引起的脑梗死。
排除标准:(1)合并恶性肿瘤、急性胃炎胃出血、癫痫、严重肝肾功能不全、免疫系统疾病、严重感染、急性心梗、房颤者;(2)合并脑肿瘤、颅内感染、脑梗死后出血、脑出血、神经变性疾病、短暂性脑缺血发作者;(3)近6 m接受过重大手术或有重大外伤史者;(4)接受透析治疗者;(5)凝血功能障碍者,或正在应用抗凝血药物者;(6)脑静脉血栓性梗死者;(7)入院后应用过质子泵抑制剂者。本次研究通过了医院伦理委员会批准,患者知情同意,并签署了知情同意书。
1.2 方 法
1.2.1 CYP2C19*2和CYP2C19*3基因型检测 采集患者的肘正中静脉血2 ml,以EDTA真空抗凝管保存,置于-20 ℃的冰箱中保存待检。选用德国GIAGEN公司生产的DNA提取试剂盒,严格按照试剂盒上的操作说明提取血液标本基因组的DNA。使用美国Sequenom公司生产的MassARRAY iPLEX基因型分析仪及配套软件系统进行检测,并使用ABI公司生产的9700型PCR扩增仪,对CYP2C19*2和CYP2C19*3位点所在DNA片段进行扩增。引物设计使用Assay Design Suite软件。
CYP2C19*2(G681A)的引物为:F5’-ACCAGAGCTTGGCATATTGTATCT-3’,R5’-GATTCTTGG-TGTTCTTTACTTTCT-3’。CYP2C19*3(G636A)的引物为:F5’-TTTCAT-CCTGGGCTGTGCTC-3’,R5’-TGTACTTCAGGGCTTGGTCAAT-3’。
1.2.2 血小板抑制率测定 两组患者均在应用氯吡格雷1 w后进行血小板抑制率检测,采集空腹肘静脉血3 ml,使用EDTA真空抗凝管保存,采血后2 h内完成血小板抑制率测定。检测方法选用血栓弹力图法,仪器选用Haemoscope公司生产的5000型血栓弹力图法凝血分析仪,试剂包括高岭土、激活剂F、ADP。检测通道包括高岭土、激活剂F、激活剂F+ADP共3个,使用血栓弹力图法软件计算出血小板抑制率。根据ADP诱导的血小板抑制率,分为氯吡格雷抵抗(血小板抑制率≤40%)和氯吡格雷敏感(血小板抑制率>40%)。
1.2.3 随访及预后 所有患者出院后均进行为期1 y的随访,随访方式包括门诊复查、再入院记录、电话询问等。随访过程中,使用改良RANKIN量表[5](mRS)对患者进行评分,用以评估患者的转归情况。量表根据患者症状严重程度评0~5分,完全无症状为0分,有症状但无明显残疾,可完成所有经常从事的工作与活动为1分;轻度残障,不能完成所有以前从事的活动,但可独立处理个人事务计2分;中度残疾,处理个人事务需他人协助,但可独立行走计3分;中度残障,行走需要他人协作,不能照顾自己的身体需要计4分;严重残障,卧床、大小便失禁,需要他人的持续照护计5分。mRS评分>2分判定为预后不良。记录两组患者在随访期间的心脑血管不良事件发生情况,包括卒中复发、短暂性脑缺血发作、心源性死亡、非致死性心肌梗死等。

2 结 果
2.1 CYP2C19突变等位基因频率及基因型频率 CYP2C19突变等位基因频率及基因型频率分布(见表1)。CYP2C19*2和CYP2C19*3等位基因的分布频率符合Hardy-Weinberg平衡。
2.2 CYP2C19基因型与血小板抑制率、氯吡格雷抵抗的关系 野生型组患者的平均血小板抑制率为(42.42±2.74)%,突变型组为(32.41±2.69)%,突变型组的平均血小板抑制率显著低于野生型组(t=23.011,P<0.05)。突变型组的氯吡格雷抵抗发生率为26.32%,显著高于野生型组的1.25%(P<0.05)(见表2)。
2.3 CYP2C19基因型与临床预后的关系 突变型组的预后不良发生率显著高于野生型组,卒中复发率及心脑血管不良事件总发生率也显著高于野生型组(P<0.05)(见表3)。

表1 CYP2C19突变等位基因频率及基因型频率分布

表2 不同CYP2C19基因分型患者的氯吡格雷抵抗发生率比较(n)
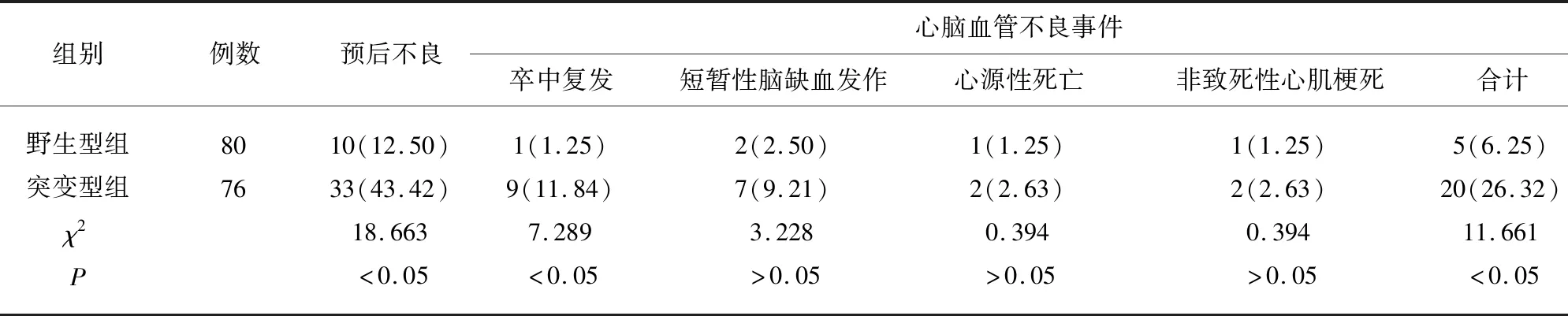
表3 不同CYP2C19基因分型患者的预后情况[n(%)]
对两组患者绘制无再发心脑血管不良事件的KM生存曲线,曲线显示两组患者随着随访时间的延长,累积无再发心脑血管不良事件的生存率均呈下降趋势;与野生型(GG)患者相比,突变型(GA+AA)患者随访期间累积无再发心脑血管不良事件的生存率明显更低(P<0.05)(见图1)。

图1 CYP2C19不同基因型患者随访期间的无再发心脑血管不良事件的生存率
3 讨 论
卒中是临床常见的脑血管疾病,其包括出血性卒中与缺血性卒中两类,且以缺血性脑卒中作为多见,约有4/5左右的卒中都为缺血性卒中[6]。缺血性脑卒中,是由各种原因引起的脑部血供障碍而导致脑组织局部缺氧、缺血、坏死,并由此引发的一组神经功能缺损临床综合征。患者可表现为单侧肢体瘫痪、语言功能障碍、偏身感觉障碍等。近年来,随着我国人口老龄化进程的加剧,急性缺血性脑卒中的临床发病率也呈现出了明显的上升趋势。
动脉粥样硬化性血栓形成是急性缺血性脑卒中的主要病因,所以采取有效的抗血小板治疗是本病实施二级预防的关键。抗血小板药物的应用能够极大地降低脑梗死的发病率、致残率,但是仍有部分患者在应用抗血小板药物后,依然达不到理想的防治效果。研究认为[7],抗血小板药物氯吡格雷药效的降低可能是急性缺血性脑卒中患者卒中再发的危险因素,而氯吡格雷药效的降低主要与药物代谢抵抗的发生有关。由于氯吡格雷是一种前体药物,其在进入人体后有85%会被直接酯化为活性产物而排出体外,仅有15%可经肝细胞中的CYP代谢为活性产物发挥药效[8]。在CYP系统中,CYP2C19参与了氯吡格雷两步代谢过程,所以CYP2C19在氯吡格雷药物代谢过程中发挥着至关重要的作用,其是氯吡格雷进行体内活化的关键因素。CYP2C19存在着多种突变等位基因,其中*2和*3是亚洲人最为常见的两个CYP2C19基因突变位点。研究已证实[9],CYP2C19*2和CYP2C19*3均是无功能等位基因,携带CYP2C19*2或*3等位基因者,均为弱代谢型,氯吡格雷在其体内的血药浓度会明显降低,血小板聚集率会明显增加,发生脑血管不良事件的风险也会相应增加。美国食品和药物管理局明确指出[10],氯吡格雷在弱代谢型(*2*3、*2*2、*3*3)患者体内的药效将无法充分发挥,临床应通过测定CYP2C19基因型来判断患者是否为弱代谢型,以指导这类患者的抗血小板治疗方案。本次研究结果显示,突变型组的平均血小板抑制率显著低于野生型组,而氯吡格雷抵抗显著高于野生型组。这与Wang等[11]的报道结论相符,说明CYP2C19基因*2、*3位点突变,造成了CYP2C19等位基因功能缺失,降低了氯吡格雷的代谢效率,氯吡格雷的抗血小板聚集作用得不到充分发挥,引起了氯吡格雷抵抗,所以突变型组的血小板聚集抑制率明显降低。
国内有报道指出[12],CYP2C19基因的多态性与卒中、冠心病患者的预后存在着显著相关性。国外有学者[13]对接受氯吡格雷治疗的千余名患者进行CYP2C19基因型检测,发现有1/3的患者都携带有CYP2C19功能缺失型等位基因,而这些患者的心血管死亡、心肌梗死、脑卒中风险要比非携带者高出50%以上,并且前者的支架内血栓形成风险超出后者2倍。郭朝群等[14]对急性缺血性脑卒中患者的CYP2C19基因型及临床预后关系进行分析后发现,CYP2C19*2和CYP2C19*3等位基因携带者在发病后3 m、6 m的预后效果明显比非携带者更差。本次研究结果也显示,突变型组的预后不良发生率、卒中复发率及心脑血管不良事件总发生率均显著高于野生型组,KM曲线显示,相比野生型患者相比,突变型患者随访期间累积无再发心脑血管不良事件的生存率明显更低。这一结果与前述几篇研究报道的结论相符,说明CYP2C19*2及*3等位基因突变与急性缺血性脑卒中患者的临床预后显著相关,其会增加急性缺血性脑卒中患者的心脑血管不良事件发生风险,导致患者预后不良。CYP2C19存在于肝脏微粒体中,由490个氨基酸残基组成,编码基因位于10p24染色体,包括9个外显子和8个内含子。在CYP2C19*2和*3基因型的外显子发生突变时,终止密码会明显提前,从而提前终止蛋白质合成,促使CYP2C19失活[15]。CYP2C19活性的丧失,会直接影响氯吡格雷的活化,从而削弱氯吡格雷对血小板聚集的抑制作用,影响脑卒中治疗效果,增加预后不良发生风险。另外,血小板的大量聚集,也会增加脑梗死再发、短暂性脑缺血发作、非致死性心肌梗死等不良心脑血管事件的发生风险,从而增加患者的死亡风险。
综上所述,急性缺血性脑卒中患者的CYP2C 19基因分型与血小板抑制率、临床预后密切相关。携带CYP2C19突变型基因型的患者,血小板抑制率更低,氯吡格雷敏感性越差,其会降低氯吡格雷疗效,增加卒中复发及其他不良心脑血管事件发生风险,从而影响患者的临床预后效果。
