颈动脉支架术后脑血流动力学的超早期改变
2019-10-17任国勇吴雪梅
任国勇,薛 盼,吴雪梅,孙 博
颈动脉狭窄是缺血性脑卒中的常见病因,20%~30% 缺血性脑卒中由颈动脉狭窄引起[1]。随着介入器械的飞速发展,颈动脉支架植入术(Carotid artery stenting,CAS)逐步取代颈动脉内膜剥脱术(carotid endarterectomy,CEA),成为治疗颈动脉狭窄的理想选择[2]。脑过度灌注综合征(cerebral hyperperfusion syndrome,CHS)是CAS术后少见但可能危及生命的并发症,其发生率为0.5%~6.8%[3,4]。Ogasawara等[5]通过对4494例患者进行回顾性分析,发现CHS多发生在CAS术后24 h内,CEA术后3~6 d。也有研究发现,在CAS术后6 h内即可发生CHS[6~8]。因此,在CAS术后超早期(6 h内)进行血流监测,对预防CHS显得更为重要。而目前对CAS术后超早期血流监测的报道很少,本研究拟应用经颅多普勒超声(Transcranial Doppler,TCD)血流监测,探讨颈动脉支架术后超早期脑血流动脉学变化。
1 对象和方法
1.1 观察对象 收集 2017年1月~2019年3月在我院接受CAS治疗的颈动脉狭窄患者85例,其中12例因颞窗透声不佳排除,剩余73例均行TCD监测。在这73例患者中男40例、女33例,年龄为45~82岁,平均(71.10±7.97)岁。其中高血压病51例(69.9%),糖尿病34例(46.6%),脑梗死48例(65.8%),短暂性脑缺血发作9例(12.3%),头晕8例(11.0%),无症状狭窄8例(11.0%)(见表1)。所有患者均符合脑血管病指南诊断标准,均经过全脑血管造影确诊,单侧颈动脉狭窄程度无症状性≥70%,症状性≥50%,诊断标准参照“北美有症状性颈动脉狭窄剥脱试验”(NASCET)标准[9]。

表1 病例特征
1.2 方法
1.2.1 所有手术均在局麻下进行,常规行股动脉穿刺,置入8F动脉鞘,按照55 U/kg肝素化,在泥鳅导丝引导下将8F引导管送至狭窄侧颈总动脉末端,路图指引下将保护伞送入颈内动脉C2段,释放保护伞;沿着保护伞导丝送入预扩球囊,准确定位后进行球囊扩张,复查造影显示狭窄部位明显改善,随后撤出球囊,沿导丝将自膨式支架送入,准确定位后释放支架;最后造影确定残余狭窄≤30%。
1.2.2 73例患者在行CAS治疗前对其高血压病、糖尿病、高脂血症等基础疾病给予药物控制。在手术前至少口服阿司匹林100 mg,1次/d;氯吡格雷75 mg,1次/d达5 d;手术后继续口服阿司匹林、氯吡格雷6 m,之后改为单用阿司匹林肠溶片或硫酸氢氯吡格雷。所有患者均服用阿托伐他汀钙片20 mg,1次/晚。均常规应用TCD行患侧大脑中动脉血流监测,并于术后1 h、6 h同一部位复查,所有检测均由同一人操作。TCD使用深圳德力凯公司生产的EMS-9EP经颅多谱脑血流分析仪,采用2.0 MHz脉冲波探头,通过颞窗探测术侧大脑中动脉(middle cerebral artery,MCA)的血流,探测深度选择50~60 mm,记录收缩期峰值流速(peak systolic velocity,PSV)、血管搏动指数(pulsation index,PI)。
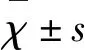
2 结 果
2.1 所有患者都成功植入颈动脉支架,颈动脉狭窄程度90%~99%者19例(26.0%),70%~89%者45例(61.6%),50%~69%者4例(12.3%)。4例患者术后24 h血压低于90/70 mmHg,给予静脉泵入多巴胺升压治疗,1例患者低血压持续达8 d。4例患者为双侧颈动脉狭窄,其中2例于术后1 m再行对侧支架术,另外2例只给予一侧支架植入术。3例患者术后出现头痛(4.11%),给予积极控制血压后症状均消失。在这3例头痛患者中,2例狭窄程度超过90%,1例狭窄程度85%。1例(1.37%)患者术后18 h出现癫痫发作(见图1),复查CT考虑高灌注脑出血,此患者为孤立大脑中动脉,术前颈内动脉狭窄超过95%,经内科治疗后留有肢体残疾。其余72例患者均未出现脑出血,无死亡病例。术后收缩压超过170 mmHg者给予乌拉地尔控制血压。术前平均收缩压为(152.47±12.85)mmHg,术后1 h平均收缩压(127.86±16.48)mmHg(P<0.01),术后6 h平均收缩压(126.75±14.31)mmHg(P<0.01)。
2.2 术后1 h术侧大脑中动脉PSV及PI变化情况 术前MCA-PSV为(70.25±19.87)cm/s,术后1 h MCA-PSV为(84.81±17.88)cm/s(P<0.001),增幅为24.95%。其中3例头痛患者术后1 h MCA-PVS平均增幅为73.7%;1例出血患者术后1 h MCA-PVS增幅达117.5%。术前MCA-PI为(0.836±0.158),术后1 h MCA-PI为(0.933±0.178)(P<0.01),平均增幅为12.14%。而对侧MCA-PSV为(87.38±21.88)cm/s,术后1 h MCA-PSV为(86.01±25.75)cm/s(P>0.05)。
2.3 术后6 h术侧大脑中动脉PVS及PI变化情况 术前MCA-PSV为(70.25±19.87)cm/s,术后6 h MCA-PVS为83.58±17.26cm/s(P<0.01),增幅为23.17%。而术后1 h MCA-PSV对比术后6 h MCA-PSV无统计学差异(P=0.06)。术前MCA-PI为(0.836±0.158),术后6 h MCA-PI为(0.921±0.164)(P<0.01),平均增幅为10.88%(见表2、图2)。而对侧大脑中动脉术前PSV为(87.38±21.88)cm/s,术后6 h MCA-PSV为(85.70±28.31) cm/s(P>0.05)。
2.4 术后1 h MCA-PVS对比术前MCA-PVS增幅变化情况 有5例患者术后1 h MCA-PVS较前降低;其余68例患者术后1 h MCA-PVS均较前升高。增幅在0%~20%有32例,21%~50%有28例,超过50%者8例。在这8例患者中,5例(62.5%)狭窄程度超90%,6例(75%)有高血压病。

表2 患者术前、术后血压值、大脑中动脉PSV及PI比较

图1 患者狭窄程度大于95%,为孤立大脑中动脉,术后1 h患侧MCA-PSV增幅达117.5%,术后18 h出现癫痫发作,复查CT考虑脑出血

图2 术后1 h、6 h患者大脑中动脉PSV较术前明显增快;而术后1 h与术后6 h大脑中动脉PSV对比无明显差异
3 讨 论
颈动脉狭窄的手术治疗主要包括CEA及CAS。颈动脉狭窄后患侧供血区长期低血流灌注导致脑血管自动调节功能紊乱,颈动脉术后脑血流量突然增多,此时脑血管自动调节能力尚未恢复,小血管不能通过收缩来调节脑灌注量,因此,颈动脉手术后可能导致CHS。Ogasawara等[5]研究发现CHS多发生在CAS术后24 h 内,CEA术后3~6 d。也有研究发现,在CAS术后6 h内即可发生CHS[6~8]。因而,术后超早期血流监测在CAS中比CEA中显得更为重要。
CHS的主要危险因素包括:狭窄程度重、侧支代偿差、严重的对侧颈内动脉病变、高血压、近期卒中等[10]。随着危险因素的增多,CHS的发生率可以升高至14.1%~56%[11~16]。如何预防CHS仍然存在争议,严格控制血压仍是目前主要的预防手段[5,17]。然而,血压过低会增加肾功能衰竭、心肌梗死及脑梗死的风险[18~20]。本组患者在治疗前已给予积极降压,术后1 h血压平均降幅为16.21%。术后1 h MCA-PSV增幅超50%的8例患者,血压平均降幅为7.63%。而5例术后1 h MCA-PSV降低的患者,血压平均降幅达35.28%。
应用TCD在颈动脉手术前、手术中、手术后评估脑血流动力学,已是一种非常成熟的技术[21]。有学者研究发现,CAS术后同侧大脑中动脉平均血流速度增加超过100%,是CHS最早、最敏感的指标[22]。本组病例术后1 h术侧MCA-PSV较术前增高达24.95%;MCA-PI增幅达12.14%。术后6 h术侧MCA-PSV较术前增幅达23.17%;MCA-PI增幅达10.88%。术后6 h MCA-PSV及MCA-PI增幅略微降低,考虑与术后1 h发现增幅偏高后给予加强药物降压有关。而术后1 h及术后6 h对侧MCA-PSV变化无统计学意义。
在3例头痛的患者中,术后1 h MCA-PSV增幅均超过50%,平均达73.7%;而1例出血的患者术后1 h PSV增幅达117.5%。而在未出现头痛及癫痫等脑高灌注表现的69例患者中术后1 hMCA-PSV平均增幅为21.5%。因此,术后1 h MCA-PSV增高超过50%时需警惕CHS的发生。
颈动脉狭窄程度为90%~99%的19例患者术后1 h MCA-PSV增幅为42.71%±32.26%,明显高于其余54例患者18.71%±15.34%(P<0.001)。本组患者中有5例术后1 h MVA-PSV较术前降低,考虑与支架刺激颈动脉窦导致术后血压明显降低有关。
4 结 论
在颈动脉支架植入术后1 h、术后6 h术侧MCA-PSV、MCA-PI就明显增高,而术后1 h与术后6 h对比无明显差异。狭窄程度>90%者术后1 h MCA-PSV增幅明显升高,可能会增加脑高灌注综合征的发生风险。
