突变型PUMA(S10A)对Hela细胞的凋亡作用及其分子机制
2014-02-15熊为国郑泽琪
熊为国,孙 洁,黄 伟,郑泽琪,3
突变型PUMA(S10A)对Hela细胞的凋亡作用及其分子机制
熊为国1,孙 洁1,黄 伟2,郑泽琪1,3
目的观察突变型PUMA和野生型PUMA对Hela细胞在促凋亡及抑制肿瘤细胞增殖方面的生物学功能差异,并探讨导致这些差异的分子机制。方法实验随机分为:空载体质粒组、野生型PUMA组、突变型PUMA 3个实验组,应用脂质体转染方法分别将空载质粒、野生型PUMA质粒、突变型PUMA质粒转染Hela细胞中,转染24、48 h后用实时定量PCR和Western blot法检测各组PUMA表达情况;野生型实验组和突变型实验组分别加入蛋白质合成抑制剂放线菌酮后,Western blot法检测PUMA蛋白的表达;MTT及流式细胞术检测野生型PUMA与突变型PUMA对细胞增殖抑制和促凋亡作用。结果在相同转染效率的情况下,通过Western blot法分析野生型PUMA组和突变型PUMA组的表达水平,结果表明突变型PUMA蛋白比野生型PUMA蛋白有一个更高的稳定状态。转染24 h后诱导表达野生型和突变型的PUMA细胞中均加入放线菌酮,结果表明,突变型PUMA蛋白降解延迟、半衰期延长;光密度值测定结果显示细胞转染两种质粒后,细胞存活率随着时间的延长逐渐下降,且转染突变型PUMA质粒在24、48 h的存活率均比野生型PUMA组低(P<0.05,P<0.01);流式细胞术结果显示,随着PUMA转染时间的增加,野生型和突变型两组肿瘤细胞的凋亡率均逐渐升高,并且突变型组细胞比野生型组细胞的凋亡率增加更加明显(P<0.05,P<0.01)。结论PUMA具有抑制Hela细胞增殖、促进其凋亡的作用,而其10号位的丝氨酸被丙氨酸取代后增加了突变型PUMA的稳定性、延长了其半衰期,导致突变型比野生型PUMA对Hela细胞的抑制作用及促凋亡功能得到加强。
p53上调凋亡调制物;定点突变;蛋白稳定性;细胞凋亡;Hela细胞
p53上调凋亡调制物(p53 up-regulated modulator of apoptosis,PUMA)蛋白属于BCL-2家族、促凋亡蛋白亚家族中的重要成员之一,最早由余健等[1-3]在直结肠癌细胞中发现,因能被p53强大快速诱导,并且能通过线粒体途径直接激活凋亡的基因,所以被称之为PUMA。由于PUMA是细胞凋亡的主要介导者,具有强大的促凋亡能力,其转录体PUMA-α编码一个全长为193个氨基酸的蛋白,近年研究[4]显示一个重要的蛋白突变点位:即蛋白10号位丝氨酸磷酸化位点。该研究主要通过MTT、流式细胞术等方法比较突变型PUMA和野生型PUMA对Hela细胞在抑制其增殖及促凋亡方面的生物学功能差异,并深入研究导致这些差异的分子机制。
1 材料与方法
1.1 材料
1.1.1 细胞与质粒 野生型和突变型pIRES2-EGFP-(HA)2-PUMA质粒由南昌大学医学院生物化学与分子生物教研室构建及赠与[5];Hela细胞由本教研室保存。
1.1.2 主要试剂 质粒提取试剂盒、LipofectaminTM2000、TRIzol试剂均购自上海Invitrogen公司;1640培养基及胎牛血清购自美国Hyclone公司;PUMA-C末端抗体购自美国CST公司;PI、Hoechst 33342染料购自美国Sigma公司;MTT、DMSO购自美国Ameresco公司;感受态细胞DH5α、逆转录试剂盒购自中国全式金公司。
1.2 方法
1.2.1 Hela细胞复苏及培养 从液氮中取出Hela细胞,37℃水浴解冻后,迅速放入含10%胎牛血清、100 U/ml青霉素、100 mg/ml链霉素的1640培养基中,放入37℃、5%CO2培养箱中培养,生长至80%以上密度时传代,转染前1 d更换无抗生素的1640培养基过夜。
1.2.2 野生型和突变型pIRES2-EGFP-(HA)2-PUMA质粒测序 将两种质粒送上海英骏生物技术公司测序并进行BLAST比对。
1.2.3 实验分组及质粒转染 ①空载体质粒组:空载质粒pIRES2-EGFP转染Hela细胞24 h或48 h实验组。②24 h野生型PUMA组:野生型pIRES2-EGFP-(HA)2-PUMA转染Hela细胞24 h实验组。③24 h突变型PUMA组:突变型pIRES2-EGFP-
(HA)2-PUMA转染Hela细胞24 h实验组。④48 h野生型PUMA组:野生型pIRES2-EGFP-(HA)2-PUMA转染Hela细胞48 h实验组。⑤48 h突变型PUMA组:突变型pIRES2-EGFP-(HA)2-PUMA转染Hela细胞48 h实验组。以上实验组按照Invitrogen公司提供的LipofectamineTM2000转染protocol操作,以脂质体(μl):DNA(μg)=3∶1比例转染Hela细胞。
1.2.4 实时定量PCR检测各组细胞PUMA的转录
总RNA的抽提采用Invitrogen公司的TRIzol Reagent,根据说明书操作,紫外分光光度仪检测总RNA浓度,A260/A280为1.79~2.00,并计算RNA含量,所提取RNA于-80℃保存备用。制备PUMA和βactin的荧光定量PCR标准曲线,采用Light Cycler RealTime PCR扩增仪进行反应,制作融解曲线,确定扩增产物的特异性。分别测定每个样品野生型PUMA、突变型PUMA、β-actin mRNA的CT值,每个样品均作复管以减少操作误差。采用相对定量方式表示各样品目的基因的ΔCT,再根据ΔΔCT计算2-ΔΔCT。ΔCT=目的基因CT-内参基因CT,ΔΔCT=目的基因ΔCT-内参基因ΔCT。扩增条件为:95℃预变性30 s;95℃变性10 s,58℃退火15 s,72℃延伸10 s,40个循环后,72℃延伸10 min。Gen-Bank中查找目的基因序列,用Primer Premier 5.0软件设计引物序列,由英骏公司合成。PUMA上游引物:5’-GCGGGGAGGAGGAACAGT-3’,下游引物:5’-TGTGGCCCCTGGG TAAGG-3’;β-actin上游引物:5’-CATGTACGTTGCTATCCAGGC-3’,下游引物:5’-CTCCTTAATGTCACGCACGAT-3’。
1.2.5 Western blot法检测细胞中突变型、野生型PUMA蛋白的表达 转染后Hela细胞置于37℃、5%CO2培养箱中孵育24、48 h,提取蛋白裂解液,测定蛋白浓度,Western blot法分别检测突变型与野生型PUMA在细胞中的表达。
1.2.6 Western blot法检测细胞中突变型、野生型PUMA蛋白的降解 将1 g放线菌酮溶解于10 ml DMSO,将其配制成100 mg/ml母液,在转染突变型、野生型PUMA质粒24 h后的Hela细胞中均加入100 mg/ml母液使其终浓度为10~20 μg/ml,继续培养,分别于0、6、12、24、48 h后使用Western blot法检测突变型、野生型PUMA蛋白的降解情况。
1.2.7 MTT比色法检测各组细胞增殖的抑制情况
转染后24、48 h,96孔培养板各组的每孔分别加入MTT溶液20 μl(终浓度0.5 mg/ml),37℃继续孵育4 h,弃尽板中的培养液,加入150 μl DMSO,振荡10 min,用酶标仪检测570 nm波长处各孔的吸光度(OD)值。同时设置不加细胞的调零孔(培养基、MTT、DMSO)。以每组6个孔(OD值-空白对照组OD值)的平均值作为各组的平均OD值。细胞生长抑制率(%)=(1-转染组OD值/细胞对照组OD值)×100%。
1.2.8 AnnexinⅤ-FITC/PI双标记法检测各组细胞凋亡 收集转染后24、48 h细胞,进行AnnexinⅤ检测。将细胞悬浮于结合缓冲液中,调整浓度为2.5 ×105/ml,与FITC标记的AnnexinⅤ混合,室温孵育10 min后,1 000 r/min离心10 min,PBS缓冲液洗涤细胞2次,缓冲液重悬细胞,PI染色,上机测试分析。
1.3 统计学处理采用SPSS 11.5统计软件分析,数据以±s表示,多组间差异比较用单因素方差分析,各组组间比较用LSD法。
2 结果
2.1 野生型、突变型pIRES2-EGFP-(HA)2-PUMA质粒测序结果野生型pIRES2-EGFP-(HA)2-PUMA质粒测序后在线比对,结果显示PUMA全基因序列碱基完全正确,而突变型pIRES2-EGFP-(HA)2-PUMA质粒测序结果显示:第28~30位碱基由TCC突变为GCC,其他碱基均无突变,见图1。

图1 野生型和突变型PUMA质粒的测序结果比较
2.2 实时定量PCR检测突变型PUMA质粒与野
生型PUMA质粒的转染、转录效率结果显示:突变型PUMA与野生型PUMA转染24 h后,实时定量PCR检测野生型PUMA 24 h过表达量相对于空载体质粒ΔΔCT为-9.999,而突变型PUMA24 h过表达量相对于空载体质粒ΔΔCT为-9.869;野生型PUMA 48 h过表达量相对于空载体质粒ΔΔCT为-13.880,而突变型PUMA 48 h过表达量相对于空载体质粒ΔΔCT为-15.082。实验表明突变型PUMA质粒与野生型PUMA质粒转染、转录效率一致。见表1。PCR检测显示在相同转染率的情况下,突变型PUMA质粒与野生型PUMA质粒的转录效率相同,因此,PUMA质粒并没因为该基因的第28号碱基发生突变其转录效率发生改变,提示突变型PUMA蛋白表达升高可能是因为突变型PUMA蛋白稳定性较野生型PUMA蛋白的稳定性高,见图2。

表1 各实验组CT值

图2 突变型与野生型PUMA质粒的实时定量PCR结果
2.3 Western blot法检测突变型与野生型PUMA蛋白表达情况突变型PUMA质粒转染Hela细胞24 h后表达较野生型PUMA质粒组表达量升高(P<0.05),48 h后更明显(P<0.05)。之前,PCR检测发现在相同转染率的情况下,突变型PUMA质粒与野生型PUMA质粒的转录效率相同,因此,PUMA质粒并没因为该基因的第28号碱基发生突变其转录效率发生改变,这表明突变型PUMA蛋白表达升高可能是因为突变型PUMA蛋白稳定性较野生型PUMA蛋白的稳定性高,见图3。

图3 Western blot法检测突变型与野生型PUMA蛋白表达情况
2.4 Western blot检测突变型与野生型PUMA蛋白降解情况突变型PUMA蛋白较野生型PUMA蛋白降解速度延迟,见图4,表明突变型PUMA蛋白比野生型PUMA蛋白稳定性更强。由于改变了PUMA蛋白的磷酸化位点,导致PUMA蛋白的磷酸化程度下降进而导致PUMA蛋白的降解速率减慢,而这种降解的减慢很有可能是由于蛋白泛素化程度降低所致。

图4 突变型与野生型PUMA蛋白降解情况
2.5 MTT检测Hela细胞存活率结果显示:细胞
转染两种质粒后,细胞存活率随着时间的延长逐渐下降,且转染突变型PUMA质粒在24、48 h的存活率均比野生型PUMA质粒组低,见表2、图5,表明突变型PUMA蛋白由于其稳定性较野生型PUMA更强导致其抑制细胞增殖作用明显增加。
表2 突变型PUMA与野生型PUMA对Hela细胞OD值的影响(n=5,±s)

表2 突变型PUMA与野生型PUMA对Hela细胞OD值的影响(n=5,±s)
与空载体质粒组比较:*P<0.05;与野生型PUMA组比较:#P<0.05
组别24 h48 h空载体质粒0.763±0.0260.951±0.033野生型PUMA0.481±0.072*0.493±0.069*突变型PUMA0.395±0.065*#0.341±0.062*#
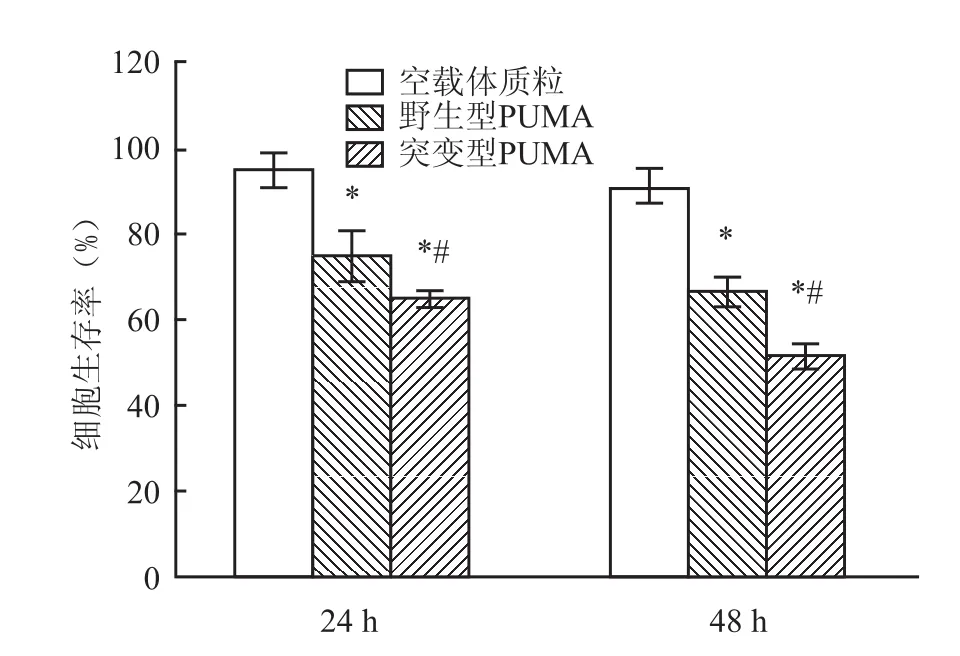
图5 突变型与野生型PUMA抑制Hela细胞增殖柱状图
2.6 流式细胞术检测PUMA过表达诱导Hela细胞凋亡转染野生型24 h组凋亡率为(16.8± 2.1)%和突变型24 h组凋亡率为(21.5±2.7)%,高于转染空载体质粒组的(9.7±1.9)%,差异有统计学意义(P<0.05);而转染野生型48 h组凋亡率为(26.7±2.0)%和突变型48 h组凋亡率为(32.5 ±1.9)%,高于转染空载体质粒组的(12.5± 0.8)%,差异有统计学意义(P<0.05)。提示突变型PUMA的促凋亡能力较野生型强,见图6。
3 讨论
本研究在突变型PUMA质粒与野生型PUMA质粒的转录效率基本一致情况下,通过MTT实验显示:Hela细胞转染两种质粒后,细胞存活率随着时间的延长逐渐下降,且转染突变型PUMA质粒在24、48 h的存活率均比野生型PUMA质粒组低,这表明了突变型PUMA蛋白由于其稳定性较野生型PUMA更强导致其抑制细胞增殖作用明显增加。流式细胞术结果显示,随着PUMA转染时间的增加,野生型和突变型两组肿瘤细胞的凋亡率均逐渐升高,并且突变型组细胞比野生型组细胞的凋亡率增加更加明显,表明突变型PUMA对Hela细胞促凋亡作用强于野生型PUMA。通过Western blot实验显示:突变型PUMA蛋白比野生型PUMA蛋白有一个更高的稳定状态,而突变型PUMA蛋白比野生型PUMA蛋白半衰期更长。

图6 流式细胞术检测各组Hela细胞凋亡结果
较早之前,PUMA研究多集中在转录水平的调控,主要通过一些如p53和非p53转录因子(如p73、E2F1和FOXO3a)上调其表达水平[6]。这些因素包括:基因毒性应激、癌基因应激、血清饥饿/细胞因子/生长因子撤离应激、内质网应激、缺血/再灌注等。而近年发现该蛋白存在翻译后调节即蛋白磷酸化调节。Fricker et al[4]研究发现PUMA磷酸化位点位于10、96、106位的丝氨酸,其中10号位点的丝氨酸是主要的磷酸化位点。当PUMA的10号位点的丝氨酸被磷酸化后可以促进其降解,其促凋亡作用减弱。
随着对突变型PUMA研究的不断深入,进一步研究PUMA在蛋白酶降解过程中的机制,如PUMA翻译后调节是否存在磷酸化修饰及泛素化修饰双调控?进一步阐明PUMA翻译后磷酸化修饰调控机制,试图寻找调节PUMA蛋白磷酸化相应的细胞信号转导,便可以使用相应的磷酸激酶抑制剂增强肿瘤细胞凋亡,
为肿瘤治疗找到一个新的治疗靶点。最后,也将对PUMA其他的磷酸化位点进行深入研究。
[1] Yu J,Zhang L,H Wang P M,et al.PUMA induces the rapid apoptosis of colorectal cancer cells[J].Mol Cell,2001,7(3):673-82.
[2] Nakano K,Vousden K H.PUMA,a novel proapoptotic gene,is induced by p53[J].Mol Cell,2001,7(3):683-94.
[3] Han J,Flemington C,Houghton A B,et al.Expression of Bbc3, a pro-apoptotic BH3-only gene,is regulated by diverse cell death and suvival signals[J].Proc Natl Acad Sci U S A,2001,98(20):11318-23.
[4] Fricker M,Prey O J,Tolkovsky A M,et al.Phosphorylation of puma modulates its apoptotic function by regulating protein stability[J].Cell Death Dis,2010,1:e59.
[5] 黄 伟,万福生.突变型PUMA质粒的构建及表达[J].安徽医科大学学报,2013,48(4):341-5.
[6] Yu J,Zhang L.PUMA,a potent killer with or without p53[J].Oncogene,2008,27 suppl1:S71-83.
Mutant type PUMA can accelerate the apoptosis of Hela cells in vitro and its molecular mechanism
Xiong Weiguo1,Sun Jie1,Huang Wei2,et al
(1Dept of Cardiology,The First Affiliated Hospital of Nanchang University,Nanchang 330006;
2Clinical Laboratory,Children′s Hospital in Jiangxi Province,Nanchang 330006)
ObjectivTo investigate the differences of wild type PUMA protein mutant PUMA protein in apoptosis and proliferation inhibition function and to explore the molecular mechanism of these differences,which may pave the way for further study on tumor suppressor function of PUMA and its post-translational regulation on mechanism.MethodsHela cells were divided into 3 groups:wild type PUMA transfection group,mutant PUMA transfection group,and the empty vector control group.After transfection 24 h and 48 h the expression of PUMA was detected by Western blot and qPCR.The cellular proliferation inhibition was examined by MTT.The cellular apoptosis rates were examined by FCM.Wild type group and mutant group after joining protein synthesis inhibitors cycloheximide,degradation of PUMA protein were detected by Western blot,respectively.ResultsWe analyzed the expression levels of wild type PUMA and mutant PUMA by Western blot.This revealed that mutant PUMA was expressed at a higher steady state level than wild type PUMA in the same under the condition of transfection efficiency.Cells expressing wild type PUMA and mutant PUMA were treated with cycloheximide,and we then tested wild type PUMA and mutant PUMA protein degradation.This assay revealed that degradation of mutant PUMA protein delayed degradation and prolonged the half life.After mutant PUMA and WT plasmids cell transfection,the OD value results displayed certain degree proliferation inhibitory effect in a time-dependent manner Hela cells,and transfected with mutant PUMA was significantly lower than that after being transfected with WT at the 24 h and 48 h time point.There was significant difference(P<0.05,P<0.01).FCM results showed that with the increase of transfection time,wild type and mutant of two groups of tumor cell apoptosis rate increased,and the mutant type group cell apoptosis rate increased more obviously,the difference was statistically significant(P<0.05,P<0.01).ConclusionPUMA can inhibit Hela cells proliferation and promote its apoptosis.10 of serine was replaced by alanine can increase the stability of mutant PUMA,prolong its half-life,which results in inhibition and pro-apoptotic function strengthened in the mutant than wild type PUMA on Hela cells.
p53 up-regulated modulator of apoptosis;site-directed mutagenesis;protein stability;apoptosis;Hela cells
R 737.33;R 329.2;R 394.2
A
1000-1492(2014)11-1553-05
2014-08-11 接收
2012年江西省教育厅课题(编号:CJJ12101)
南昌大学第一附属医院1心血管内科、3高血压病研究所,南昌 330006
2江西省儿童医院检验科,南昌 330006
熊为国,男,主治医师,硕士研究生;
郑泽琪,女,教授,主任医师,硕士生导师,责任作者,E-mail:zeqizheng@126.com
