非小细胞肺癌患者全胸腔镜肺叶切除术血管中断顺序对预后的影响
2019-10-15秦天洁吴齐飞
焦 敏,郭 卉,孙 红,秦天洁,吴齐飞
(西安交通大学第一附属医院1肿瘤内科,2胸外科,西安 710061)
肺癌是临床上最常见的一种恶性肿瘤,该疾病的发病率和死亡率均排在恶性肿瘤的第一位,在不同的病理分型中,非小细胞肺癌(NSCLC)是肺癌中最常见的类型,占肺癌发病率的85%以上[1]。手术切除是非小细胞肺癌的主要治疗方法,目前标准的外科手术治疗方法是肺叶切除加局部淋巴结清扫。主要的手术治疗手段包括:传统开胸肺叶切除术和胸腔镜下肺叶切除术。其中肺叶切除术需要中断主要结构,包括肺动脉分支、肺静脉和支气管。自20世纪40年代首次进行个体肺门解剖以来,这种肺叶切除术的基本技术一直没有改变。长期以来,在非小细胞肺癌切除术中,部分外科医生在结扎肺动脉前先结扎肺静脉,因为在手术过程中肿瘤细胞可能会通过肺静脉发生扩散[2]。然而,如果首先进行肺静脉的中断可能会增加术中出血的风险[3]。基于以上问题,本研究通过回顾性病例资料分析2016年1月-2018年6月期间在西交通大学第一附属医院接全胸腔镜肺叶切除术治疗非小细胞肺癌的180例患者,对其临床病理、手术和术后数据进行了比较,旨在探讨全胸腔镜肺叶切除术血管中断顺序对非小细胞肺癌复发的影响。
1 资料和方法
1.1 临床资料通过医院管理系统调取2016年1月-2018年6月在西安交通大学第一附属医院手术患者资料。病例选择标准:(1)非小细胞肺癌I期、II期或IIIA期的病理学确认;(2)完全治愈性切除术;(3)全胸腔镜肺叶切除术;(4)无术前治疗;(5)无微观残留肿瘤。排除标准:(1)微创腺癌患者(即为≤3 cm的鳞状上皮肿瘤,入侵≤5 mm);(2)传统开胸肺叶切除患者;(3)病理分期IIIB期患者。所有患者均行胸部和腹部术前对比强化计算机断层扫描(CT),脑造影增强磁共振成像(MRI)或CT,全身或骨扫描的正电子发射断层扫描(PET)评估非小细胞肺癌的阶段。合并症为慢性阻塞性肺病、间质性肺病、缺血性心脏病和慢性心力衰竭,由医生根据病史和体检结果进行术前诊断,包括超声检查、肺功能检查、放射成像和冠状动脉造影。所有无症状的术后患者每6个月进行1次常规评估,随访包括体格检查、胸部X线检查、血液检查,包括确定肿瘤标志物水平、胸部和腹部CT以及脑部MRI。使用成像或活组织检查程序评估疾病复发。本研究已通过医院伦理委员会的审查,并签署知情同意书。
1.2 方法术中均使用本院同型号胸腔镜设备。在气管插管全身麻醉后,健侧单肺通气,取健侧90°卧位。使用3端口技术进行全胸腔镜肺叶切除术。在同侧腋中线的第7肋间创建1个1.5 cm的观察口,在同侧前腋线的第4肋间隙创建3 cm工作端口,并且在同侧腋后线的第7肋间隙创建2 cm的辅助端口。所有患者在肺叶切除术后进行纵隔淋巴结清扫术。在中断肺动脉之前完全中断肺静脉的患者为“肺静脉组”。在完全中断肺静脉之前肺动脉分支部分中断的患者为“肺动脉组”。通过评估患者术中出血的风险以及肺淤血的可能性,手术医生将分别用两种血管中断顺序对患者进行全胸腔镜肺叶切除手术。
1.3 观察指标包括手术时间、术中出血量、术后辅助化疗、疾病复发、局部复发、远处转移、死亡、总生存期(OS)、5年内总生存率(%)、无病生存期(DFS)及无病生存率(%)。其中总生存期(OS)指从手术日期到任何原因的死亡日期;5年内总生存率(%)=5年内生存总人数/手术总人数,通过比较肺静脉组与肺动脉组患者术后5年内总生存率评价术中血管中断顺序对于患者术后生存率的影响。无病生存期(DFS)指从外科手术之日到疾病复发之日。无病生存率(%)=术后未复发患者数/手术总人数。
1.4 统计学分析所有数据均使用SPSS 18.0 统计学软件进行分析。其中比较分类变量使用χ2检验,并使用t检验比较正态分布后的连续变量。Kaplan-Meier方法用于估计DFS和OS时间函数的概率,采用双尾对数秩检验比较患者亚组之间的差异。采用Cox比例风险模型进行单变量和多变量分析,根据血管中断顺序比较DFS。在多变量分析中使用了单变量分析显著的风险因素。P<0.05表示差异具有统计学意义。
2 结果
2.1 两组患者一般资料对比结果共有180例患者接受了全胸腔镜肺叶切除手术。其中7例患者因术前治疗(3例)、微创腺癌(3例)和病理分期IIIB(1例)被排除在外,共173例患者被纳入本研究。其中,89例患者分为肺静脉组,84例患者分为肺动脉组,其临床病理特征见表1。除了切除的肺叶外,两组患者在临床病理学方面差异无统计学意义。
2.2 两组患者手术及预后结果对比肺静脉组术中出血量平均为(101.9±98.6)mL,而肺动脉组为(125.6±83.8)mL,两组术中出血量无统计学差异(P>0.05)。肺静脉组中有7例、肺动脉组中有15例患者出现复发。其中,肺静脉组中的2例患者和肺动脉组中的10例患者发生远处转移,而肺静脉组中的5例患者和肺动脉组中的5例患者发生局部复发。结果见表2和表3。
2.3 两组患者术后5年内生存率的比较173例非小细胞肺癌患者中,肺静脉组的5年生存率为90.0%,而肺动脉组的5年生存率为82.7%。肺静脉组的总生存时间比肺动脉组的总生存时间长(见图1A)。
2.4 两组患者术后的无病生存率比较173例非小细胞肺癌患者中,肺静脉组的无病生存率为88.2%,肺动脉组为75.7%。整个肺静脉组的无病生存时间明显长于肺动脉组(P=0.019)(图1)。对于接受全胸腔镜肺叶切除术的158例I期患者,肺静脉组的无病生存期明显长于肺动脉组(P=0.047),15例接受全胸腔镜肺叶切除术的Ⅱ-ⅢA期患者中,两组的无病生存期无统计学差异(见图1B)。
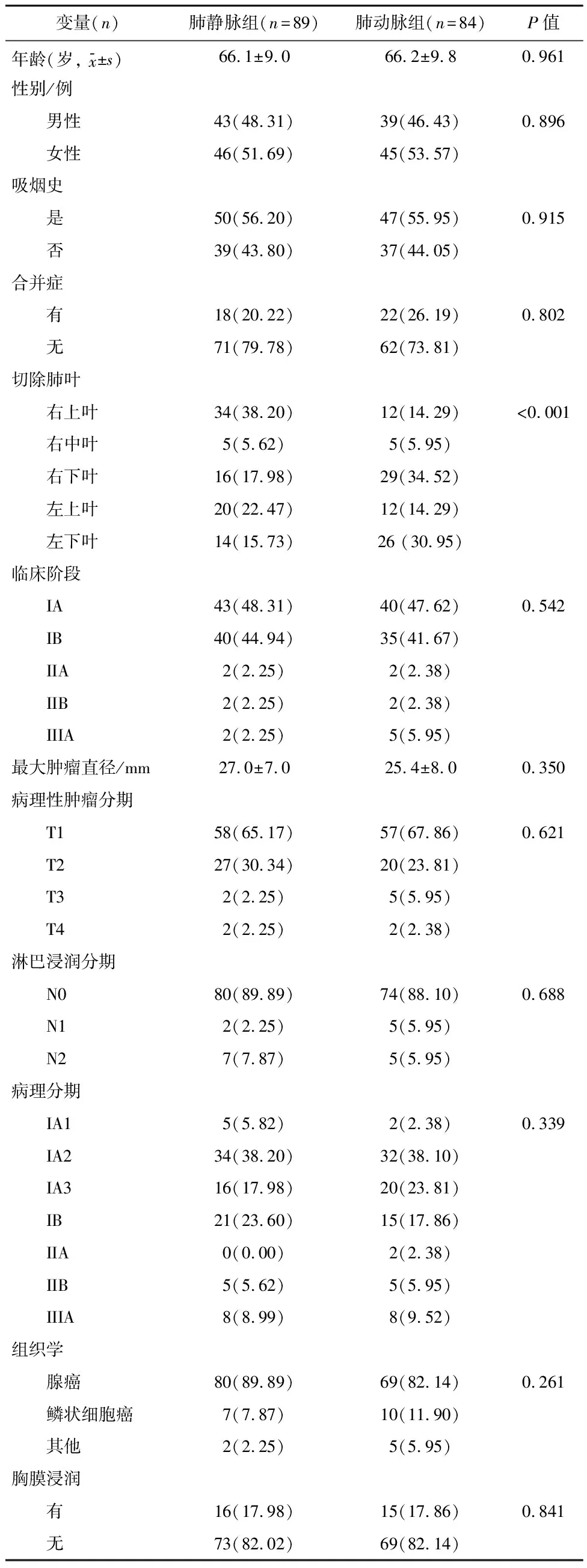
表1 两组患者一般资料比较
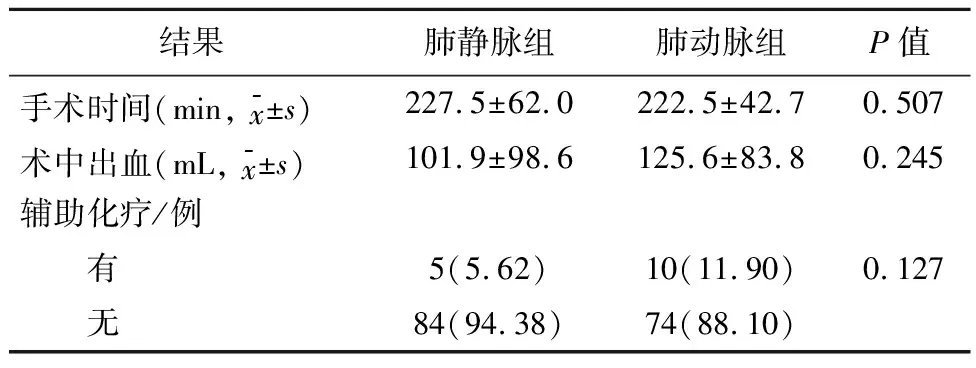
表2 两组手术及术后相关指标比较
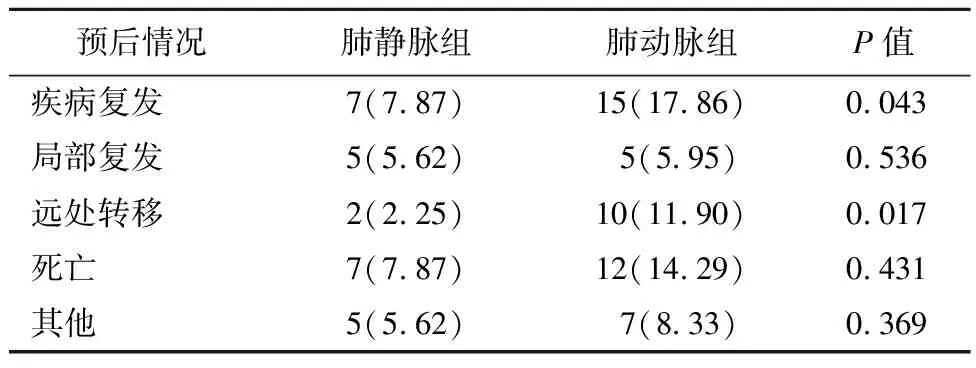
表3 两组预后相关指标比较(n/%)
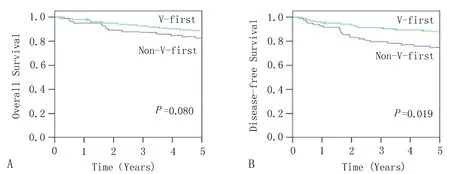
图1 两组患者的总生存期和无病生存期比较
2.5 多变量分析预测全胸腔镜肺叶切除术的非小细胞肺癌患者的无病生存期对173例接受全胸腔镜肺叶切除术的非小细胞肺癌患者进行单因素分析,确定了无病生存期的3个重要危险因素:病理分期、组织学和血管中断顺序。多变量分析结果表明,其中2个变量是无病生存期的重要预测因子,即血管中顺序和病理分期,见表4。
3 讨论
肺癌是癌症相关死亡的最常见原因,手术切除一直是非小细胞肺癌治疗的主要手段[4]。许多外科医生认为手术的操作可能会促使肿瘤细胞脱落到血液中,并导致其转移。在肺叶切除手术后,肺静脉中的循环肿瘤细胞将增加[5]。Lohr等[6]通过比较肺叶切除术前、中、后的外周血中癌胚抗原mRNA的水平发现,肺叶切除术期间的血管中断顺序能够影响循环肿瘤细胞。同样,Song等[7]报道肿瘤特异性基因(CK19和CD44v6)的表达在先进行动脉中断的手术中显著增加,但在先进行静脉中断的手术中没有显著增加。Cho等[8]研究认为可能由肺癌手术期间的手术操作引起的远处转移的发生。然而,在肺叶切除术血管中断顺序是如何影响非小细胞肺癌患者的临床结局尚不清楚。Refaely等[9]报道先肺静脉组与先肺动脉组患者的疾病复发和生存无显著差异。而本研究结果显示,全胸腔镜肺叶切除术中血管中断顺序对疾病复发有影响,特别是对于早期疾病患者。本研究通过回顾性分析发现非小细胞肺癌的肺叶切除术中血管中断顺序对肿瘤患者术后的相关影响。虽然本研究表明肺静脉组的总生存时间与无病生存时间明显更长,但由于研究中的患者病例数较少,以及最近化疗和分子靶向治疗的改善,都可能导致本次研究结果的偏倚。
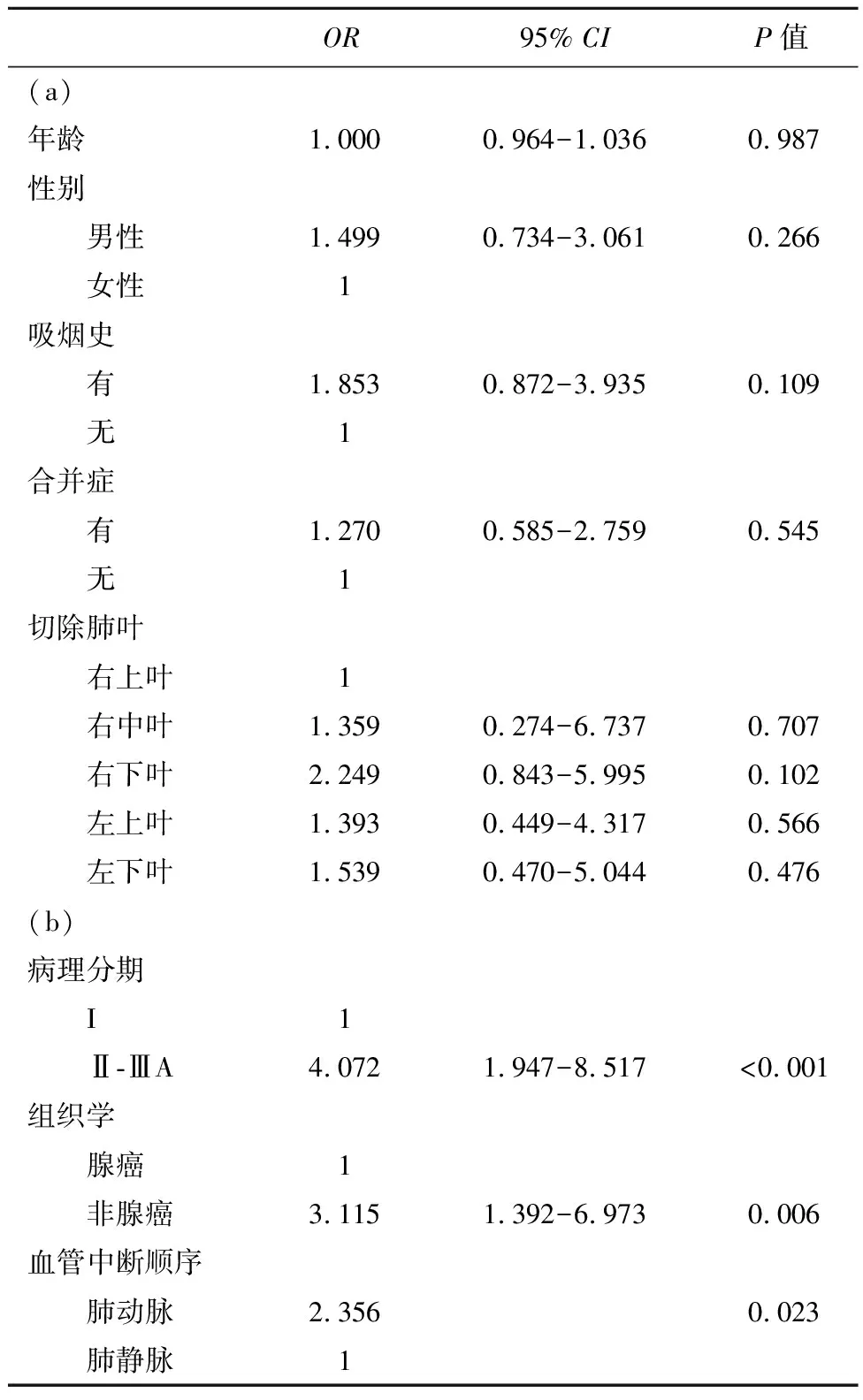
表4 无病生存的单变量分析(a)和无病生存的多变量分析(b)
Toufektzian等[10]报道手术操作后引流肺静脉血液中循环肿瘤细胞计数显著增加。另外,Sawabata等[11]研究发现手术后肺静脉血液中存在聚集的循环肿瘤细胞,上述研究结果可在一定程度上解释为何肺静脉组的无病生存时间明显长于肺动脉组[12]。然而,根据血管中断顺序,Ⅱ-ⅢA期的非小细胞肺癌患者的无病生存时间无显著差异[13]。如果先行肺静脉中断可以阻止肿瘤细胞从肺癌组织中脱落,从而降低远处转移的风险[14]。血管中断顺序对晚期非小细胞肺癌患者的疾病复发影响较小,因为这些患者的复发可能是通过淋巴结转移[15]。
有研究报道先行肺动脉中断可以减少胸腔镜肺叶切除术中早期非小细胞肺癌患者的失血量[16]。但本研究发现肺静脉组和肺动脉组的术中失血量无统计学差异,此结果与Yellin等[17]的报道一致。
本研究表明首先中断肺静脉可能与接受胸腔镜肺叶切除术治疗非小细胞肺癌患者的无病生存期的改善有关。但由于本研究是回顾性分析,且研究时间较短,病例数少,结果可能不具有代表性。今后需要进一步收集病例,进行大规模的前瞻性随机研究,以证实本研究结果。
