LncRNA-SNHG17通过调控miR-23b-3p促进非小细胞肺癌进展
2019-10-15哈依努尔戴月梅木叶沙尔皮达义迪丽努尔吾甫尔
哈依努尔,戴月梅,木叶沙尔·皮达义,迪丽努尔·吾甫尔,陈 林
(1中南大学湘雅医院卫生部肿瘤蛋白组学重点实验室,长沙 410008; 2新疆医科大学第一附属医院呼吸与呼吸危重症中心一病区,乌鲁木齐 830054)
近几十年来,肺癌的发病率和死亡率都明显增高,是世界范围内的主要人口死亡原因。非小细胞肺癌(NSCLC)约占所有肺癌的85%,是最常见的肺癌类型[1]。虽然近些年在肺癌诊断方法、手术技术、新的化疗方案等方面取得了很大的进展,但NSCLC患者的5年生存率仍然较低[2-3]。因此,研究NSCLC发展过程中肿瘤发生的分子机制,寻找新的有效治疗靶点,对于提高患者生存率至关重要。长链非编码RNA (long noncoding RNAs,lncRNAs)是一类新发现的长度超过200个核苷酸的非蛋白编码转录本,其参与细胞发育、凋亡、分化以及免疫应答[4-5]等多种生理病理过程。越来越多的证据表明,LncRNA的失调在各种类型的癌症的发生和进展中起着关键作用[6-8]。对于非小细胞肺癌(non-small cell lung cancer,NSCLC),许多LncRNA已被证实参与了NSCLC的发生和发展,并可作为NSCLC诊断或治疗靶点[9-10]。SNHG17(小核仁RNA宿主基因17)已被证实在胃癌、结直肠癌的发生、发展和转移方面发挥重要作用[11-13]。然而,目前尚不清楚SNHG17在人类非小细胞肺癌中是否存在异常表达,或与功能调控有关。微小RNA (miRNA) 是一类长度约为22 个核苷酸的非编码单链RNA分子,研究证实,miRNA与肺癌等多种肿瘤的发生发展密切相关[14-16],而LncRNAs可以作为一种内源竞争RNA (ceRNA)作用于特定的miRNAs,导致相应的miRNA靶向转录。本研究发现SNHG17在非小细胞肺癌细胞系中具有高表达,SNHG17与miR-23b-3p关系密切,LncRNA-SNHG17可能是miR-23b-3p的内源竞争RNA,通过调控miR-23b-3p促进非小细胞肺癌进展,现将结果报道如下。
1 材料与方法
1.1 细胞系NSCLC细胞株(H358、A549、SK-MES-1、H1299)和正常人支气管上皮细胞16HBE均购自ATCC(American Type Culture Collection)。细胞培养于RPMI-1640培养基(Thermo Fisher scientific,MA,USA),含10%胎牛血清(Thermo Fisher scientific,MA,USA),37℃,5% CO2湿化空气。
1.2 细胞转染pLCDH-ciR-SNHG17质粒和SNHG17-SiRNA序列分别由上海吉玛公司构建与合成。用Lipofectamin 2000脂质体转染试剂盒转染pLCDH-ciR-SNHG17质粒或siRNA到细胞中,分别设阴性对照组。设计的siRNA序列如下:siRNA-NC:(5′-UUGUAAUACACCAAAGUACUG-3′),SNHG17-siRNA:(5′-GGUGGACCAUGGUGUUCUATT-3′)。
1.3 qRT-PCR实验使用TRIzol试剂盒(Thermo Fisher scientific,MA,USA)从细胞中提取RNA。采用EX TaqTMII试剂盒(TaKaRa,Shiga,Japan)进行SNHG17水平检测。内部对照为GAPDH和U6。引物序列如下:SNHG17-F:TGCTTGTAAGGCAGGGTCTC; SNHG17-R: ACAGCCACTGA-AAGCATGTG; GAPDH-F: GCTCTCTGCTCCT-CCTGTTC; GAPDH-R:ACGACCAAATCCGTTGACTC.MiR-23b-3p-F:ACACTCCAGCTGGGAT-CACATTGCCAGGGAT; miR-23b-3p-R: CTCA-ACTGGTGTCGTGGAGTCGGCAATTCAGTTG-AGGTGGTAAT; U6-F: CTCGCTTCGGCAGC-ACA; U6-R: AACGCTTCACGAATTTGCGT。
1.4 CCK-8实验采用CCK-8法检测细胞增殖。转染后将5×103个肺癌细胞株A549接种到96孔板中。分别于24、48、72 h用CCK-8试剂(Beyotime,Shanghai,China)在暗箱中孵育2 h,最后用Benchmark PlusTM微板光谱仪(Bio-RadLaboratories Inc)测定各孔在450 nm处的吸光度。
1.5 流式细胞术收集转染后的A549细胞,用70%冷乙醇4℃固定。固定后的细胞用PBS洗2次,并用10 μg/mL RNase A 和20 μg/mL PI(Sigma-Aldrich) 37℃下孵育30 min。细胞周期分布采用流式细胞分析仪分析(BeckmanBiosciences,USA)。采用MODFIT LT软件(BD Biosciences)分析G0/G1期、S期和G2/M期细胞的百分率。
1.6 Transwell实验在无血清培养基中,约2×104个A549细胞被接种到无涂层或涂有基质凝胶的小室上层,底层加入750 μL培养液。培养24 h后取出上层细胞,用4%多聚甲醛固定下层细胞,0.1%结晶紫染色。用光学显微镜对迁移和侵袭细胞数进行计数。

2 结果
2.1 SNHG17在NSCLC细胞系中表达上调包括H358、SK-MES-1、H1299、A549在内的非小细胞肺癌细胞系SNHG17表达水平明显高于正常人类非小细胞肺癌上皮细胞系16HBE(图1)。A549细胞株表达的SNHG17最高。
2.2 SNHG17的沉默抑制非小细胞肺癌细胞增殖和迁移通过转染siRNA,SNHG17在A549细胞中沉默(与siRNA-NC比较,P<0.01,图2a)。然后进行细胞计数(CCK8实验),发现沉默SNHG17显著降低了A549细胞的增殖能力(图2b)。流式细胞术结果表明,SNHG17基因敲除后,A549细胞中G1期细胞比例增加,S期细胞和G2M期细胞比例下降(P<0.05,图2c、2d)。采用Transwell法测定SNHG17基因敲除后的细胞迁移能力,结果表明,SNHG17siRNA显著减少了细胞的迁移(图2e、图2f)。这些结果提示SNHG17调控非小细胞肺癌细胞的增殖和迁移。
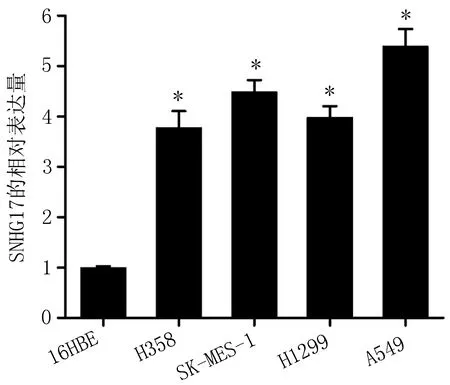
图1 SNHG17在非小细胞肺癌中的表达
注: 与正常支气管上皮细胞16HBE比较,*P<0.01。
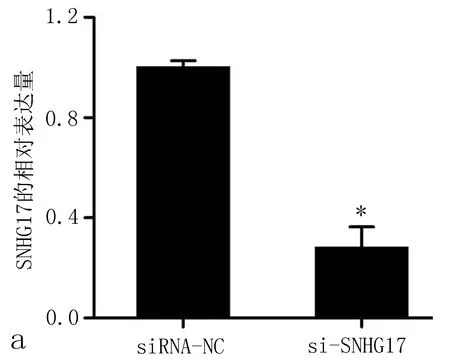
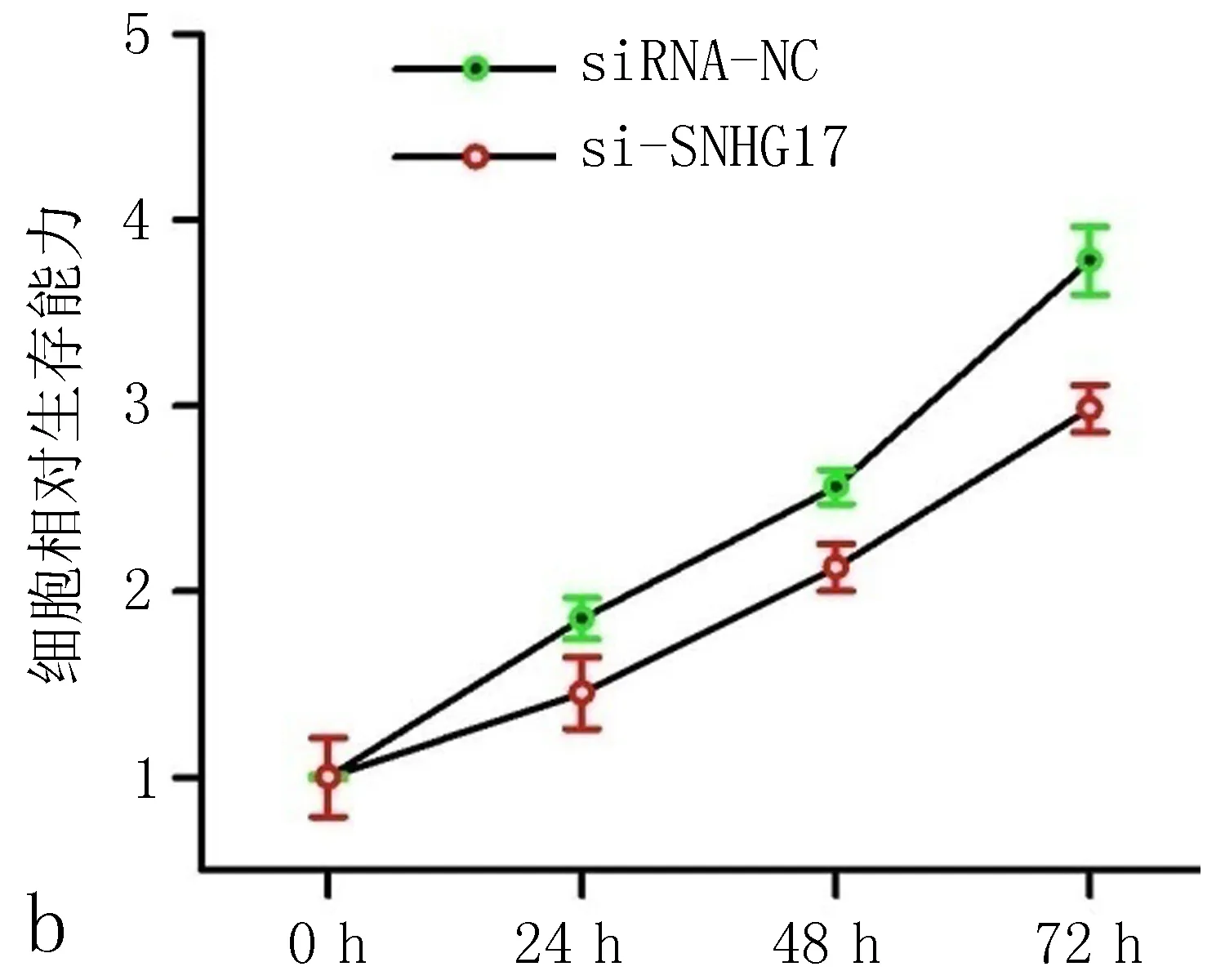

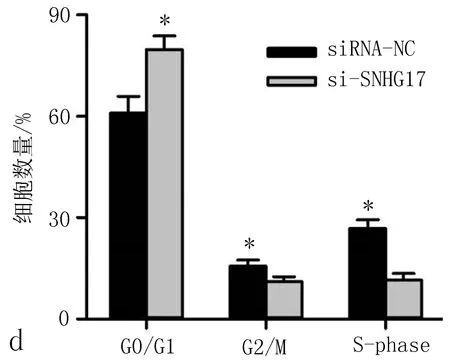


图2 SNHG17沉默抑制非小细胞肺癌细胞增殖和迁移
a: qRT-PCR结果显示,转染SNHF17干扰RNA后,A549细胞株SNHG17表达下调; b: CCK8实验表明,转染不同时间,SNHG17可不同程度抑制非小细胞肺癌细胞增殖; c、d: 转染si-SNHG17 48 h后用流式细胞术检测A549细胞周期; e、f: Transwell实验表明,SNHG17沉默抑制非小细胞肺癌细胞迁移能力。注:与siRNA-NC比较,*P<0.05。
2.3 SNHG17的上调促进非小细胞肺癌细胞增殖和迁移为进一步验证SNHG17在非小细胞肺癌中的作用,我们通过将pLCDH-SNHG17质粒转染至A549细胞中过表达SNHG17(与pLCDH比较,P<0.01,图3a)。CCK8实验和流式细胞术细胞周期实验均显示,SNHG17过表达促进了A549细胞的生长(图3b~3d)。此外,Transwell检测表明,pLCDH-SNHG17的转染促进了A549细胞的迁移(P<0.01 vs.pLCDH,图3e、3f)。这些数据进一步证明了SNHG17在非小细胞肺癌中的致癌作用。
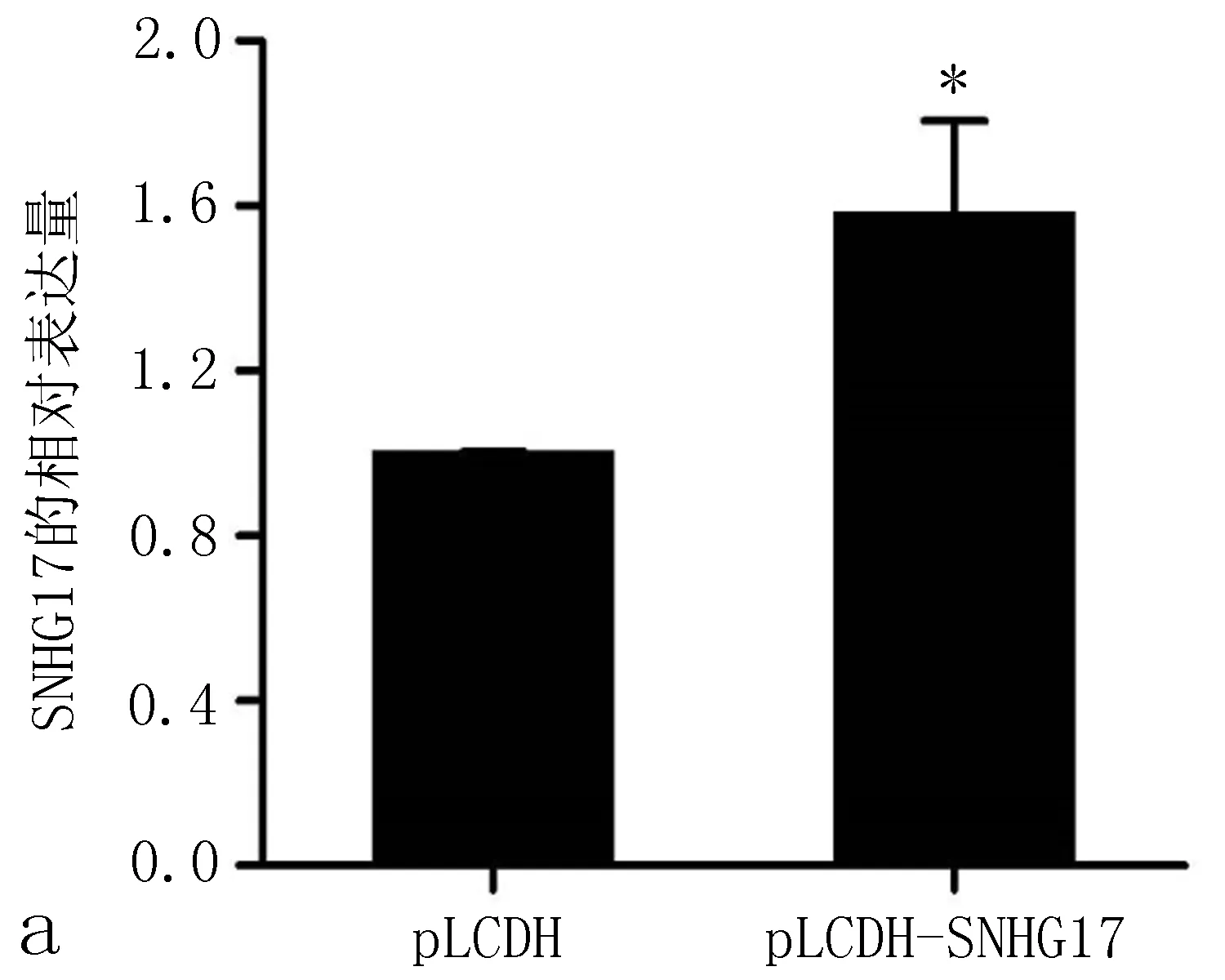

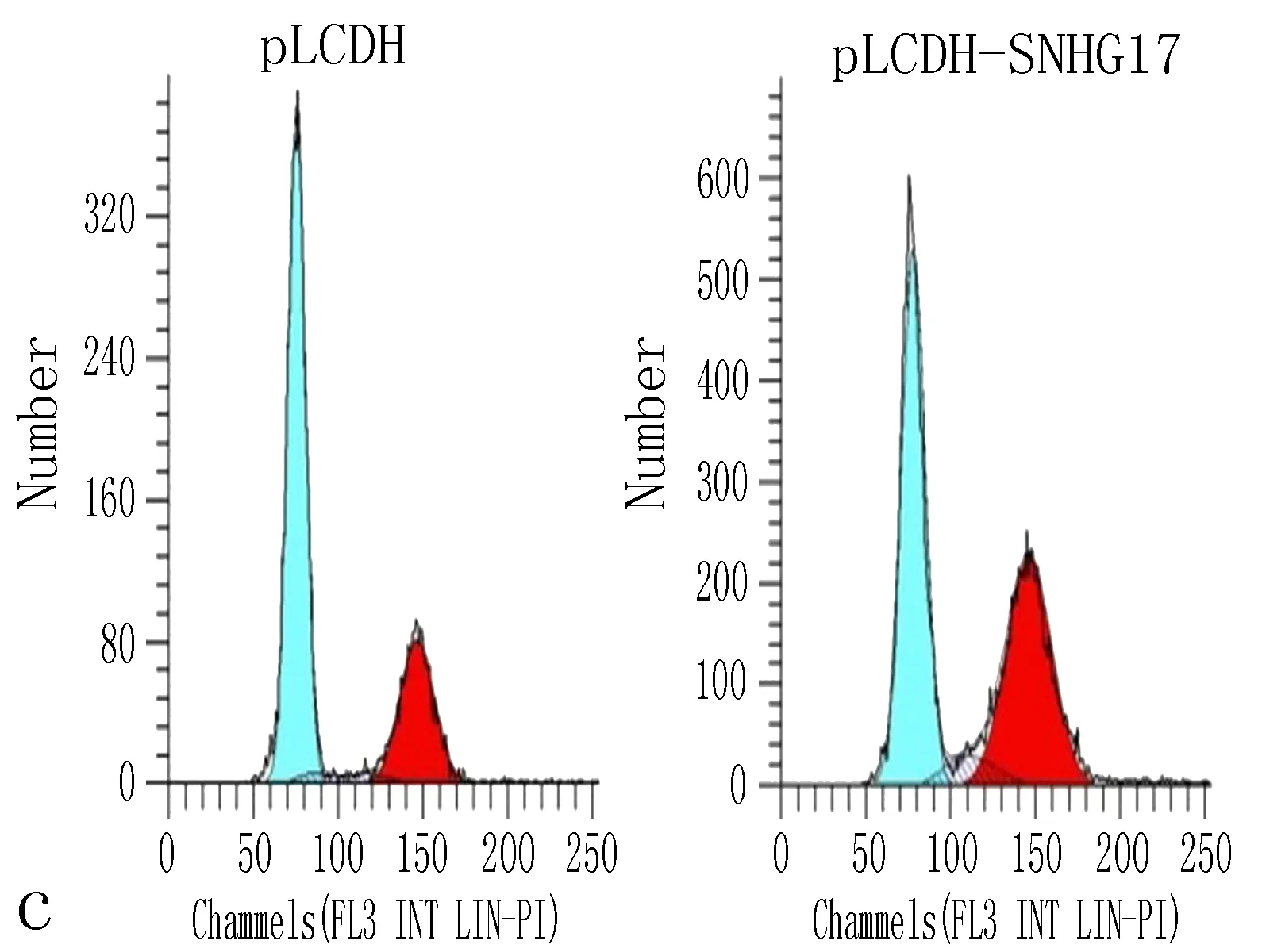

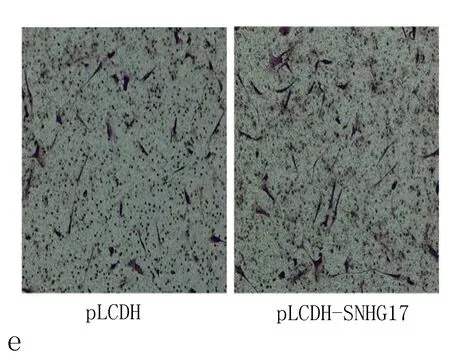
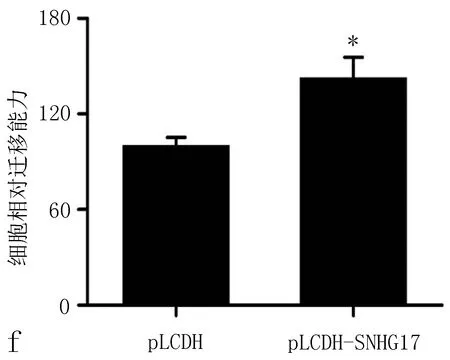
图3 SNHG17上调促进非小细胞肺癌细胞增殖和迁移
a: qRT-PCR结果显示,转染pcDNA-SNHG17质粒后,SNHG17表达水平升高; b: CCK8实验表明,SNHG17过表达促进非小细胞肺癌细胞增殖; c、d: 用流式细胞术检测转染SNHG17质粒的A549细胞的细胞周期; e、f: Transwell实验表明,SNHG17转染增强非小细胞肺癌细胞迁移侵袭能力,注: 与pLCDH比较,*P<0.05。
2.4 SNHG17可能是miR-23b-3p的内源竞争RNA使用软件Starbase v2.0预测与SNHG17相互作用的miRNA,发现miR-23b-3p可以与SNHG17中的互补序列结合(图4a)。我们用qRT-PCR分析发现,包括H358、SK-MES-1、H1299、A549在内的非小细胞肺癌细胞系,miR-23b-3p水平明显低于正常人支气管上皮细胞系16HBE(图4b),沉默SNHG17导致A549细胞中miR-23b-3p表达水平升高(图4c),在A549细胞中过表达miR-23b-3p抑制了SNHG17的表达(图4d),说明SNHG17与miR-23b-3p关系密切。
3 讨论
以往的研究发现,人类基因组序列约98%被转录成非编码RNAs(lncRNAs),其中长度为>200 nt的长非辅酶核糖核酸(lncRNAs)越来越受到关注[7-8]。越来越多的证据表明,lncRNAs在多种癌症的发病机制中起主要作用[7-8,17]。小核仁RNA宿主基因(SNHG)在非小细胞肺癌中表达上调。相关研究报道,SNHG1通过抑制miR-101-3p和激活Wnt/β-catenin 信号通路促进非小细胞肺癌进展;SNHG7通过调节FAIM2表达来抑制肺癌细胞凋亡[17-18]。许多研究发现,沉默SNHG16可以抑制多种肿瘤瘤体的生长[19-20]。SNHG17也是SNHG的重要成员之一,但其在非小细胞肺癌中的表达和作用尚不清楚。


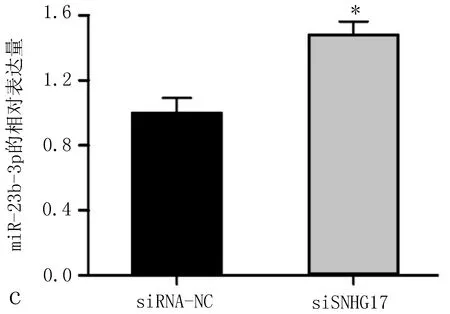
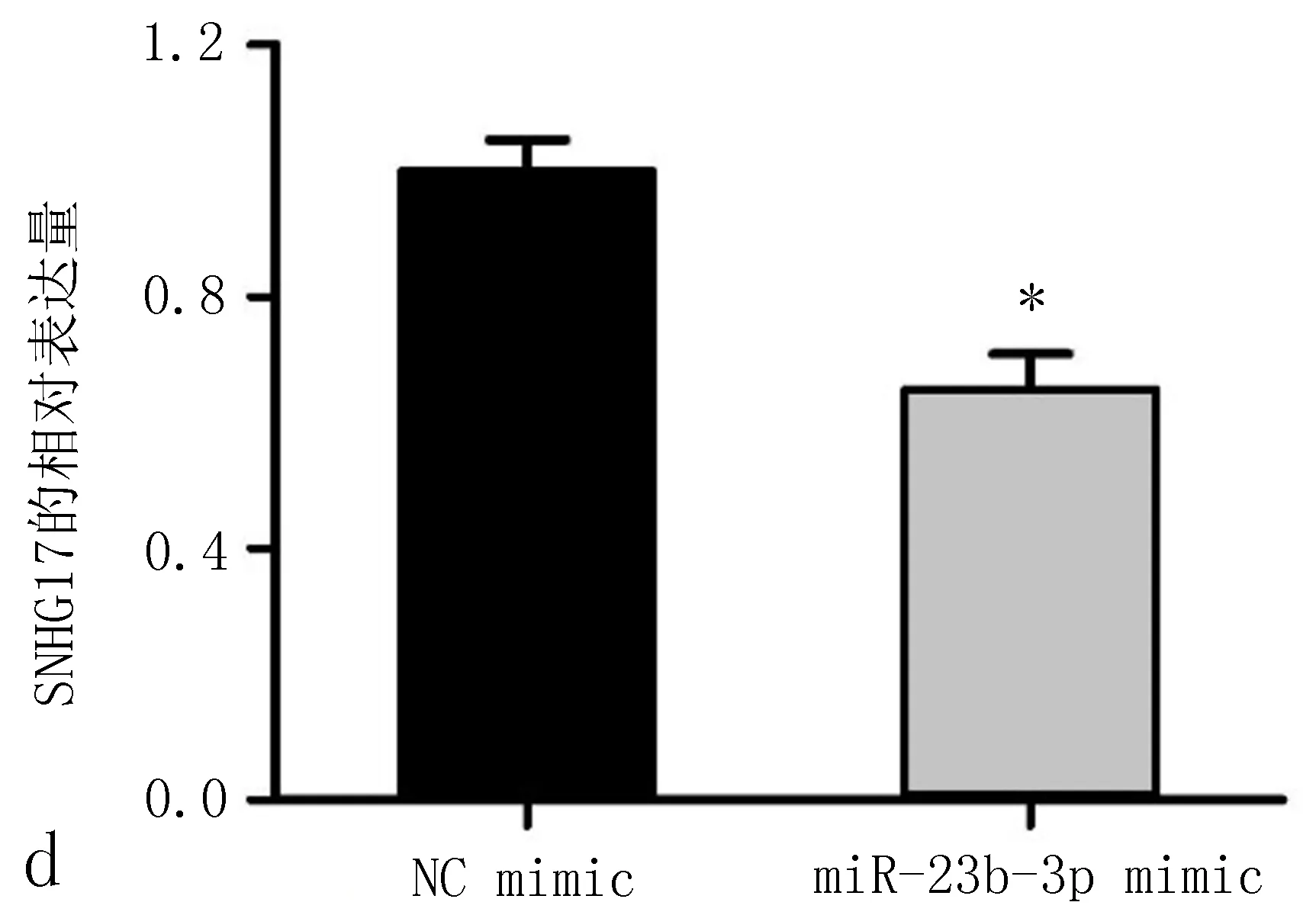
图4 SNHG17可能是miR-23b-3p的竞争内源性RNA
a: 用软件Starbase v2.0预测SNHG17与 miR-23b-3p相互作用位点; b: qRT-PCR结果显示,miR-23b-3p在非小细胞肺癌细胞系中表达水平低于正常人支气管上皮细胞系16HBE,注: 与16HBE细胞系比较,*P<0.05; c: qRT-PCR结果显示,沉默SNHG17可使A549 细胞miR-23b-3p表达水平比siRNA-NC组增高,注: 与siRNA-NC组比较,*P<0.05; d: qRT-PCR结果显示,在A549细胞中过表达miR-23b-3p,SNHG17表达水平低于对照组,注: 与NC mimic组比较,*P<0.05。
本研究结果显示,SNHG17在非小细胞肺癌细胞系中高表达,提示SNHG17可能是一种预后生物标志物。此外,我们还通过CCK8、Transwell等一系列实验证实了SNHG17对A549细胞的恶性行为具有促进作用。研究结果揭示了SNHG17是NSCLC的致癌因子。然而,SNHG17是否调控NSCLC尚需深入研究。
lncRNA-miRNA-mRNA调控方式已得到普遍认可。lncRNA可作为microRNA的ceRNA促进信使RNA的表达[21]。因此,我们对SNHG17中能够结合互补序列的miRNA进行了分析。miR-23b-3p在3′-UTR上具有互补的结合位点,有报道称miR-23b-3p通过调节长链非编码RNA MALAT1调控胃癌[22],在肾癌中抑制PTEN基因表达[23],通过ATG12和HMGB2调控胃癌细胞的耐药性[24]。另一项研究通过整合microRNA表达谱和基因组分析发现miR -23b-3p在非小细胞肺癌组织中下调[25]。但miR-23b-3p在非小细胞肺癌中的生物学作用尚不清楚。我们还发现SNHG17抑制 miR-23b-3p的表达,在非小细胞肺癌中可能是miR-23b-3p的内源竞争RNA(ceRNA)。
综上所述,lncRNA-SNHG17通过竞争性结合miR-23b-3p促进NSCLC的发生。通过我们的研究,对SNHG17在非小细胞肺癌中的作用有了更好的了解,对以后研究lncRNA相关的NSCLC诊断及治疗有了促进作用。
