起源于三尖瓣环顶部的特发性室性期前收缩心电图特点和导管消融治疗
2019-10-14龙德勇蒋晨曦桑才华汤日波喻荣辉李松南刘相飞杜昕董建增马长生
王 龙德勇 蒋晨曦 桑才华 汤日波 喻荣辉 李松南 刘相飞 杜昕董建增 马长生
近年来,室性心律失常——尤其是起源于一些特殊部位的室性期前收缩(premature ventricular contracts,PVC)和室性心动过速(ventricular tachycardia,VT)越来越受到临床重视[1]。其中,右心室三尖瓣环(tricuspid annulus,TA)区域因其解剖结构和临近希氏束等结构特性,受到越来越多的关注[2]。既往研究发现这一部位起源的室性心律失常具有一定特征[3]。本研究旨在通过对TA区域起源的PVC患者进行分析,进一步探索此类心律失常的电生理学特征以及提高手术成功率的方式。
1 对象与方法
1.1 研究对象
纳入2016年1月至2016年12月首都医科大学附属北京安贞医院263例室性心律失常患者。纳入标准:(1)诊断符合特发性室性心律失常;(2)经胸超声心动图提示无室壁运动异常等器质性心脏病阳性结果;(3)血清学、影像学检查不存在其他可能引起心律失常的疾病,且无其他可能导致不宜手术的严重合并症;(4)若经胸超声心动图提示左心室舒张末期内径>50 mm,常规行心脏核磁共振成像进一步排除器质性心脏病。排除标准:(1)患有肥厚型心肌病、扩张型心肌病、致心律失常性右心室心肌病或冠状动脉粥样硬化性心脏病等器质性病变;(2)合并其他可引起心律失常的疾病,包括但不限于甲状腺功能亢进、多发性骨髓瘤、电解质平衡紊乱等;(3)合并严重疾病不能耐受手术,或术中电生理检查无法诱发心律失常。共220例患者成功诱发并完成激动标测和导管消融。术后确认有8例患者室性心律失常起源于TA顶部,设为样本组(TA组),有16例患者室性心律失常起源于临近的右心室流出道(right ventricular outflow tract,RVOT)前壁,设为对照组(RVOT组)。所有患者术前停用抗心律失常药物至少5个半衰期。
1.2 研究方法
所有患者术前行常规检查。连接12导联心电监护,观察心律失常发作情况,在心律失常发作稳定状态下开始手术。其中3例患者PVC数较少,给予异丙肾上腺素(1 mg/500 ml生理盐水,20滴/min,下同)静脉滴注,至心率提高50%(>120 次/分)时PVC增多,并以异丙肾上腺素洗脱期最为明显,重复性良好。记录PVC状态下和窦性心律时QRS波形态、宽度,V1导联R波和S波的比值(R/S),Ⅱ、Ⅲ、aVF导联R波振幅,aVR导联S波振幅,aVL导联形态,胸前导联R波移行位置以及V5、V6导联R波高度等,两组间进行对比分析。
1.3 激动标测和导管消融
所有患者在心律失常稳定发作下采用“热点追踪”法进行激动标测。标测采用Thermocool Smart Touch导管(美国强生公司),每个点的压力控制在5~15 g,避免贴靠不佳或过度压迫心肌导致心肌形变,影响位置的真实性。双极电位设置滤波参数为30~400 Hz,单极电位设置滤波参数为0.5~500 Hz。同时标记希氏束位置,重点记录H电位最高的部位。标测完成后,若激动最早点电位理想,则于激动最早点处尝试消融。消融前观察靶点处电位特点,如有无H电位等。采用温控模式,盐水灌注保持低流速(2 ml/min),消融参数为55 ℃、35 W,若出现交界性心律,则降低功率,同步观察心电图形态和房室传导情况。
1.4 消融终点
消融时间达到45 s以上,原发PVC消失,静息重复术前的诱发条件,如静脉滴注异丙肾上腺素观察15 min,无PVC出现则视为消融成功。若出现快速房室交界性心律、房室传导时间延长(P-R间期延长)或QRS波(V波)脱落,应立刻终止放电,调整位置或消融参数后再次尝试消融。若反复尝试均发现房室传导阻滞或有发生其他严重并发症的风险,或始终消融无效,且临近部位如RVOT、左心室、心大静脉等同样未能标测到有效消融靶点,则视为手术失败,需终止手术。
1.5 随访
术后即刻和次日描记标准12导联体表心电图。术后随访6个月,并于1、3、6个月时复查24 h动态心电图,记录复发及用药情况。
1.6 统计学分析
所有数据采用SPSS 23.0统计学软件进行分析。正态分布计量资料以(±s)表示,组间比较采用t检验;非正态分布计量资料以中位数(最小值,最大值)表示,组间比较采用秩和检验;计数资料以例(比)表示,组间比较采用χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 所有患者基线资料比较
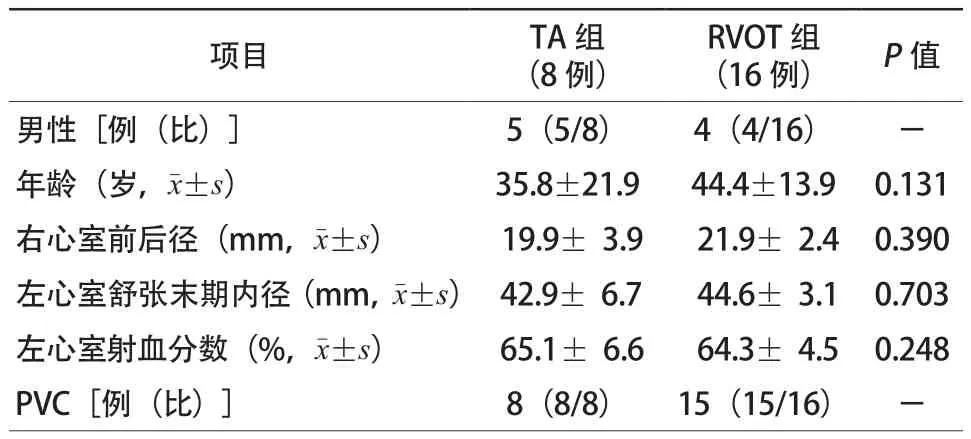
表1 两组患者基线资料比较
2.2 心电图分析
24例患者体表心电图均呈左束支传导阻滞(left bundle branch block,LBBB)样图形,与既往报道右心室起源的室性心律失常心电图特点一致[4]。TA组8例PVC患者QRS波时程为160(114,196)ms,RVOT组16例患者QRS波时程为143(114,202)ms,两组比较差异无统计学意义(P=0.189)。TA组8例(8/8)患者QRS波均可见到较为明显的切迹(notching),尤以下壁导联和V4~V6导联显著,而在RVOT组,仅不到半数可见到较明显的切迹(7/16)。TA组Ⅰ导联均呈高大“M”型,无qs波,与窦性心律时比较,Ⅰ导联的R波振幅在PVC发作时更高[(0.93±0.17)mV比
两组患者共24例,均有不同程度的症状性PVC或VT,TA组8例患者均为PVC患者,而RVOT组包含15例PVC患者和1例VT患者,术前曾口服2~4种包括β阻滞药在内的抗心律失常药物效果不佳。两组患者性别、年龄、右心室前后径、左心室舒张末期内径、左心室射血分数(left ventricular ejection fraction,LVEF)以及PVC比例比较,差异均无统计学意义(均P>0.05,表1)。两组患者中共有3例左心室舒张末期内径达到50 mm,但LVEF值均在正常范围,经进一步心脏核磁共振成像,未发现其他器质性心脏病。(0.75±0.12)mV,P=0.003]。而在RVOT组,Ⅰ导联形态多变,可呈R、Rs、qR、QS型,但无论何种形态,其R波振幅均低于窦性心律时。TA组下壁导联(Ⅱ、Ⅲ、aVF导联)主波方向与窦性心律时基本保持一致。Ⅱ导联基本以R波为主;Ⅲ导联呈R、Rs、rS型,R波为主者有6例(6/8);aVF导联呈R或rS型。下壁导联R波振幅与窦性心律时比较,差异均无统计学意义(均P>0.05);而RVOT组下壁导联R波振幅均明显高于窦性心律时(均P<0.001);TA组下壁导联R波振幅均显著低于RVOT组,差异均有统计学意义(均P<0.01)。两组患者aVR导联均呈QS型,TA组振幅与窦性心律时比较,差异无统计学意义[(1.02±0.21)mV比(1.14±0.27)mV,P=0.933],但RVOT组振幅较窦性心律时负向更深[(1.32±0.17)mV比(1.19±0.18)mV,P=0.014]。TA组aVL导联以R波为主,而RVOT组则均为QS型,未见到r波。TA组胸前导联V1均以QS型为主,甚至极少见到r波;V2导联则以rS型为主(图1),其R波与S波振幅比值(R/S)显著低于窦性心律时[(0.06±0.05)比(0.23±0.11),P=0.004]。TA组胸前导联移行多在V3~V4导联,而窦性心律时和RVOT组移行多在V3之前。与窦性心律时相比,TA组V5~V6导联R波振幅在PVC发作时更为高大[(1.4±0.5)mV比(1.0±0.3)mV,P=0.007;(1.2±0.3)mV比(0.9±0.2)mV,P=0.007]。RVOT组V1导联R/S亦小于窦性心律时[(0.09±0.01)比(0.14±0.03),P=0.024],但其形态可见r波,呈rS型。胸前导联移行多在V3导联,领先于TA组。同时,无论相较于TA组还是窦性心律时,RVOT组的V5、V6导联均具有更为高大的R波[5]。两组患者窦性心律与心律失常下体表心电图主波振幅比值的比较详见表2。
2.3 激动标测和导管消融
表2 两组患者窦性心律与心律失常下体表心电图主波振幅比值比较(RSN/RVT)(±s)

表2 两组患者窦性心律与心律失常下体表心电图主波振幅比值比较(RSN/RVT)(±s)
注:TA,三尖瓣环;RVOT,右心室流出道;RSN,窦性心律下QRS波振幅;RVT,心律失常时QRS波振幅
导联 TA组(8例) RVOT组(16例) P值Ⅰ1.2±0.4 2.3±0.7 0.003Ⅱ1.2±0.9 0.6±0.1 0.016Ⅲ1.0±0.5 0.4±0.2 0.001 aVF 1.0±0.6 0.5±0.2 0.003 aVR 0.9±0.3 0.9±0.1 0.333 V5 1.4±0.5 1.0±0.3 0.009 V6 1.2±0.3 0.9±0.2 0.007
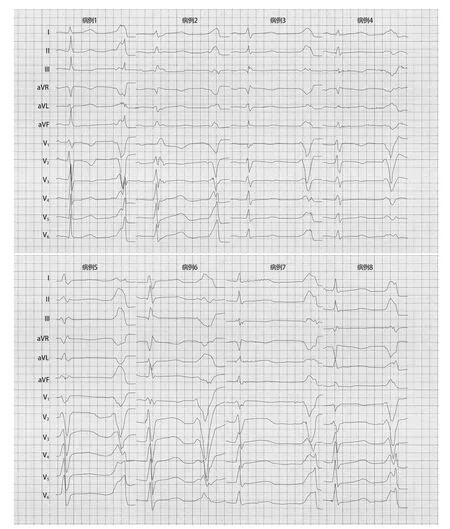
图1 TA组8例患者心律失常发作时,心电图均呈左束支传导阻滞样图形,病例2、4 V1 呈 QS型,其余V1呈rS型
TA组8例患者激动标测最早点均位于右心室TA 11点~1点方向,距离H电位最大希氏束位置21.5(9.7,36.0)mm。TA组和RVOT组的有效消融靶点局部电位分别提前最早QRS波时限32.5(26,45)ms和35(22,56)ms。多数患者消融靶点处PVC时可以记录到反转电位(TA组8/8例,RVOT组13/16例),且多见局部双极电位以负向起始(图2)。24例患者中,23例PVC患者均在术中成功终止发作,另1例VT患者消融成功后反复刺激不能诱发。TA组8例患者有效消融靶点均未记录到H电位,提示距离希氏束有一定距离。激动标测和导管消融过程中,消融导管直接由心房指向TA贴靠时,头端压力常不稳定。本中心采用反“C”形,意将导管跨过三尖瓣一段距离,再向心房侧打弯,使导管头端指向心房方向贴靠于TA,此时贴靠压力和稳定性都更为理想(图3)[6]。
2.4 术后随访
所有患者随访6个月,在未使用抗心律失常药物下未见原发室性心律失常发作,RVOT组1例患者复查可见与原发PVC患者心电图形态不同的PVC,但数量极少(<1000次/24 h),且无明显症状。
3 讨论
3.1 基线特征
最终纳入研究的患者中,3例患者心室增大未发现器质性病变,考虑与原发性PVC有关,已有室性早搏性心肌病的潜在风险[7]。临床上,心室扩大也提示必须对心律失常加以干预,以阻止心肌病变进一步进展,甚至出现LVEF下降,成为室性早搏性心肌病[8]。TA组8例患者中有5例男性(5/8),RVOT组中有4例男性(4/16),鉴于总样本量并不大,这一差异是否有统计学意义还未可知[9]。
3.2 解剖特点
右心室TA瓣下区域有着类似“反折”形态的特殊解剖结构。游离壁侧TA瓣下的心室壁向心房侧走行后,再折回心室方向,形成游离壁侧瓣下“反折”结构,其内的心室肌在空间上位于TA的心房侧,因而电极在该部位可记录到较大的心房电位。而到了TA顶部,并无明显的“反折”结构,但由于瓣叶阻隔,导管直接贴靠瓣下区域仍有困难(图4)。

图2 TA组患者心电图和有效消融靶点处局部电位,可见窦性心律时位于末端的电位成分在PVC发作时出现于起始处(细箭头),且通常可见起始方向为负向(粗箭头)
3.3 心电图
起源于TA顶部的PVC患者体表心电图具有共同特征:Ⅰ导联呈“M”型的R波,其他肢体导联与窦性心律下方向和振幅均相近,这可能是由于TA顶部在空间上仍较为接近希氏束的缘故。但在胸前导联,PVC发作下与窦性心律时差异较大,具体表现在V1导联R/S值较低,R波移行较晚(V3~V4导联),V4、V5导联R波更为高大,这是由于PVC发作时心肌电位起源点更偏向游离壁侧,这也导致下壁和胸前导联常可见到明显切迹。
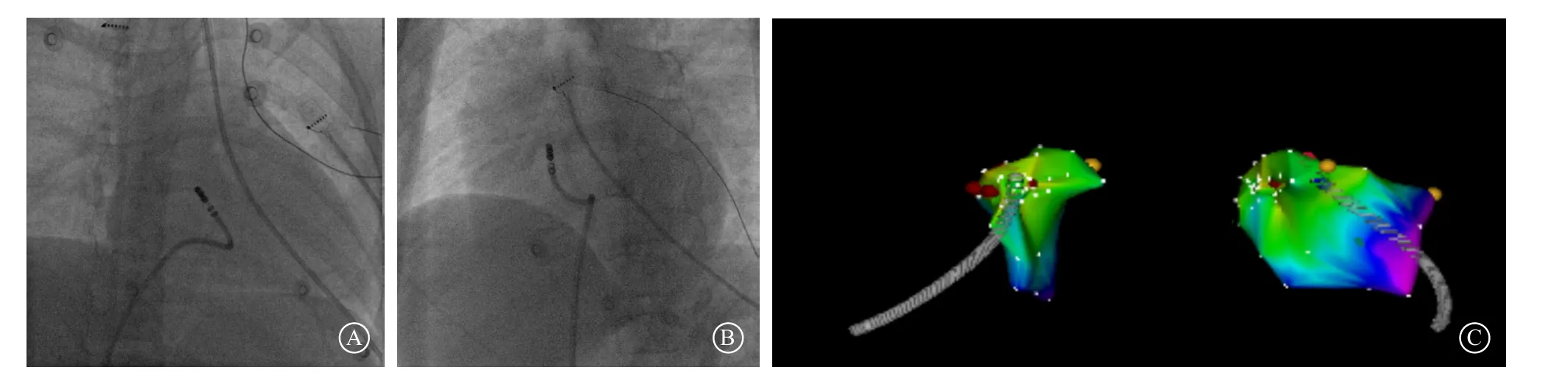
图3 胸部X线和三维标测系统下的导管贴靠 A.右前斜位30°导管贴靠于三尖瓣环顶部形态呈反“C”形;B.左前斜位45°导管贴靠于三尖瓣环顶部形态呈反“C”形;C.三维标测系统下建立的三尖瓣环解剖模型,导管头端反向折回贴靠于瓣环顶部
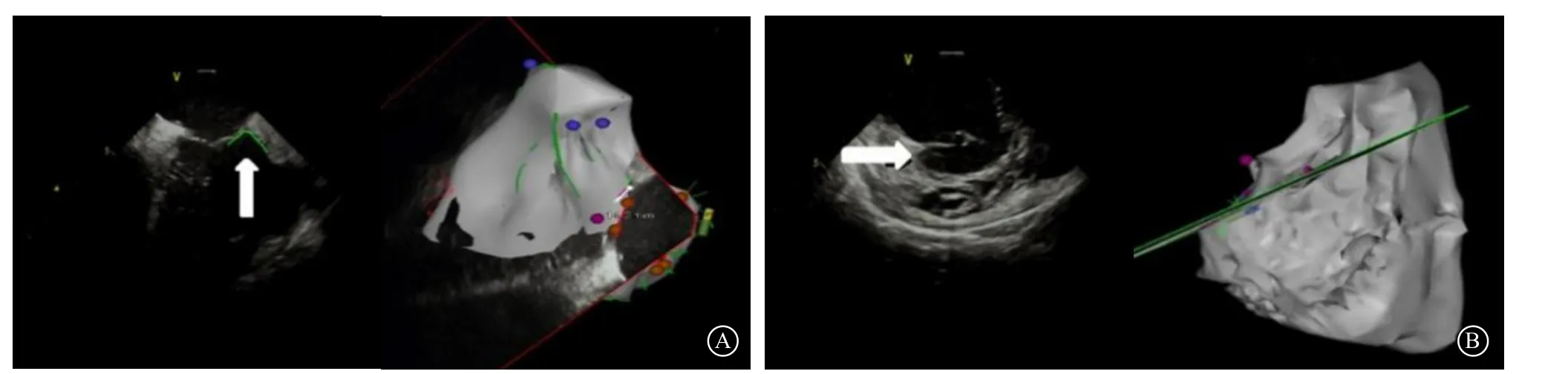
图4 心腔内超声下的三尖瓣结构 A.可见三尖瓣环顶部(箭头处),若导管直接由心房侧贴靠,则三尖瓣环前叶恰好阻隔于导管和心室壁之间;B.三尖瓣环游离壁侧瓣下可见明显的“反折”结构(箭头处),其内心室腔已位于心房水平
3.4 激动标测与导管消融
忽略特殊解剖结构的前提下,TA区域室性心律失常标测并无太大难点。常规方法都能标记到最早起源部位。只是在瓣下区域进一步精细标测确定靶点时,需采用特殊的到位方式。本研究推荐反“C”形弯型,即前文所述的贴靠方式。需要注意的是,尝试导管做出这一弯型的时候,要注意头端压力和操作手感。由于右心室前后径较小,且心内膜面有乳头肌、调节束、腱索等结构,可供操作的空间并不大,极易勾挂导管。切忌暴力操作,损伤腱索等结构,导致瓣膜功能受损[10]。
本研究同时发现,TA顶部区域的PVC靶点通常距离希氏束较远,常规消融功率不易伤及希氏束主干。但仍需注意的是,机械压迫导致右束支传导阻滞在实际临床实践中并不罕见。这时解除压迫,多数情况下右束支传导都可以自行恢复。
起源于TA顶部区域的PVC具有特殊体表心电图和电生理学特征。对于抗心律失常药物无效的患者,可以考虑导管消融治疗。本研究患者数虽较少,但消融治疗均取得了满意的结果。因此本中心认为基于目前经验,导管消融可以成功终止心律失常发作[11]。同时,了解局部解剖结构的特殊性,采用特别的反“C”形导管到位方式,有可能帮助实现精确标测和消融。本研究为单中心研究,且由于疾病本身的发病率不高,导致最终入选的患者数有所限制,故在基线特征方面有一定影响。
