腹腔镜下联合腹腔干切除胰体尾癌根治术1例报告并文献复习
2019-10-12侍力刚陈丹磊刘安安邵成浩
汤 靓,侍力刚,陈丹磊,刘安安,邵成浩
(上海长征医院,上海,200001)
胰腺癌是一种恶性程度高、诊疗较困难的消化道恶性肿瘤,其中20%~30%发生于胰体尾部,手术切除是患者长期生存的唯一治疗方式。胰体尾癌容易侵犯腹腔动脉干及其属支,导致手术切除率低,患者预后较差。联合腹腔干切除的胰体尾癌切除术(distal pancreatectomy with celiac axis resection,DP-CAR)为这类患者带来更高的手术切除率,也为提高患者生活质量、延长生存时间提供了可能。上海长征医院胰胆外科收治1例胰体癌侵犯腹腔动脉干的患者,成功施行腹腔镜下联合腹腔干切除的胰体尾癌切除术(laparoscopic distal pancreatectomy with celiac axis resection,LDP-CAR)。笔者将结合此病例并进行文献复习,探讨LDP-CAR治疗胰体尾癌的安全性、有效性。
1 资料与方法
1.1 临床资料 患者男,68岁,主诉为中上腹隐痛1月余。查体无特殊。腹部CT检查示胰体占位性病变,考虑为胰腺癌,伴腹腔动脉、脾动脉受侵,部分包绕;胃幽门部胃壁稍增厚(图1)。CA19-9 157.32 U/mL。胃镜示慢性浅表性胃炎伴糜烂。PET-CT示胰腺体部占位性病变且代谢增高,考虑为恶性。患者既往一般状况良好,无明显手术禁忌。
1.2 手术方法 气管插管全身麻醉,患者取仰卧分腿位,术者立于患者右侧,助手立于患者左侧。采用5孔法施术,常规建立CO2气腹,探查腹盆腔,排除转移。用超声刀充分打开胃结肠韧带,解剖胃十二指肠动脉(gastroduodenal artery,GDA)、肝总动脉(common hepatic artery,CHA),清扫LN8,确定GDA未受侵犯,肿瘤包绕腹腔动脉干、CHA及脾动脉起始部,悬吊CHA,试验性阻断CHA,2 min后可见明显肝固有动脉搏动,解剖胰腺下缘,暴露肠系膜上静脉(superior mesenteric vein,SMV),于其前方建立胰后隧道,直线切割闭合器离断胰颈,解剖出脾静脉(splenic vein,SV),根部结扎离断SV,于SMV左侧解剖显露肠系膜上动脉(superior mesenteric artery,SMA),循SMA走行清扫SMA前方及左侧淋巴脂肪组织,直至根部,向上暴露腹腔干,分离腹腔动脉干根部,未见肿瘤侵犯,悬吊腹腔动脉干,清扫其周边淋巴组织及腹腔神经节(丛),根部结扎离断腹腔动脉干,距GDA根部1 cm离断CHA,打开小网膜囊,解剖离断胃左动脉及冠状静脉,清扫LN7,向左侧游离胰体尾部至脾门,清扫LN9、LN11,完整切除包括胰体尾部、脾脏、左侧肾上腺及左侧肾前筋膜组织。标本装袋移出。见图2~图5。
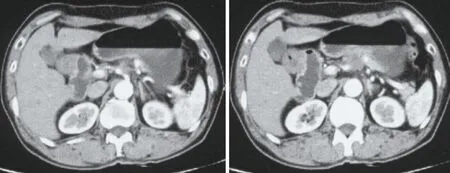
图1 上腹部增强CT

图2 悬吊CHA 图3 分离胰后隧道
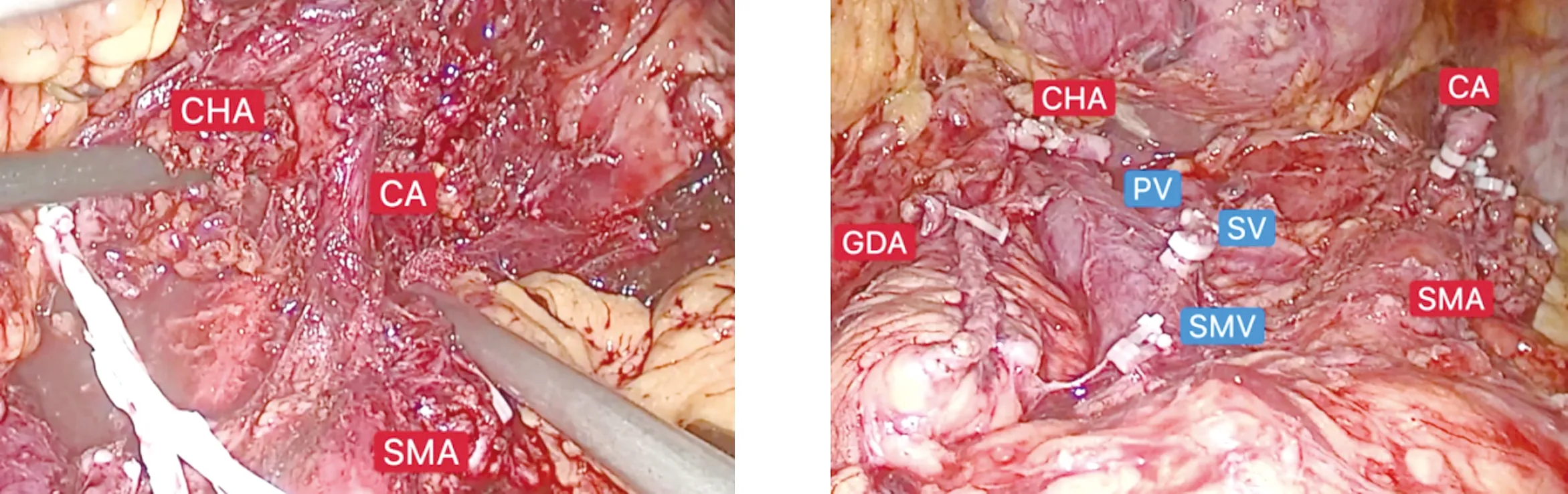
图4 解剖SMA及腹腔动脉干 图5 清扫后视野
2 结 果
患者成功完成腹腔镜手术,手术时间230 min,术中出血量300 mL,未输血。患者于术后第2天排气,下床活动,并开始进食流质,术后出现肝酶短暂轻度增高,予以保肝治疗后术后第4天恢复正常;出现生化漏,予以双套管冲洗,通畅引流后痊愈,术后第15天拔除腹腔引流管出院。术后病理:胰腺导管腺癌(3 cm×2 cm×3 cm),中-低分化,可见神经侵犯,血管断端、胰腺切缘及脾脏未见癌侵犯,胰周淋巴结(0/19)、脾周淋巴结(0/2)未见癌转移。术后予以口服替吉奥治疗6个月。患者于术后8个月发现肝转移,于术后10个月死亡。
3 讨 论
胰体尾恶性肿瘤发病隐匿,一经发现往往侵犯腹腔干。1953年加拿大外科医师Appleby[1]报道了联合腹腔干切除的胃癌根治术式,切除范围包括联合腹腔干、全胃、远端胰腺及脾脏,保留由胃十二指肠动脉弓至肝固有动脉的血流,并将其命名为“Appleby手术”。1976年Nimura等[2]首次将联合腹腔干及CHA切除的Appleby手术应用于胰腺体尾癌的扩大根治术中;1991年Hishinuma等[3]为改善患者术后营养吸收及生活质量,对Appleby手术进行了改进,保留了全胃,称为“改良Appleby手术”即DP-CAR。
DP-CAR利于病灶整块切除及腹主动脉前方的淋巴结清扫,可提高手术R0切除率,改善预后,并且通过手术可有效缓解腰背部疼痛等症状,提高术后生活质量[4-6]。日本的多中心研究[7]显示,DP-CAR组的R0切除率为67%,并发症发生率明显高于传统胰体尾癌根治组(63% vs. 47%),中位生存时间短于传统胰体尾癌根治组(17.5个月vs. 28.6个月),但亚组分析显示DP-CAR组中接受辅助治疗的患者较未接受的患者中位生存时间明显延长(21.9个月vs. 6.7个月)。欧洲的多中心研究[8]显示,DP-CAR组R0切除率为53%,90 d内死亡率较高,达到16%,其中82%的患者接受了新辅助或辅助化疗,中位生存时间为18个月。笔者中心[9]报道显示,DP-CAR组患者术后C级胰瘘及术后出血发生率明显高于传统胰体尾癌根治组,但两组患者的中位生存时间分别为19个月与20个月,两组差异无统计学意义。
2003年Strasberg等[10]提出了根治性顺行模块化胰脾切除(radical antegrade modular pancreatosplenectomy,RAMPS)的理念并报道了其早期临床效果。其优势在于强调更深层面的切除包括肾前筋膜、肾前脂肪囊甚至左侧肾上腺等,旨在提高R0切除率并改善预后。韩国学者提出在经过选择的胰体尾肿瘤患者中,微创RAMPS可使患者获益,并定义该标准为Yonsei标准[11],具体内容为:(1)肿瘤局限于胰腺;(2)远端胰腺、左肾上腺与肾之间存在完整筋膜层;(3)肿瘤距腹腔干至少1~2 cm。韩国Kim等[12]报道了15例腹腔镜RAMPS的研究结果,R0切除率为100%,淋巴结获取数量为(18.1±6.2)个,术后3年无病生存率与存活率分别为56.3%与74.1%,中位生存期为40个月,显示出较好的远期生存获益。我国学者也提出在腹腔镜胰腺手术经验丰富的中心开展腹腔镜RAMPS是安全、可行的[13]。
目前,DP-CAR的微创手术报道较少[14-17]。2011年Cho等[14]完成首例腹腔镜下LDP-CAR。2016年刘荣等[15]报道了1例联合腹腔干切除术的达芬奇机器人辅助下胰体尾癌扩大根治术。匹兹堡医学中心[16]回顾性分析30例行DP-CAR患者的资料,与开放组相比,达芬奇机器人手术系统组具有手术时间短(316 min vs. 476 min)、出血量少(393 mL vs. 1 736 mL)及输血率低(0 vs. 54%)的优势,虽然两组R0切除率相当(82% vs. 79%),但达芬奇机器人手术系统组可清扫更多的淋巴结(34枚vs. 18枚),两组中位生存时间差异无统计学意义(33个月vs. 40个月)。作者分析原因考虑达芬奇机器人系统可提供更好的后腹膜视野,安全有效地解剖腹腔动脉干旁结构,应用单、双极工具可减少清扫动脉周围淋巴结的出血。
2017版NCCN指南更新,对于胰体尾癌,肿瘤侵犯腹腔干>180°,如果肿瘤无主动脉及GDA侵犯,改良Appleby手术提供了R0切除的可能性,属于交界可切除。目前国内外指南均建议条件允许时先行新辅助化疗,以评估其肿瘤生物学行为,并提高R0切除率。约翰霍普金斯医院[18]统计了17例DP-CAR患者,其中15例术前进行了新辅助化疗,80%的患者选用了FOLFIRINOX方案,2例未行化疗的均为R1切除,而化疗的15例中仅1例为R1切除。Nakamura等[19]回顾分析了80例DP-CAR患者,接受新辅助治疗组较未接受新辅助治疗组生存时间明显延长,术后1、3、5年生存率分別为100%、78.8%、78.8%与77.9%、39.5%、26.7%。日本其他团队[20-21]的研究也显示,新辅助治疗后可降低肿瘤的血管侵犯、淋巴转移,提高DP-CAR的R0切除率,延长患者的生存期。
对于胰体尾癌患者,DP-CAR与RAMPS相互结合,有足够的切除范围,可获得较高的R0切除率。LDP-CAR手术操作难度较大,严格选择合适的患者,手术可在具有丰富开放及腹腔镜经验的胰腺中心进行。LDP-CAR的肿瘤学效果有待进一步评估,正确使用新辅助治疗进行转化治疗,可进一步提高胰腺癌患者的生存率。
