微创与开腹远端胰腺切除术围手术期的预后比较
2019-10-12田蓝天孙传东张炳远邱法波郭卫东
王 涛,周 斌,刘 好,陈 鹏,田蓝天,胡 骁,孙传东,张炳远,邱法波,郭卫东
(青岛大学附属医院,山东 青岛,266003)
随着现代腹腔镜技术的发展,外科手术方式呈现出多元化的特点。与肝脾胃肠等器官不同,胰腺作为腹膜后器官之一,位于人体腹腔较深处[1]。位置的特殊性、病理类型的多样性及与周围血管解剖关系的复杂性导致胰腺外科的手术很难做到像流水线一样统一。20世纪初,Mayo[2]首先报道了3例开腹远端胰腺切除术(open distal pancreatectomy,ODP),距1996年第一台腹腔镜远端胰腺切除术[3](laparoscopic distal pancreatectomy,LDP)及2002年[4]第一例机器人远端胰腺切除术(robotic distal pancreatectomy,RDP)的问世跨越了近一个世纪的时间。而后的十余年间,微创远端胰腺切除术(minimally invasive distal pancreatectomy,MIDP)在世界范围内迅速发展。腹腔镜技术以其画面清晰、器官毗邻易于显露及操作的灵活性等诸多特点,被越来越多的胰腺外科医生所接受。尽管如此,仍有部分外科医生对于MIDP的安全性、临床疗效、手术方式的选择及保留脾脏等方面存在担忧与困惑。本研究通过比较分析单中心MIDP组与ODP组患者术前、术中、术后的相关临床资料,评价胰腺体尾部肿瘤不同手术方式的临床疗效,进而为临床提供借鉴意义。
1 资料与方法
1.1 临床资料 回顾分析2014年1月至2019年5月在青岛大学附属医院行远端胰腺切除患者的临床资料,共263例患者纳入统计分析,其中126例行MIDP,包括78例LDP、48例RDP,137例行传统ODP,LDP组中转开腹5例。根据手术方式分为微创组与开放组,微创组包括LPD与RPD。对比两组患者术前、术中、术后情况及病理资料,并进一步将微创组分为腹腔镜组与机器人组,进一步探讨两亚组的临床疗效。手术对象均接受术前肺功能锻炼,吸烟者停止吸烟1周,尽量减少术后咳嗽、大量咳痰及肺部感染等呼吸系统并发症。纳入标准:(1)胰体尾部良性病变,良性、交界性及恶性肿瘤;(2)无严重肝、肾、心、脑功能障碍。排除标准:(1)上腹部有手术史并存在严重粘连;(2)术中联合多脏器切除;(3)术中发现远处转移。
1.2 是否保脾 所选病例除恶性肿瘤需联合切除脾脏,对于良性病变、低度恶性病变等,术中应尽量保留脾脏。保脾方式包括:保留脾动静脉Kimura法[5];切断脾动脉或切断脾动静脉、保留脾胃韧带中的胃短动脉及胃后动脉Warshaw法[6]。如术中出现以下情况时也行脾切除术:(1)脾梗死、脾血管血栓形成;(2)解剖脾静脉或脾门有困难(脾静脉血管比较脆,位于胰腺后位,且与胰腺关系紧密);(3)脾血管或脾内出血。LDP见图1;RDP见图2。
1.3 观察指标 观察患者的术前情况:包括年龄、性别、体重指数(body mass index,BMI),是否合并高血压、糖尿病,术前CEA、CA125、CA19-9、白蛋白、血红蛋白、ASA分级,胰管是否扩张;术中情况:包括手术时间、手术出血量、术中有无输血、是否保脾;术后情况:术后住院时间、首次进食时间、首次排气时间、术后是否胰瘘、出血、腹腔感染、切口感染、死亡、再次手术、引流管拔除时间、住院费用;术后病理情况:病理类型、肿瘤直径、R0切除率等。胰瘘的诊断标准按照国际胰瘘研究小组2016年更新的定义与分级标准[7],包括B级、C级瘘,生化瘘不诊断为胰瘘。
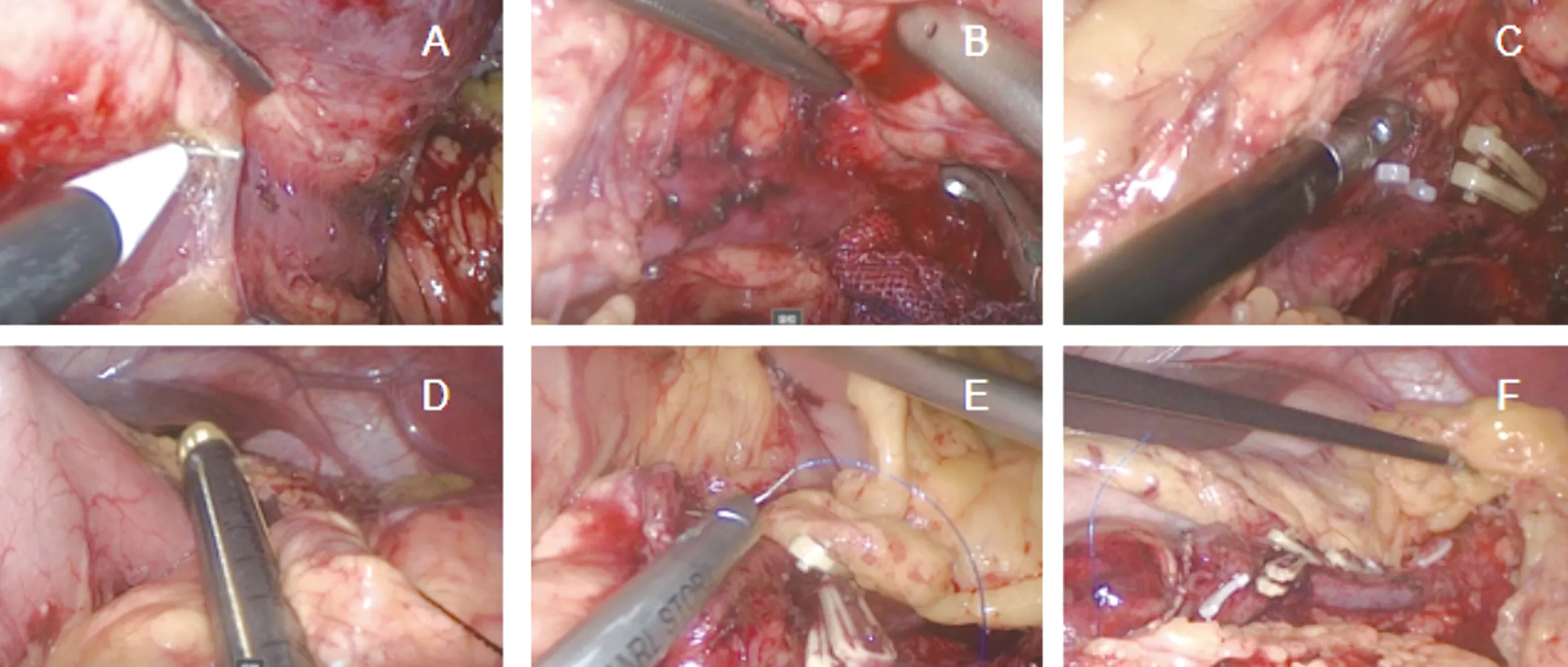
图1 LDP(A:分离胰腺与脾静脉;B:显露脾静脉属支;C:断脾静脉属支;D:横断胰腺;E:断端缝合;F:胰腺断面与脾动静脉
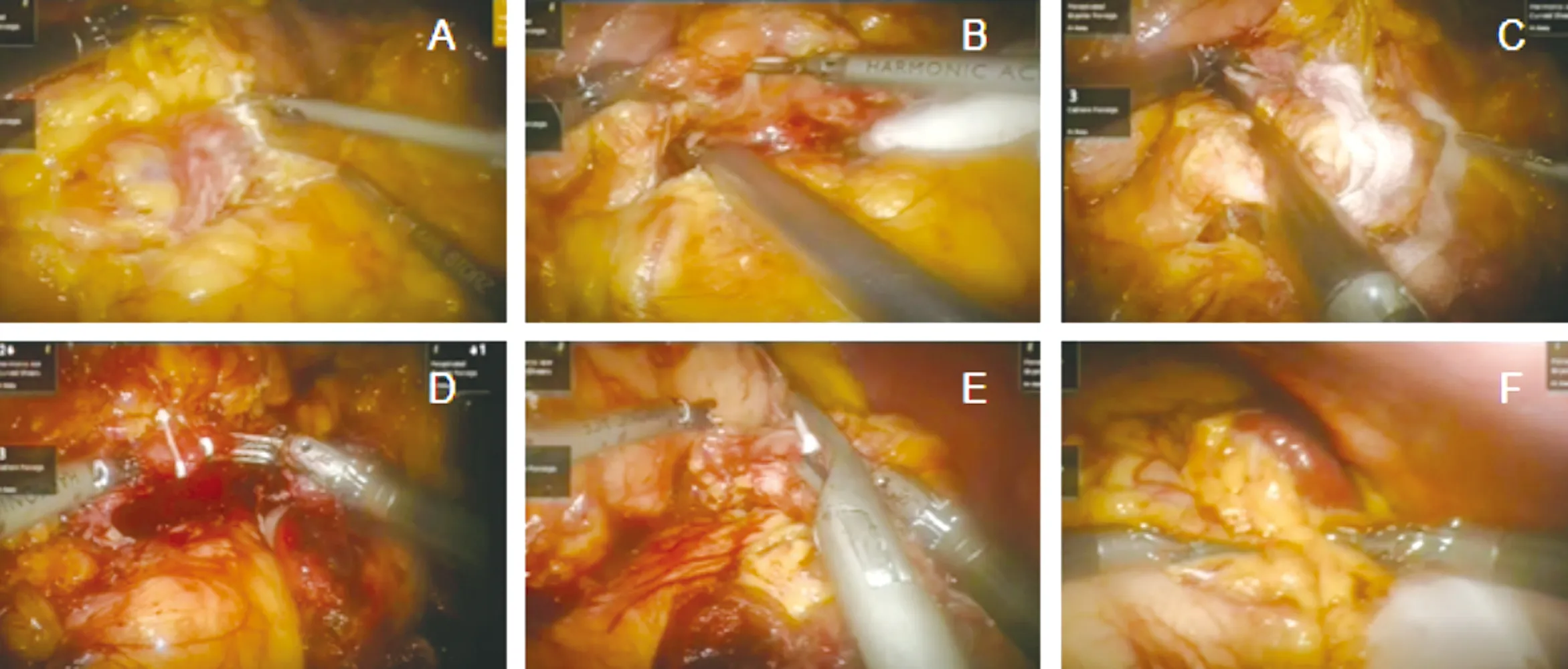
图2 RDP(A:显露胰腺;B:断脾静脉属支;C:横断胰腺;D:断脾静脉;E:断脾动脉;F:观察脾脏色泽)
2 结 果
2.1 MIDP组与ODP组患者一般情况及手术相关指标的比较 微创组与开放组患者在年龄、性别、BMI、合并症、术前检验指标、ASA分级、胰管是否扩张方面差异无统计学意义(P>0.05),见表1。开放组手术时间短于微创组,住院费用低于微创组,差异有统计学意义(P<0.001);微创组术中出血量、保脾率、住院时间、术后首次进食时间、排气时间、拔管时间、切口感染率均优于开放组,差异有统计学意义(P<0.05);两组术中输血率、胰瘘发生率、术后30 d内死亡率、术后出血率、腹腔感染率等差异无统计学意义(P>0.05),见表2。
2.2 MIDP组与ODP组患者术后病理资料的比较 开放组中胰腺癌50例、胰腺囊性肿瘤40例、实性假乳头状瘤18例、神经内分泌肿瘤11例、胰腺炎5例、其他13例;微创组中胰腺癌13例、胰腺囊性肿瘤56例、实性假乳头状瘤27例、神经内分泌肿瘤17例、胰腺炎3例、其他10例。两组患者肿瘤类型、肿瘤长径差异有统计学意义(P<0.05),手术切缘差异无统计学意义(P>0.05),见表3。
2.3 LDP组与RDP组患者手术相关指标的比较 腹腔镜组手术时间、术中出血量、术中输血率、胰瘘发生率、出血发生率、腹腔感染、切口感染、术后30 d内死亡率、引流管拔除时间与机器人组相比差异无统计学意义(P>0.05);机器人组住院费用高于腹腔镜组,差异有统计学意义(P<0.001);机器人组保脾率、住院时间、术后首次进食时间、首次排气时间优于腹腔镜组,差异有统计学意义(P<0.05),见表4。
表1 微创组与开放组患者一般情况的比较
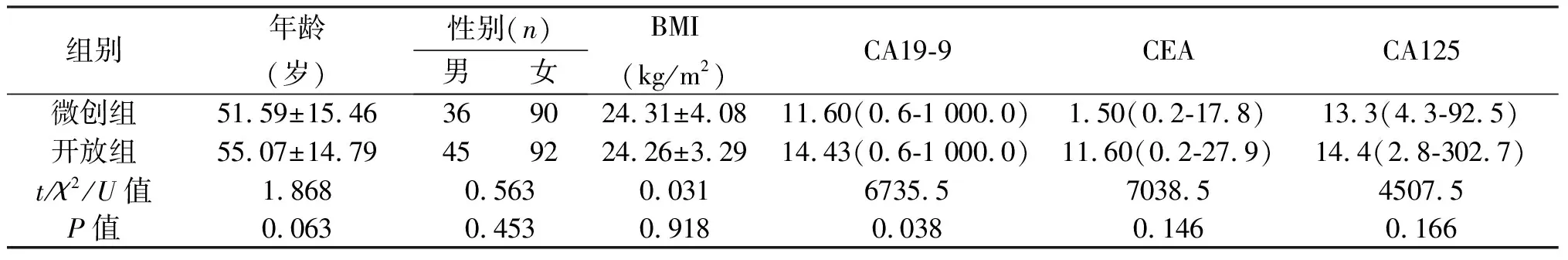
组别年龄(岁)性别(n)男女BMI(kg/m2)CA19-9CEACA125微创组51.59±15.46369024.31±4.0811.60(0.6-1 000.0)1.50(0.2-17.8)13.3(4.3-92.5)开放组55.07±14.79459224.26±3.2914.43(0.6-1 000.0)11.60(0.2-27.9)14.4(2.8-302.7)t/χ2/U值1.8680.5630.0316735.57038.54507.5P值0.0630.4530.9180.0380.1460.166
续表1
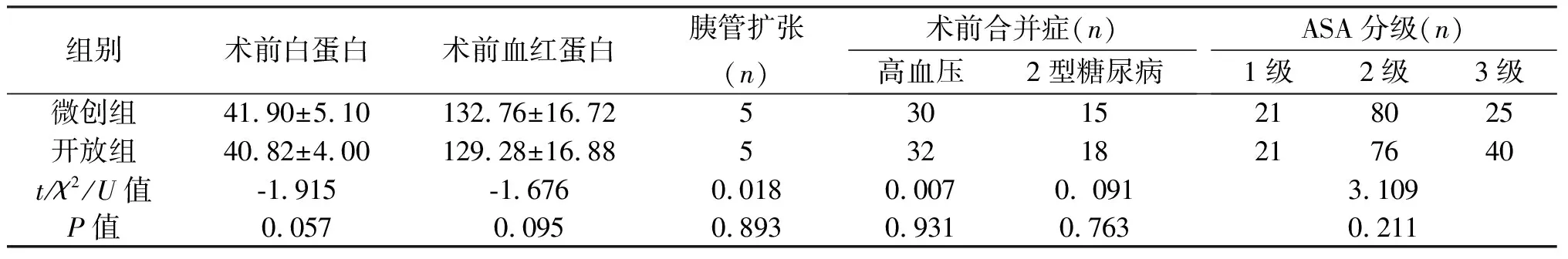
组别术前白蛋白术前血红蛋白胰管扩张(n)术前合并症(n)高血压2型糖尿病ASA分级(n)1级2级3级微创组41.90±5.10132.76±16.7253015218025开放组40.82±4.00129.28±16.8853218217640t/χ2/U值-1.915-1.6760.0180.0070. 0913.109P值0.0570.0950.8930.9310.7630.211
表2 微创组与开放组术中、术后情况的比较
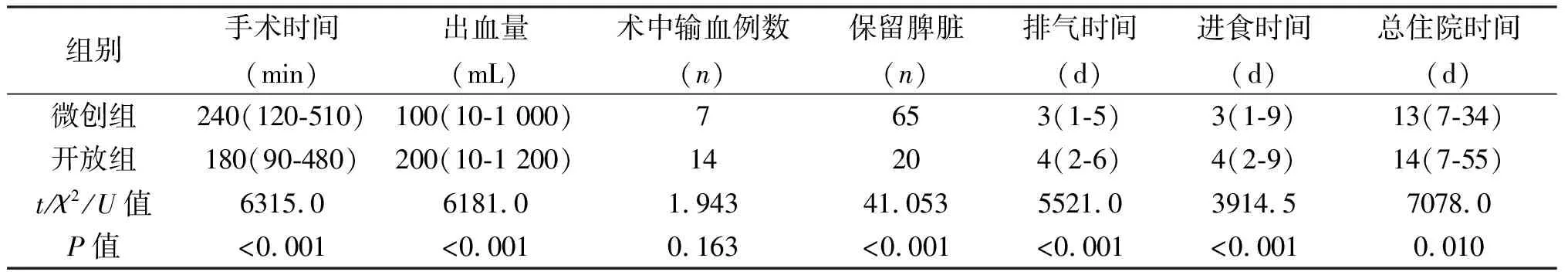
组别手术时间(min)出血量(mL)术中输血例数(n)保留脾脏(n)排气时间(d)进食时间(d)总住院时间(d)微创组240(120-510)100(10-1 000)7653(1-5)3(1-9)13(7-34) 开放组180(90-480)200(10-1 200)14204(2-6)4(2-9)14(7-55) t/χ2/U值6315.06181.01.94341.0535521.03914.57078.0 P值<0.001<0.0010.163<0.001<0.001<0.0010.010
续表2
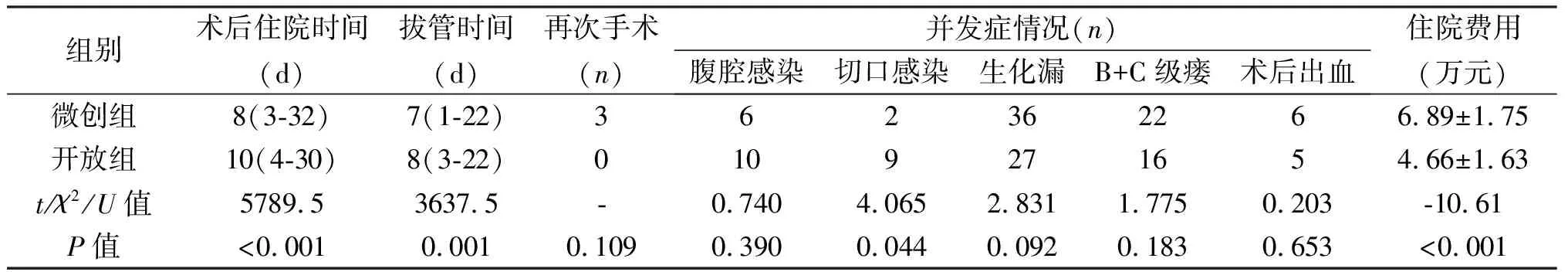
组别术后住院时间(d)拔管时间(d)再次手术(n)并发症情况(n)腹腔感染切口感染生化漏B+C级瘘术后出血住院费用(万元)微创组8(3-32)7(1-22)362362266.89±1.75开放组10(4-30)8(3-22)0109271654.66±1.63t/χ2/U值5789.53637.5-0.7404.0652.8311.7750.203-10.61P值<0.0010.0010.1090.3900.0440.0920.1830.653<0.001
表3 两组患者术后病理情况的比较

组别肿瘤类型(n)胰腺癌胰腺炎胰腺囊性肿瘤实性假乳头状瘤神经内分泌肿瘤其他肿瘤长径(mm)手术切缘(R0)(n)微创组1335627171043.52±26.84126开放组5054018111357.66±38.65134t/χ2/U值-3.4180.922P值<0.0010.0010.248
表4 腹腔镜组与机器人组术中、术后情况的比较

组别手术时间(min)出血量(mL)术中输血例数(n)保留脾脏(n)排气时间(d)进食时间(d)总住院时间(d)腹腔镜组225(120-510)100(10-1 000)1313(2-5)3(2-6)14(7-34)机器人组240(168-390)100(30-500)6342.5(1-4)3(1-9)12(7-23)t/χ2/U值1836.51623.5-11.5001143.01188.51454.0P值0.8570.2470.2500.0010.001<0.0010.035
续表4
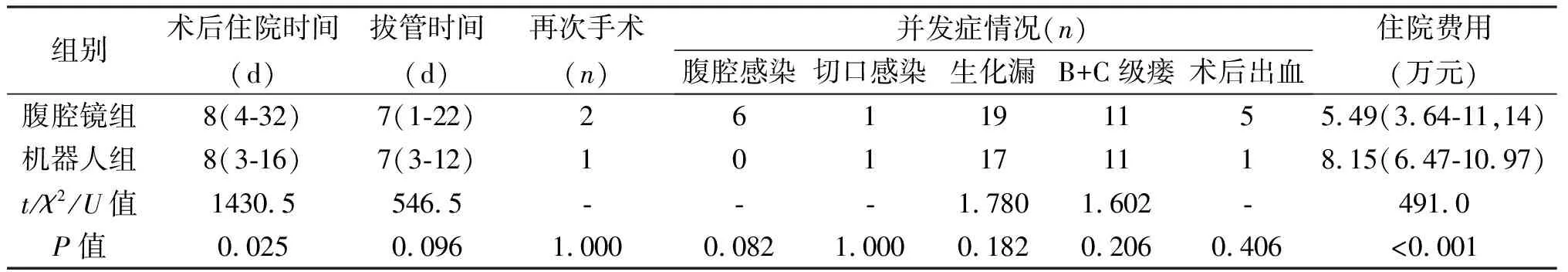
组别术后住院时间(d)拔管时间(d)再次手术(n)并发症情况(n)腹腔感染切口感染生化漏B+C级瘘术后出血住院费用(万元)腹腔镜组8(4-32)7(1-22)261191155.49(3.64-11,14)机器人组8(3-16)7(3-12)101171118.15(6.47-10.97)t/χ2/U值1430.5546.5---1.7801.602-491.0P值0.0250.0961.0000.0821.0000.1820.2060.406<0.001
3 讨 论
近十年,微创技术的发展为医学领域带来了日新月异的变化,大量证据表明,医学微创技术具有的手术创伤小、操作精细、术后康复快等优点,是传统开腹手术所达不到的,因此,微创技术也越来越多地应用于外科手术的各领域[8]。早在2007年Takaori的研究就表明,LDP治疗良性或交界性胰腺肿瘤是安全、可行的[9]。最新的高质量系统评价表明,MIDP在胰体尾肿瘤中的应用相较开腹手术在同样安全可行的前提下具有一定优势[10-11]。这与本中心的结果是相符合的,如MIDP组患者在术后胃肠道功能恢复、住院时间、引流管拔除时间、切口感染发生率、保脾率等方面明显优于ODP组,差异均有统计学意义。脾脏是人体重要的免疫器官,对于良性、交界性及低度恶性未侵袭脾血管的胰体尾肿瘤而言,我们应尽量选择保留脾脏的远端胰腺切除术,但因为出血风险高、操作难度大,是胰腺外科的手术难点。既往研究报道,远端胰腺切除术保脾率为2%~70%[12-13]。我们的研究发现,MIDP的保脾率高于ODP,达到半数以上,对于良性、交界性及低度恶性肿瘤而言,MIDP组较ODP组保脾率更高(57.52%),差异有统计学意义(P<0.001)。由于本中心保脾方式首选Kimura法[5]尽量保留脾血管,因此本中心MIDP与ODP保脾患者中均未出现脾梗死的状况。在经济效益方面,邢宏松等[14]发现,与开腹手术相比,LDP虽然住院总费用稍多,但术中输血少、术后康复快,有助于提高治疗效果。本研究中心微创组住院费用明显高于开腹组,主要原因可能与MIDP术中腹腔镜配套组件、切割闭合器、血管夹等一次性耗材有关,这与de Rooij等[15]提出的MIDP总体医疗成本与ODP相当(即非显著减少)不符。如果想在一定程度上解决这个问题,可通过提高手术熟练度、缩短住院时间实现。国内外不同医学中心在两种手术方式手术时间的比较中尚存有差异[16-17]。我们的结果表明,MIDP患者手术时间长于ODP患者,笔者分析,这与本中心腹腔镜与机器人胰腺手术起步较晚,数据覆盖MIDP学习曲线的各阶段有关。开展MIDP初期,应以手术操作安全为重心,其次可能与MIDP手术区域显露困难、操作较ODP复杂有关,尤其MIDP术中保脾率高、出血量少,要求术中操作更为精细,耗时较长。
本中心MIDP组恶性、交界性肿瘤57例(45.24%)、良性肿瘤69例(54.76%),而ODP组恶性、交界性肿瘤84例(61.31%)、良性肿瘤53例(38.69%),病理类型、肿瘤大小等方面两组差异有统计学意义。笔者认为,这种手术方式的选择偏倚不可避免且具有一定的合理性。原因可能为:(1)胰腺恶性肿瘤发病隐匿、侵袭性高、位置特殊等特点导致一经发现便与周围脏器、血管失去明显界限。(2)本着手术安全性原则,微创完整切除直径较大的肿瘤难度仍然较大。通过观察发现,随着手术技术的逐渐成熟,MIDP组中恶性肿瘤患者的比例也在增高。
国内赵玉沛等[18]在RDP学习曲线的探究中表明,手术例数达到48例后便达到成熟期。截至目前,本中心共完成48例RDP,结果表明LDP组与RDP组在肿瘤类型、肿瘤直径、手术时间、术中出血量、术中输血率、术式选择及安全性方面差异无统计学意义。但RDP组保脾率却达到百分之七十,其中非恶性肿瘤的保脾率高达77.27%,这可能得益于机器人手术系统拥有三维高清放大视野,消除了手部震颤,可实现更稳定精准的操作,术中对脾静脉属支的游离缝合等操作更加灵活方便。在经济效益方面,刘荣等[19]进行了相关研究,机器人在高难度及复杂的保留脾脏远端胰腺切除术中可能更具优势,但目前机器人手术成本较高,限制了机器人手术的推广应用,因此高昂的手术耗材费仍是阻碍机器人手术发展的原因之一。
MIDP在切口感染、术后胃肠道恢复及保脾率等方面优于开放远端胰腺切除术,手术安全性无差异。对于良性、交界性、低度恶性的胰腺体尾部肿瘤,我们应优先选择微创术式。RDP保脾率高,不失为经济条件优越患者的更好选择。本研究为回顾性病例对照研究,数据仅来自一个中心,样本例数并不大,技术仍需完善,所有这些因素在一定程度上限制了研究结果的普遍性。在以后的探究中,大样本的队列研究及高质量的系统评价显得更为重要。
