良性阵发性位置性眩晕与骨质疏松及血清MMP-9 TNF-α TIMP2的相关性
2019-10-12聂德新姜腾波
聂德新 姜腾波
良性阵发性位置性眩晕(BPPV)俗称耳石症,是临床常见的外周眩晕疾病,在老年人群中发病率接近9%,主要临床表现为当头位或体位改变时,出现短暂性的眩晕,并伴有自主神经症状。该病具有自愈性,但可复发,每年复发率约为15%[1]。有报道显示BPPV可能与骨质疏松相关,老年女性BPPV患者骨密度远低于老年健康女性[2]。基质金属蛋白酶9(MMP-9)、肿瘤坏死因子-α(TNF-α)、基质金属蛋白酶抑制剂(TIMP2)在破骨细胞迁移、骨代谢及骨吸收中发挥重要作用,有研究显示MMP-9、TNF-α、TIMP2与合并骨质疏松症存在显著相关[3]。但目前尚无其与BPPV的相关报道。本文探讨BPPV与骨质疏松、MMP-9、TNF-α、TIMP2的相关性。
1 资料与方法
1.1 临床资料 选取2015年1月至2018年1月本院良性阵发性位置性眩晕患者148例为观察组,男55例,女93例;年龄32~74岁,平均年龄(54.45±8.06)岁。体质指数(BMI)(23.95±2.51)kg/m2。抽烟18例,饮酒14例,高血压27例。另取同期非BPPV的体检健康者148例为对照组,男51例,女97例;年龄35~72岁,平均年龄(55.21±8.65)岁。BMI为(23.24±2.96)kg/m2。抽烟23例,饮酒19例,高血压24例。两组患者性别、年龄、BMI、抽烟、饮酒、高血压等一般资料比较,差异无统计学意义(P>0.05)。本项目经本院伦理委员会批准,患者或家属知情并签署同意书。
1.2 纳入及排除标准 纳入标准:(1)符合中华耳鼻咽喉头颈外科学分会制定的BPPV诊断标准;(2)无神经系统其他定位体征及听力障碍;(3)无服用毒性药物史;(4)头颅MRI正常;(5)无严重器质类疾病。排除标准:(1)中枢性眩晕患者;(2)因梅尼埃病、前庭神经元炎、迷路炎等因素引起的眩晕患者;(3)有耳部、眼部、周围前庭器官疾病及神经系统疾病史;(4)有骨折史的患者。
1.3 方法 通过双能X射线吸收测定法(DXA)对两组患者行腰椎、股骨颈骨密度(BMD)检测。BMD检测参照中华医学会骨质疏松、骨矿盐疾病分会制定的原发性骨质疏松症诊断指南,BMD测定结果用T值表示,T值=(测定值-骨峰值)/健康成人BMD标准差。骨量正常:T值≥-1;骨量减少:-2.5<T值<-1;骨质疏松:T值≤-2.5。分析两组骨质疏松、骨量低下发生率的差异,采用ELISA法检测各组血清MMP-9、TNF-α、TIMP2水平,检测严格按照试剂盒操作标准进行。
1.4 统计学方法 采用SPSS19.0统计软件。计量资料以(s)表示,采用独立样本t检验;计数资料以%表示,采用χ2检验。多因素分析采用logistic回归分析,相关性分析用Pearson相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 两组骨质疏松、骨量低下发生率比较 见表1。
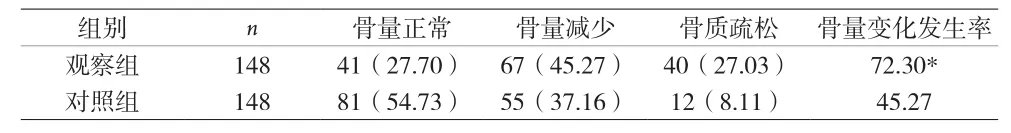
表1 两组骨质疏松发生率比较[n(%)]
2.2 两组不同年龄段、不同性别BMD值比较 见表2。
表2 两组女性不同年龄段BMD值比较(s)

表2 两组女性不同年龄段BMD值比较(s)
注:与对照组比较,*P<0.05
?
2.3 BPPV与各因素相关性分析 logistic回归分析显示:骨量减少、骨质疏松是BPPV的危险因素,OR值为 3.9,95% 置信区间 1.50~9.36,P<0.05。
2.4 BPPV各组患者MMP-9、TNF-α、TIMP2水平比较 骨质疏松组、骨量减少组血清MMP-9、TNF-α水平及MMP-9/TIMP2值显著高于骨量正常组,骨质疏松组显著高于骨量减少组,差异有统计学意义(P<0.05);TIMP2水平在骨量正常组、骨量减少组、骨质疏松组逐渐升高,差异无统计学意义(P>0.05),见表3。
表3 BPPV各组患者血清MMP-9、TNF-α、TIMP2水平比较(s)

表3 BPPV各组患者血清MMP-9、TNF-α、TIMP2水平比较(s)
注:与骨量正常组比较,*P<0.05;与骨量减少组比较,#P<0.05
?
2.5 骨密度与血清MMP-9、TNF-α、TIMP2水平相关性分析 Pearson相关性分析显示,腰椎BMD、股骨颈BMD与血清MMP-9、MMP-9/TIMP2呈显著负相关,与TNF-α、TIMP2水平无显著相关性。见表4。

表4 骨密度与血清MMP-9、TNF-α、TIMP2水平相关性分析
3 讨论
BPPV是神经内科常见的前庭疾病,是一种最常见的前庭周围性眩晕,最常累计的半规管是后半规管,其次是外半规管[4]。临床上如头部创伤、偏头痛、病毒性神经迷路炎、耳部手术等均可引起BPPV[5]。BPPV的发病机制尚不清楚,通常认为碳酸钙碎屑形成耳石是其发病前提条件,耳石沉积于半规管内,因耳石内含有大量钙离子会影响内耳迷路内环境,进而影响内淋巴流动,通过在嵴顶移位不同的半规管出现相应症状及眼震[6]。病理状态下,骨重建率升高,骨形成周期延长,新骨形成相对旧骨吸收不足,导致骨丢失,因此抑制骨吸收逐渐成为骨病防治新的研究方向。MMPS是存在于骨基质中的蛋白酶,可降解多种骨胶原,有研究显示其在骨质疏松机制中至关重要[7]。
有研究显示BPPV与骨质疏松存在显著相关[8]。本资料显示,观察组BMD显著低于对照组,观察组骨质疏松/骨量减少发生率显著高于对照组,差异有统计学意义,与相关研究结果一致。进一步分析结果显示观察组女性≥48岁组BMD显著低于对照组,差异有统计学意义,与Vibert D等研究结果一致[9]。而临床显示中老年女性BPPV发病率显著升高,提示BPPV可能与雌激素缺乏相关。原因可能为绝经后雌激素减少,对骨细胞直接作用减少,骨转换能力显著增高;同时,影响骨骼外钙离子水平动态平衡,减少肠道钙吸收,降低钙离子重吸收,造成骨质疏松,骨质疏松可使耳石成分异常,从而自椭圆囊斑脱落导致眩晕、眼震,导致BPPV发生,骨韧性会显著下降,加剧骨矿盐丢失,引发骨质疏松[10]。MMPS是一组由钙离子激活的含锌离子内肽酶,广泛存在于结缔组织中,是降解细胞外机制和基底膜过程中的关键酶。MMP-9即是MMPS成员之一,在体内以酶原形式分泌,可在破骨细胞中特异性表达,可促进骨质疏松形成。TIMP是近年来发现的一组内源性特异性抑制MMPS活动糖蛋白,是MMPS抑制因子,多随MMPS表达而特异性表达。TIMP2是TIMP成员之一,含12个高度保守的半胱氨酸残基,分子可与MMP-9结合,封闭MMP-9催化区,影响其酶活性,进而抑制MMP-9生物学效益[11]。MMPS基因表达与酶合成可受TNF-α调控,TNF-α能刺激或诱导MMPS转录水平表达,进而参与调节骨代谢和重塑,并能直接作用于破骨细胞及前体细胞,进而强化破骨细胞活性,加剧骨量丢失及骨质破坏。有研究显示骨质疏松患者血清MMP-9、TNF-α水平较健康人显著升高[12]。本资料结果显示骨质正常组、骨量减少组、骨质疏松组血清MMP-9、TNF-α水平及MMP-9/TIMP2值逐渐升高,差异有统计学意义,说明以上指标随着BMD的下降而升高,与相关研究结果一致。提示血清MMP-9、TNF-α及MMP-9/TIMP2表达与可能与骨质疏松密切相关,机制当骨质疏松发生时,成骨细胞受到促骨吸收因子刺激后分泌MMP-2,使胶原屏障降解,破骨细胞与矿化骨基质接触,激活破骨细胞活性及功能,MMP-9表达随者破骨细胞骨吸收能力增强而不断升高;同时,引起核因子kB激活,使炎症细胞因子TNF-α表达加强,使其转录活性增强。
骨质疏松/骨量减少是良性阵发性位置性眩晕发生的危险因素,骨质疏松/骨量减少与MMP-9水平、TNF-α及MMP-9/TIMP2值密切相关。MMP-9、TNF-α及TIMP2可能在良性阵发性位置性眩晕与骨质疏松发生发展中发挥重要作用,对于良性阵发性位置性眩晕诊断及治疗具有重要价值。
