慢性睡眠剥夺对小鼠海马胶质细胞α7-nAChR影响的研究☆
2019-10-11万亚会吴伟张轩孙晓倩薛蓉
万亚会 吴伟 张轩 孙晓倩 薛蓉
α7-nAChR是烟碱型乙酰胆碱受体(nicotinic acetylcholinereceptor,nAChR)的一种亚型,主要分布于中枢神经系统,参与介导学习、记忆巩固、运动、注意力等过程[1],研究表明α7-nAChR对钙离子有较高的渗透性[2],增强谷氨酸盐的释放,具有神经保护、促进突触再生及神经元生存的作用[3],可能在认知功能障碍的发展中起重要作用。目前的研究多关注α7-nAChR在卒中[4]、心肌缺血再灌注[5]、肺损伤[6]等动物模型中的表达及作用机制。睡眠是人类重要的生理过程,快速眼球运动(rapid eyes movement,REM)睡眠期对记忆形成、巩固及突触的可塑性具有重要作用[7],睡眠不足会引起日间嗜睡、注意力不集中及学习工作效率的下降,长期睡眠不足或睡眠剥夺可导致认知功能下降[8]。因此本研究旨在观察慢性睡眠剥夺对小鼠海马组织α7-nAChR的影响,为今后深入探索α7-nAChR在睡眠剥夺后认知功能下降的可能机制提供依据。
1 对象与方法
1.1 实验对象与分组雄性C57BL/6J小鼠,7~8周龄,体重在20 g~23 g之间,由北京华阜康生物科技股份有限公司提供。C57BL/6J小鼠随机分为3组,每组24只,对照(CC)组:适宜环境下饲养1周,对照组再同笼饲养7 d后处死;慢性睡眠剥夺(sleep deprivation,SD)组:适宜环境下饲养 1 周,利用改良多平台水环境法进行慢性睡眠剥夺7 d后处死;慢性睡眠剥夺后腹腔注射α7-nAChR激动剂-PHA-543613(SD+PHA-543613)组:适宜环境下饲养1周,利用改良多平台水环境法进行睡眠剥夺7 d,睡眠剥夺结束后6 h腹腔注射α7-nAChR受体激动剂PHA-543613(6 mg/kg,sigma公司,美国),连续腹腔注射3 d后处死,CC组于处死前3 d连续腹腔注射等量的生理盐水,所有小鼠均严格遵循12 h光照,12 h黑暗的昼夜节律。
1.2 实验方法
1.2.1 慢性睡眠剥夺模型的建立 使用改良多平台水环境法(modified multiple platform method,MMPM)对小鼠进行慢性睡眠剥夺,剥夺箱内均匀放有8个圆形平台,造模前向剥夺箱内加水至平台下方约 1 cm处,水温保持在(22±2)℃,剥夺箱顶部放置水和食物,小鼠可在平台间自由活动、摄食及饮水,每天定时更换水以保持清洁。睡眠剥夺过程保证 12 h 光照(9:00~21:00)、12 h 黑暗(21:00~9:00)的昼夜节律。造模开始前3 d每天定时把SD组的小鼠放在睡眠剥夺水箱内适应环境,每天适应2 h。睡眠剥夺过程从9:00开始,每天17:00~21:00把小鼠从剥夺箱中拿出,放至原来的鼠笼中休息4 h,连续睡眠剥夺7 d。
1.2.2 免疫荧光染色检测星形胶质细胞和小胶质细胞表面α7-nAChR的表达 三组小鼠腹腔注射10%的水合氯醛进行麻醉,麻醉成功后使用冰PBS灌注,直至肝脏变白、自右心耳流出为澄清液体,分离脑组织,先于4%多聚甲醛浸泡过夜固定,再先后置于15%和30%的蔗糖溶液中梯度脱水,脱水成功后切除额极和脑干,包埋脑组织,冰冻切片机下连续切片,取各组海马组织切片,每只小鼠各取5片,切片厚度为8 μm。海马组织切片经固定、破膜,与大鼠抗小鼠 α7-nAChR抗体(1:100,Santa Cruz Biotechnology公司)、山羊抗小鼠IBA-1抗体 (1:500,Abcam公司,英国),兔抗小鼠GFAP 抗体(1:1000,Abcam 公司,英国)4℃孵育过夜,次日与山羊抗兔IgG(FITC)(1:1000,Abcam 公司,英国),驴抗大鼠IgG(Alexa Fluor 596)(1:500,Jackson 公司,美国),驴抗山羊 IgG(Alexa Fluor 488)(1:500,Jackson 公司,美国)室温避光孵育 1h,DAPI封片,免疫荧光显微镜观察,计数α7-nAChR与星形胶质细胞和小胶质细胞的共表达的阳性细胞数。
1.2.3 Western印迹法检测α7-nAChR蛋白表达分离三组小鼠海马组织,加入裂解液,使用超声粉碎,于4℃离心机14000 rpm,离心30 min,吸取上清,BCA蛋白试剂盒测定蛋白浓度。等量蛋白经电泳转到聚亚乙烯双氧化物膜(PVDF)上,蛋白条带加入大鼠抗小鼠α7-nAChR抗体(1:200,Santa Cruz Biotechnology公司)4℃慢摇孵育过夜,次日与HRP标记的山羊抗大鼠IgG抗体(1:5000,北京中杉金桥生物技术有限公司)室温慢摇孵育1 h,ECL超敏发光混合液进行凝胶成像拍照。
1.2.4 实时荧光定量PCR(Rt-PCR)检测α7-nAChR的mRNA表达 分离三组小鼠海马组织,使用Trizol试剂提取RNA,紫外分光光度计检测RNA浓度。加入逆转录反应体系,将RNA逆转录合成cDNA第一条链,再向cDNA模板中加入PCR预混液进行PCR扩增,Bio-Rad检测目的基因的相对表达水平,通过比较CT值获得目的基因的相对表达水平(见表1)。

表1 α7-nAChR和GAPDH的上下游引物
1.3 统计学方法采用SPSS 23.0进行统计学分析,正态分布计量资料用x±s表示,偏态分布计量资料以中位数(四分位数)[M(QL,QU)]表示,正态分布计量资料两样本均数比较采用独立样本t检验,偏态分布计量资料的组间比较使用两独立样本秩和检验,两组以上样本比较进行单因素方差分析,进一步两两比较采用LSD检验。α=0.05为检验水准。
2 结果
2.1 小鼠海马组织α7-nAChR蛋白检测慢性睡眠剥夺7 d后,SD组小鼠海马组织α7-nAChR蛋白表达量(0.813±0.055)较 CC 组(1.249±0.118)明显减少,差异具有统计学差异(P=0.001);慢性睡眠剥夺后腹腔注射PHA-543613后α7-nAChR蛋白表达量(1.065±0.047)较 SD 组(0.813±0.055)升高,差异具有统计学差异(P=0.037)(图 1,表 2)。

表2 三组小鼠海马组织α7-nAChR表达量比较(x±s)
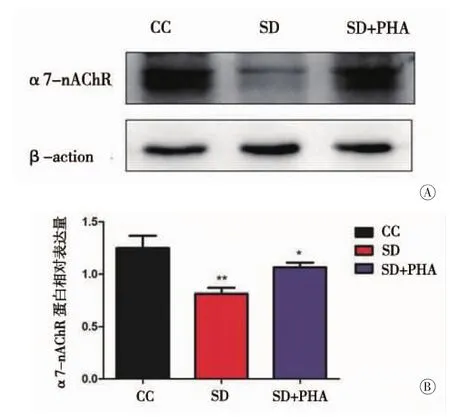
图1 三组小鼠海马组织α7-nAChR检测结果及量化比较(n=6) A:蛋白印迹法检测各组小鼠海马α7-nAChR蛋白表达;B:α7-nAChR/β-action灰度值的比较,β-action为内参
2.2 小鼠海马组织α7-nAChR mRNA表达的比较慢性睡眠剥夺 7 d后的海马组织α7-nAChR mRNA 表达量(0.930±0.150)较 CC 组(1.318±0.045)降低,差异具有统计学意义(P=0.038);与SD组比较,腹腔注射PHA-543613后α7-nAChR mRNA 表达量(1.524±0.134)升高,差异均具有统计学意义(P=0.002)(图 2,表 3)。

表3 三组小鼠海马组织α7-nAChR的mRNA表达量比较

图2 三组小鼠海马组织α7-nAChR的mRNA表达的量化比较(n=6)
2.3 α7-nAChR免疫荧光检测及其在星形胶质细胞表面的表达慢性睡眠剥夺后海马组织星形胶质细胞 α7-nAChR 的表达(1.533±0.186)较 CC 组(3.142±0.218)显著减少,SD+腹腔注射 PHA-543613组海马组织星形胶质细胞α7-nAChR的表达(2.650±0.479)较 SD 组(1.533±0.186)增多,SD组与CC组、SD+PHA组与SD组比较,差异均具有统计学意义(P<0.01、P=0.027)。

图3 免疫荧光染色法检测小鼠海马组织α7-nAChR阳性细胞及星形胶质细胞表面α7-nAChR的表达 A、B、C为CC组,D、E、F为 SD 组,G、H、I为 SD+PHA-543613组;A 为 B、C 融合图,D为 E、F 融合图,G 为 H、I融合图;B、E、H 为红色荧光标记的α7-nAChR,C、F、I为绿色荧光标记的星形胶质细胞
2.4 小鼠海马组织小胶质细胞表面α7-nAChR表达的检测慢性睡眠剥夺后海马组织小胶质细胞 α7-nAChR 的表达(1.536±0.337)较 CC 组(1.714±0.236) 减少,SD+腹腔注射 PHA-543613组海马组织小胶质细胞α7-nAChR的表达(2.340±0.189)较 SD 组(1.536±0.337)增多,SD 组与 CC组、SD+PHA组与SD组比较,差异均无统计学意义(见图 4)。

图4 免疫荧光染色法检测小鼠海马组织小胶质细胞表面α7-nAChR 的表达。A、B、C 为 CC 组,D、E、F为 SD 组,G、H、I为SD+PHA-543613组;A为B、C融合图,D为E、F融合图,G为H、I融合图;B、E、H 为红色荧光标记的 α7-nAChR,C、F、I为绿色荧光标记的小胶质细胞
3 讨论
本研究首次探讨慢性睡眠剥夺对小鼠海马组织α7-nAChR表达的影响,实验结果显示慢性睡眠剥夺7 d后小鼠海马区α7-nAChR基因与蛋白表达减少。中枢神经系统内,α7-nAChR主要分布于海马、丘脑、额叶及皮层等与学习记忆、情感相关的重要脑区[1],FREEDMAN等[9]和JESSEN等[10]发现AD和精神分裂症患者脑组织内α7-nAChR表达减少。这与本研究结果基本一致,研究结果提示海马组织α7-nAChR是中枢神经系统损伤的敏感指标。
α7-nAChR具有神经保护作用,体内和体外实验均发现,α7-nAChR激动剂通过抑制淀粉样蛋白、谷氨酸、乙醇等代谢毒物的生成发挥神经保护作用[11-14]。研究也发现α7-nAChR参与胆碱能系统与γ-氨基丁酸系统之间的相互作用,进而引起AD早期认知功能的下降[3],CONCEPCION等[15]认为α7-nAChR可能是炎症反应与神经退行性疾病之间联系的桥梁,因此是多种神经变性病的可能治疗靶点。在精神分裂症动物模型中,使用α7-nAChR激动剂后认知功能改善[16],加兰他敏也通过激活α7-nAChR改善AD大鼠的认知功能[17],与既往研究结果相同,在慢性睡眠剥夺后腹腔注射α7-nAChR激动剂PHA-543613后小鼠海马区α7-nAChR基因与蛋白表达增多,但α7-nAChR是否以及通过何种机制参与睡眠剥夺后认知功能损伤仍需要进一步研究。
小胶质细胞和星形胶质细胞是中枢神经系统主要的免疫炎性细胞,具有抗原呈递和产生促炎或抗炎因子等多种功能[18-19]。越来越多的研究发现小胶质细胞与神经变性病密切相关[20],睡眠剥夺模型中,BELLESI等[21]也发现急性睡眠剥夺和慢性睡眠限制后海马区星形胶质细胞和小胶质细胞被激活。α7-nAChR主要表达于神经元表面[22-23],非神经元细胞如星形胶质细胞[24-25]、小胶质细胞[26-27]、NK细胞及内皮细胞等[28]也有不同密度α7-nAChR的表达。本实验结果发现,正常情况下小鼠海马区的小胶质细胞和星形胶质细胞表面均有α7-nAChR的表达,星形胶质细胞表面 α7-nAChR的表达更多。α7nAChR受体在调节巨噬细胞、小胶质细胞的炎症反应中有重要作用,激活α7-nAChR能促进小胶质细胞由M1型向M2型转变[29],进而抑制炎性因子的释放;星形胶质细胞表面的α7-nAChR通过激活Nrf 2信号通路、抑制NF-κB信号通路而发挥抗炎作用[30]。慢性睡眠剥夺7 d后,海马区星形胶质细胞和小胶质细胞表面的α7-nAChR表达亦减少,睡眠剥夺后腹腔注射α7-nAChR激动剂PHA-543613后星形胶质细胞和小胶质细胞表面α7-nAChR表达增多。基于人群的研究发现5晚的睡眠限制可使外周血中促炎因子释放增多,而睡眠恢复后血中促炎因子仍持续存在[31],说明睡眠剥夺可以诱导一系列免疫炎症反应,因此小胶质细胞和星形胶质细胞表面的α7-nAChR可能成为限制睡眠剥夺后海马炎症和氧化应激的潜在靶点,未来将进一步深入探讨胶质细胞表面α7-nAChR在睡眠剥夺中的具体作用机制。
综上所述,本研究表明慢性睡眠剥夺抑制海马组织α7-nAChR的表达,降低胶质细胞表面α7-nAChR的表达,海马组织胶质细胞α7-nAChR的减少可能是慢性睡眠剥夺后认知功能下降的危险因素,鉴于本研究样本数量较少,α7-nAChR在慢性睡眠剥夺的具体机制还需进一步研究。
