台湾假单胞菌的分离、鉴定及其对难溶性磷酸盐的溶解特性
2019-10-11李凌凌孙妤婕杨欣月陈容彬左振宇杨忠华
李凌凌, 杨 进, 孙妤婕, 杨欣月, 陈容彬, 左振宇,2, 杨忠华,2
(1.武汉科技大学化学与化工学院,湖北 武汉,430081;2.武汉科技大学煤转化与新型炭材料湖北省重点实验室,湖北 武汉,430081)
磷元素是植物生长过程中不可缺少的重要营养元素之一。目前农业上主要通过施用化学肥料来满足植物对磷的需求,但由于土壤的固定作用,施入土壤中的可溶性磷肥会转化为植物难以吸收利用的无效态磷,导致作物对磷肥的利用率有限[1]。此外,由于耕地长期施用磷肥,其大部分无法被农作物利用而在土壤中沉积,造成土壤板结、退化及水体污染,对生态环境带来严重危害[2]。
溶磷微生物可以将土壤中富集的难溶性磷溶解为可供植物吸收的可溶性磷,从而促进植物生长发育,增加农作物产量,改良农田土质并减少化学磷肥的投入,而选育出高效且遗传性能稳定的溶磷微生物是实现微生物肥料活化土壤磷素的前提条件。溶磷微生物的筛选及溶磷能力的提升、微生物肥料的制备及使用效果等一直是国内外学者的重要研究方向。目前,研究人员已筛选出大量的溶磷微生物[3-6],如溶磷细菌(芽孢杆菌属、假单胞菌属、土壤杆菌属和欧文氏菌属等)、溶磷放线菌(小单胞菌属及链霉菌属等)、溶磷真菌(根霉属、枝孢霉属、曲霉属和青霉属等)。
溶磷菌普遍散布的场合有植物根际、土壤、水体等,而且溶磷菌的分布表现出根际效应,在玉米、冬小麦等作物根际附近的溶磷菌数量要明显高于非根际土壤中的数量[7],因此筛选溶磷微生物时,植物根际是一种潜在的溶磷菌优质种质资源库。本试验从武汉市园林科学研究所里的植物根际土壤样品中分离出溶磷菌,进行鉴定并研究该菌对难溶性磷酸盐的溶解能力,以期为有效利用土壤中的磷和降低农业生产成本提供理论依据和技术指导。
1 材料与方法
1.1 材料
1.1.1 培养基
NBRIP培养基:Ca3(PO4)25.0 g,葡萄糖10.0 g,(NH4)2SO40.15 g,KCl 0.2 g,MgCl2·6H2O 0.5 g,MgSO4·7H2O 0.25 g,加蒸馏水定容至1000 mL,pH值调至 7.0,用于培养溶磷细菌[8]。
LB培养基:用于观察溶磷菌的菌落特征、液体培养特征、运动性及与氧气的关系[9]。
1.1.2 酶和化学试剂
通用型柱式基因组DNA提取试剂盒、DNA Marker和2×ES Taq MasterMix(含染料)为康为世纪生物科技有限公司产品;PCR产物纯化回收试剂盒(Cycle-pure kit)为美国OMEGA公司产品;引物合成和测序工作由武汉擎科创新生物科技有限公司完成。
1.2 方法
1.2.1 溶磷菌的筛选
取5 g由武汉市园林科学研究所的车前草根际处采集的土壤样品(采集深度5~15 cm),加入到100 mL 的NBRIP液体培养基中,置于30 ℃、150 r/min的恒温摇床中培养3~5 d。吸取稀释度分别为10-4、10-5、10-6的富集培养液0.1 mL,涂布于NBRIP固体培养基中,置于30 ℃恒温生化培养箱中,培养72 h后,从平板上挑选具有明显溶磷圈的菌落,采用平板划线分离法进行菌种纯化。每次划线纯化时,用接种环在上次划线的末端有较明显溶磷圈的部分挑取出菌,在新的NBRIP固体培养基上划线。如此重复3~4次,直至显微镜中观察到形态、大小基本一致的细菌。
1.2.2 溶磷菌溶磷能力的测定
(1)增溶指数(solubilization index, SI)
纯化好的溶磷菌稀释涂布接种到NBRIP固体培养基中,于30 ℃培养箱中倒置培养5 d后测量菌株的溶磷圈直径(D)和菌落直径(d),根据SI=D/d计算细菌在NBRIP平板上的SI值[10]。
(2)培养液中可溶性磷含量
采用磷钒钼黄比色法测定培养液中可溶磷的含量[11]。
1.2.3 溶磷菌的鉴定
(1)菌株的个体形态观察
参照文献[9]对溶磷菌进行革兰氏染色。
(2)菌株的生理生化特征
各项生理生化指标的检测均按文献[9]进行操作。
(3)系统发育树的构建
按照通用型柱式基因组DNA提取试剂盒说明书,提取所选菌株的基因组DNA。菌株的16S rDNA的PCR扩增、回收、测序和系统发育树的构建参照文献[12]进行。
1.2.4 溶磷菌对难溶性磷酸盐的溶解条件优化
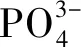
(1)
(2)
式中:m为磷酸根离子占难溶性磷酸盐的质量比。
1.2.5 生长量、pH及磷溶出量的变化曲线绘制
分别取1 mL处于对数期的菌液接入100 mL的NBRIP液体培养基及优化后的NBRIP液体培养基中,设置3组平行实验,放入30 ℃、150 r/min的恒温摇床中培养。每隔一段时间取一次样,测定pH值、OD420和OD600,据此绘制菌液的pH、磷的溶出量和生长量随时间变化曲线。
1.2.6 菌株对不同难溶性磷酸盐的溶解实验
取1 mL处于对数期的菌液接入100 mL含5.0 g/L磷源(分别为Ca3(PO4)2、FePO4、AlPO4、CaHPO4、羟基磷灰石、磷矿粉)的优化后NBRIP液体培养基中,在30 ℃、150 r/min的恒温摇床中培养,48 h取样测定pH值和OD420,72 h取样测定OD600。
1.2.7 培养液中的有机酸成分分析
菌株P2以Ca3(PO4)2、磷矿粉、羟基磷灰石和CaHPO4为磷源的培养液分别经离心收集(8000 r/min,15 min)及过滤(0.45 μm的滤膜)后获得上清液,使用高效液相色谱仪(安捷伦1100)分析其中的有机酸成分,色谱柱采用的是SB-C18反相柱,流动相为3%甲醇-0.01 mol/L K2HPO4(调至pH=2.86),流速0.5 mL/min,柱温30 ℃,检测波长215 nm,进样体积5 μL[12]。
1.2.8 菌株对土壤有效磷含量的影响
采集武汉科技大学校区边的土壤,采样深度5~20 cm,采集后除杂。将对数期的菌液P2(对照组为10 mL灭活菌液)按照10%的比例与供试土壤混合[13],自然条件下静置,72 h后采用NaHCO3浸提-钼锑抗比色法测定土壤中有效磷的含量。
2 结果与分析
2.1溶磷菌的筛选
以稀释涂布的方式将分离纯化的菌株接种于NBRIP固体培养基上,5 d后,测定菌落的直径和溶磷圈直径。根据溶磷圈大小筛选到3株具有溶磷能力的菌株,这些菌株在传代过程中能够稳定地保持溶磷性能。其中,菌株P2的菌落直径d=2.3 mm,溶磷圈直径D=4.8 mm(见图1),计算得SI=2.08,为同一批次中的最大值,故选择P2为本研究的出发菌株。
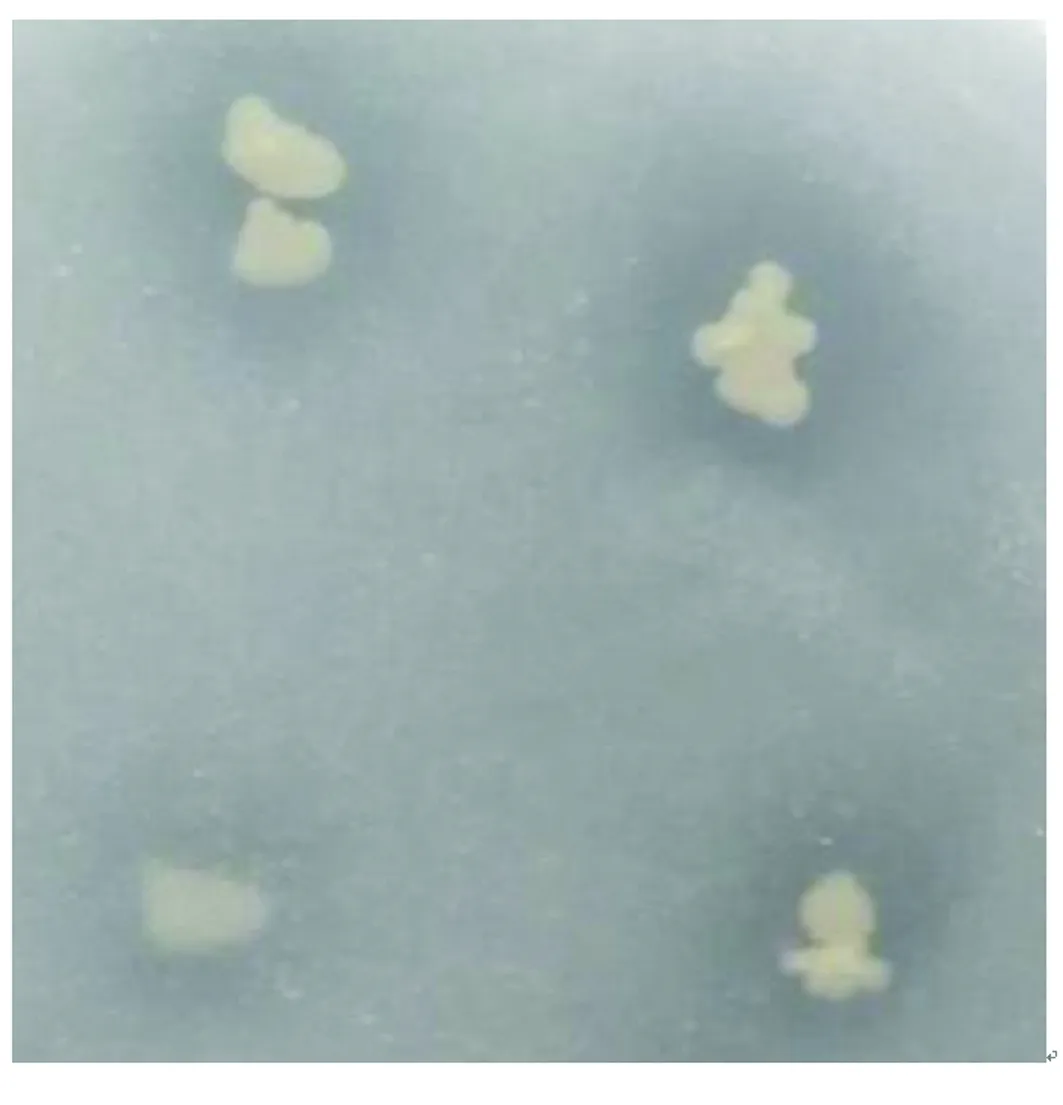
图1 菌株P2的溶磷圈
2.2 溶磷菌P2的鉴定
2.2.1 菌株P2的个体形态特征
在光学显微镜下,菌株P2为可运动且不产芽孢的球杆状细菌,其革兰氏染色结果呈阴性,如图2所示。
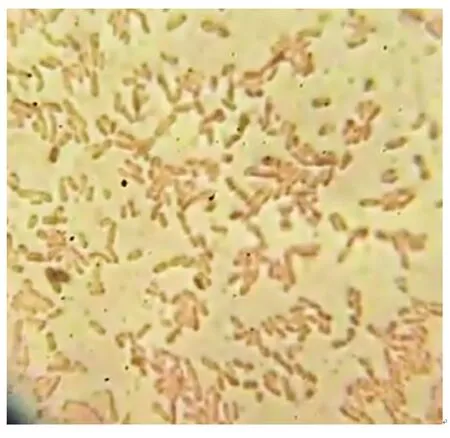
图2 菌株P2的革兰氏染色结果
2.2.2 菌株P2的菌落特征
菌株P2在LB固体培养基上培养2 d后,形成圆形的中心凸起、边缘不规则、光滑且湿润的菌落,颜色为乳黄色且不透明。在LB半固体培养基中的穿刺试验结果显示,菌株P2自上到下在穿刺部位的四周呈云雾状均匀生长,由此可知P2菌兼性好氧,可运动。
2.2.3 菌株P2的生理生化特征
如表1所示,菌株P2的接触酶、氧化酶及精氨酸双解酶为阳性。菌株P2能产生胞外的淀粉酶和脂肪酶,但不能产生胞外的明胶酶及尿素酶。菌株P2可以水解培养基中的含硫氨基酸生成H2S,但不能还原硝酸盐生成亚硝酸盐。IMViC试验结果显示,菌株P2的柠檬酸试验呈阳性反应,即可以利用柠檬酸盐产生碱性碳酸盐,使培养基pH值升高从而变成蓝色;但伏普反应为阴性,即细菌不能发酵葡萄糖生成乙酰甲基甲醇,甲基红反应呈阴性,且菌株P2也不能产生色氨酸酶分解色氨酸产生吲哚。在糖酵解试验中,菌株P2可以发酵葡萄糖产酸但不产气,不能利用蔗糖和乳糖产酸产气。另外,在NBRIP液体培养基中,菌株P2在 30 ℃下生长状况最好,40 ℃下可以生长,4 ℃条件下,在光学显微镜中未观察到菌体P2生长的迹象。菌体P2最适生长的pH值为7.0,当pH<4.0和pH>10.0时,菌体P2未见生长。
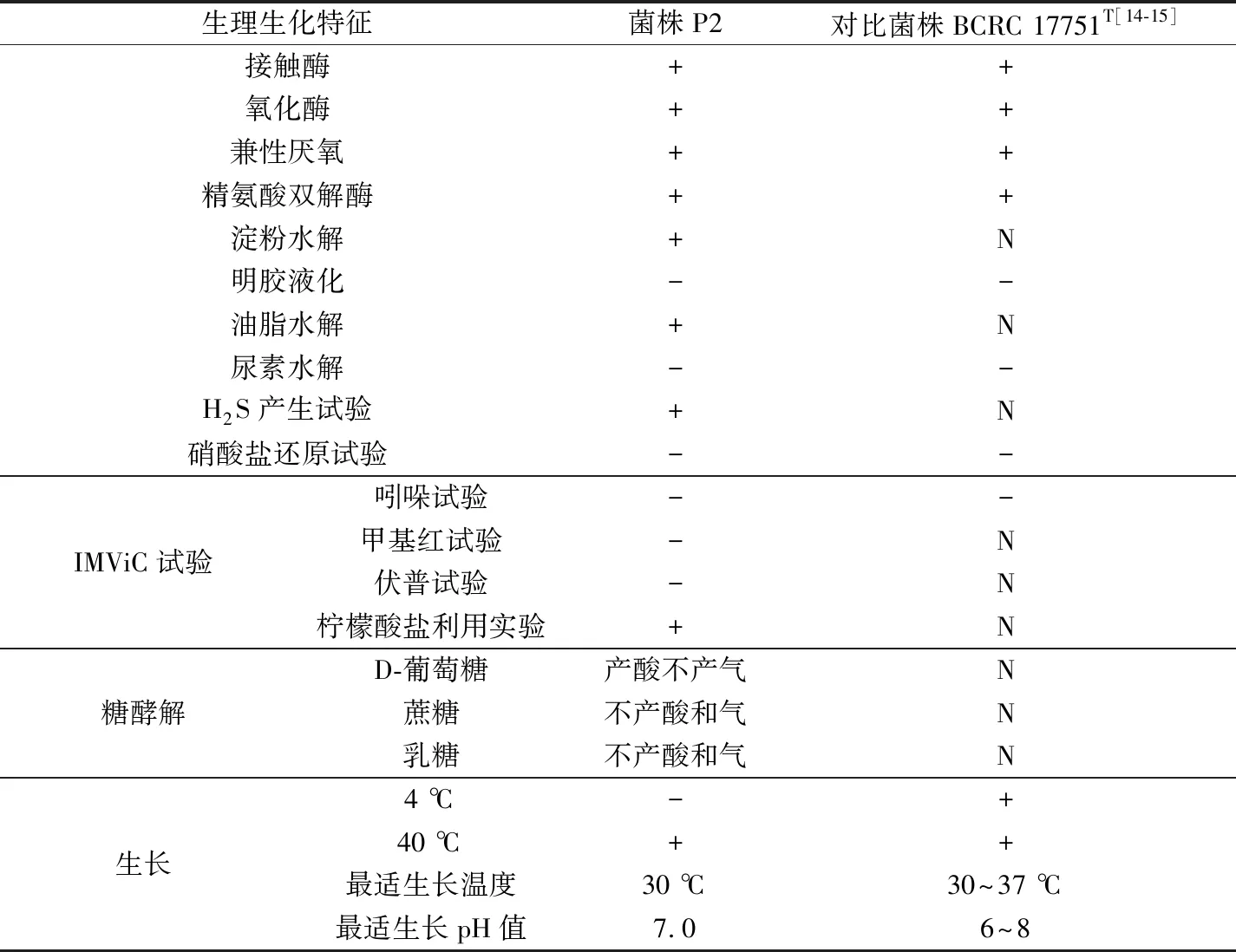
表1 菌株P2的生理生化特征
注:+代表阳性结果;-代表阴性结果;N代表未确定。
2.2.4 系统发育树的构建
以菌株P2提取出的基因组DNA为模板,进行16S rDNA的PCR扩增,对获得的PCR产物进行1.0%琼脂糖凝胶电泳,结果如图3(a)所示,可见PCR产物位于1000 bp和2000 bp之间,此点与目标序列长度大约为1500 bp相符。将PCR扩增产物切胶回收获得的产物(电泳结果见图3(b))送交武汉擎科创新生物科技有限公司进行测序,获得一段长为1436 bp的核苷酸序列,将此序列提交至Genbank,获得的登录号为MK372541。利用NCBI数据库提供的BlastN功能进行核苷酸比对,结果显示菌株P2与Pseudomonasputida、Pseudomonasmonteilii及Pseudomonastaiwanensis的16S rDNA基因序列一致性均高达99%。根据16S rDNA序列的相似性,利用Clustal Omega和Mega 6软件构建系统发育树(如图4所示),可见菌株P2在系统发育上最接近于台湾假单胞菌(Pseudomonastaiwanesis)。
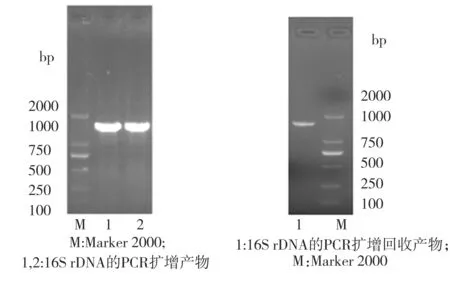
(a) 16S rDNA PCR扩增产物 (b) 回收产物
图3 菌株P2的16S rDNA PCR扩增及回收产物的琼脂糖凝胶电泳检测结果
Fig.3 Electrophoretogram of 16S rDNA PCR amplification and purified product from Strain P2
台湾假单胞菌[14-15]是球杆状革兰氏阴性菌,可以运动,但不能产生芽孢,在TSA培养基上可以长出湿润的乳黄色圆形菌落。它们可以在5~42 ℃条件下生长,但是不能在更高的温度(45~60 ℃)下生长,最适生长温度为30~37 ℃。菌株可以在pH=4~9的条件下生长,最适生长pH值为6~8。菌株的接触酶、氧化酶和精氨酸双解酶检测结果均为阳性,但明胶液化反应和脲酶检测均为阴性。该菌不能产生吲哚,也不能将硝酸盐还原成亚硝酸盐及进行反硝化作用。文献[14-15]中描述的台湾假单胞菌菌株BCRC 17751T(即菌株CMST和DSM 21245T)的这些特征与菌株P2的形态学、生理生化特征都很接近。综合16S rDNA鉴定结果,菌株P2归属于台湾假单胞菌(P.taiwanensis)。
2.3 菌株P2生长及溶磷条件的单因素优化
2.3.1 碳源
溶磷菌P2在不同种类碳源中的生长量、菌液pH值和溶磷量如图5(a)所示。以葡萄糖、甘露糖、淀粉、乙酸钠、柠檬酸钠、乙酸作为碳源时,溶磷菌P2的生长量超出对照组(不接种的相应培养基)二倍左右,生长状况良好,其中以淀粉为碳源的生长状况最好;菌株不能以酪氨酸、甘露醇为碳源生长。以葡萄糖、甘露糖、乙酸、草酸为碳源时,溶磷菌P2的溶磷率较高,其中以葡萄糖为碳源时溶磷量最高,为938.14 mg/L,此时对应的溶磷率为30.61%。当以最利于溶磷菌生长的淀粉作碳源时,却并没有达到预期的高溶磷率,推测是由于以淀粉为碳源时溶磷菌产酸量不高,这从图5(a)中pH值可以看出。另外,由溶磷菌P2在不同种类碳源中的pH变化情况可知,溶磷率与pH值存在一定的负相关性。
2.3.2 氮源
溶磷菌P2在不同种类氮源中的生长量、菌液pH值和溶磷量如图5(b)所示。以尿素为氮源时,溶磷菌P2的生长浓度最高,其次是以NH4Cl、(NH4)2SO4、草酸铵为氮源,而菌株P2在酵母抽提物中的生长浓度最低。以尿素、硝酸钾、草酸铵、氯化铵、硝酸铵、硫酸铵为氮源时,溶磷菌P2的生长量超出对照组(不接种的相应培养基)二倍左右,生长状况良好,但以蛋白胨和酵母抽提物为氮源时菌体的生长量较低。总体来说,与有机氮源比,菌体在无机氮源中的生长状况较优。当以氯化铵为氮源时,菌株的溶磷量最高,达到1131.44 mg/L,对应的溶磷率为36.92%,其次为(NH4)2SO4、草酸铵,这与生长状况基本吻合。但是,最适生长的尿素作氮源时的溶磷率不是很高,可能与尿素水解生成氨有关。对于所研究的几种氮源,溶磷菌P2在氯化铵中pH值最低,且溶磷率与pH值存在负相关性。
2.3.3 碳源浓度
溶磷菌P2在初始碳源(葡萄糖)浓度分别为1、5、10、25、50 g/L条件下的生长量、菌液pH值和溶磷量如图5(c)所示。当培养基中初始碳源浓度低于25 g/L时,随着该浓度的增加,溶磷菌P2的生长量也逐渐增加。当初始碳源浓度超过25 g/L,达到50 g/L时,溶磷菌P2的生长量大幅下降。另外,不同初始碳源浓度下的溶磷量变化趋势与生长状况一致,最适溶磷的初始碳源浓度为25 g/L,此时溶磷量为1005.16 mg/L,对应的溶磷率为32.80%。培养基初始碳源浓度为25 g/L时的pH值最低,此时的溶磷率最高。

图4 根据菌株P2的16S rDNA基因序列构建的系统发育树
2.3.4 氮源浓度
溶磷菌P2在初始氮源(NH4Cl)浓度分别为

1—葡萄糖;2—蔗糖;3—木糖;4—麦芽糖;5—甘露糖;6—淀粉;7—酪氨酸;8—甘露醇;9—丁二酸;10—甘油;11—柠檬酸;12—山梨醇;13—肌醇;14—鼠李糖;15—乙酸钠;16—柠檬酸钠;17—乙酸;18—草酸;19—草酸铵;
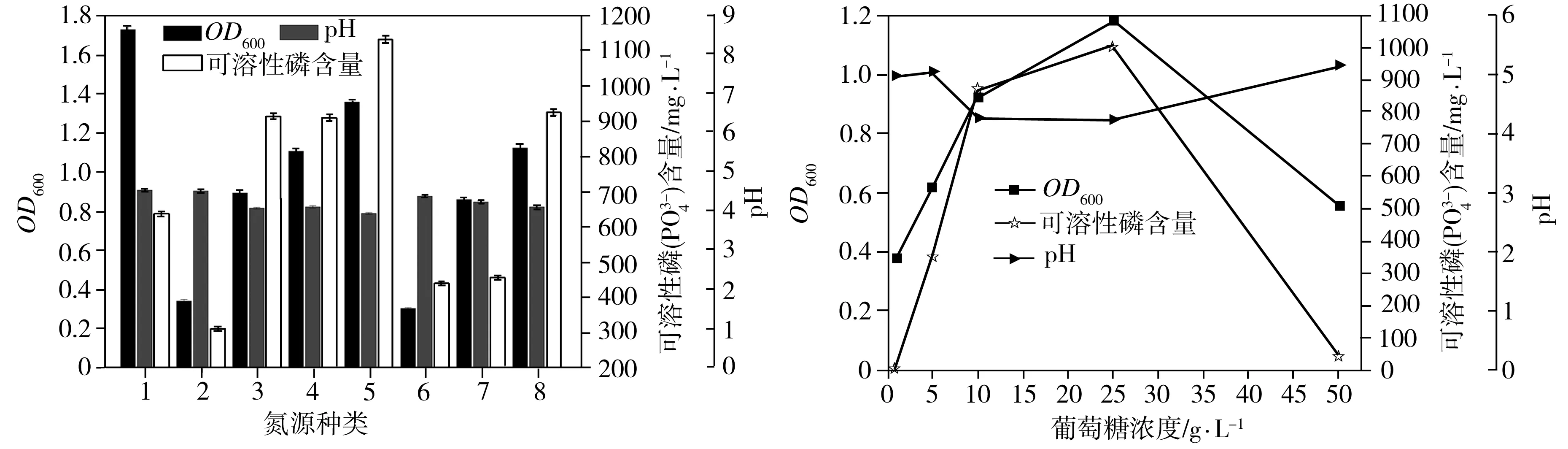
1—尿素;2—蛋白胨;3—KNO3;4—草酸铵;5—NH4Cl
(c)初始碳源(葡萄糖)浓度
6—酵母抽提物;7—NH4NO3;8—(NH4)2SO4
(b)氮源种类
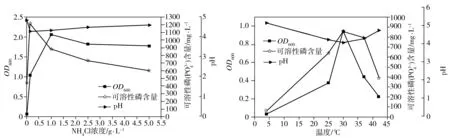
(d)初始氮源(氯化铵)浓度 (e)培养温度

(f)培养基初始pH值 (g)恒温摇床转速
图5 菌株P2的生长及溶磷条件的单因素优化实验结果
Fig.5 Single-factor optimization results of growth and phosphorous-solubilizing conditions of Strain P2
2.3.5 培养温度
溶磷菌P2在培养温度分别为4、25、30、37、42 ℃条件下的生长量、菌液pH值和溶磷量如图5(e)所示。溶磷菌P2的最适生长温度为30 ℃。当培养温度高于30 ℃时,随着温度升高,溶磷菌P2的生长量迅速降低。溶磷菌P2的最适溶磷温度也是30 ℃,此时溶磷量为855.67 mg/L,对应的溶磷率为27.92%。当培养温度为30 ℃时的pH值最低,同样存在pH值与溶磷率的负相关性。
2.3.6 培养基初始pH值
溶磷菌P2在培养基初始pH值为 3~12时的生长量、菌液pH值和溶磷量如图5(f)所示。培养基初始pH值过低不利于菌株P2的生长及溶磷,最适生长的初始pH值为7。但是,最适合P2溶解磷酸钙的pH值为5,此时溶磷量为1092.78 mg/L,对应的溶磷率为35.66%。当培养基初始pH值高于10时,P2的溶磷率迅速降低(此时生长量也很低),这是因为溶磷作为一个耗酸过程,当P2产生的酸用来中和环境中的碱时,用于溶磷的酸量就会减少,从而导致溶磷率下降。另外,除初始pH值为12的菌液以外,其他菌液的最终pH值都在4左右,说明此菌种有一定的环境改造能力,可通过自身的代谢过程调节环境pH值。
2.3.7 恒温摇床转速
溶磷菌P2在恒温摇床振荡器速率为0、100、150、200 r/min条件下的生长量、菌液pH值和溶磷量如图5(g)所示。随着振荡速率的升高,溶磷菌P2的生长量和溶磷量均先增大再减少。最适于P2菌生长和溶磷的摇床转速均为150 r/min,此时溶磷量为855.67 mg/L,对应的溶磷率为27.92%。静置时,菌体的生长停滞,未见pH值和溶磷率的明显变化,可能是由于此时磷酸钙沉降在瓶底,且假单胞菌为好氧微生物,静置时菌体很难获得足够的氧气和磷源生长。当振荡速率较低时,培养液中的溶氧浓度不足,导致菌株的好氧生长受到抑制,而当振荡速率较高时,磷酸钙颗粒在振荡过程中会对菌体产生较大的剪切力,从而影响溶磷率。
2.4 菌株P2的生长量及溶磷量随时间的变化
经单因素优化实验,得出最适合P2溶磷的条件为:碳源为葡萄糖、氮源为NH4Cl、初始碳源浓度25 g/L、初始氮源浓度0.15 g/L、培养温度30 ℃、培养液初始pH=5、恒温摇床转速150 r/min。分别配制基础NBRIP培养基和优化后的NBRIP培养基(Ca3(PO4)25.0 g/L,葡萄糖25.0 g/L,NH4Cl 0.15 g/L,KCl 0.2 g/L,MgCl2·6H2O 0.5 g/L,MgSO4·7H2O 0.25 g/L,pH值调至 5.0),再分别按照1%的接种量接入对数期的菌液到两种培养基中,放入30 ℃、150 r/min的恒温摇床中培养。每隔一段时间取样,根据测量值绘制菌株P2在条件优化前后的生长量、菌液pH值和溶磷量随着时间变化曲线(见图6)。从图6(a)可以看出,条件优化前和优化后,菌株P2的生长趋势基本一致:0~18 h为延滞期,18~72 h为对数生长期,72 ~120 h为稳定期,其中在96 h后生长量达到顶峰,培养120 h后进入衰亡期。从图6(b)可以看出,无论是条件优化前还是优化后,从接种开始,菌液的pH值均是逐渐下降,直到18 h后,菌液pH值开始稳定。推测是由于菌体溶解Ca3(PO4)2是一个耗酸的过程,同时菌体发酵葡萄糖产酸,在前18 h产酸量远远大于耗酸量,pH值迅速降低,但当菌体生长进入对数期后,产酸与耗酸达到平衡,pH值基本保持稳定。从图6(c)中可以看出,无论是条件优化前还是优化后,菌株P2培养至48 h后,培养基中可溶性磷含量趋于稳定,优化前最大溶磷率为29.02%(对应的溶磷量为889.18 mg/L),优化后的最大溶磷率为41.37%(溶磷量为1267.89 mg/L),约为优化前的1.43倍。
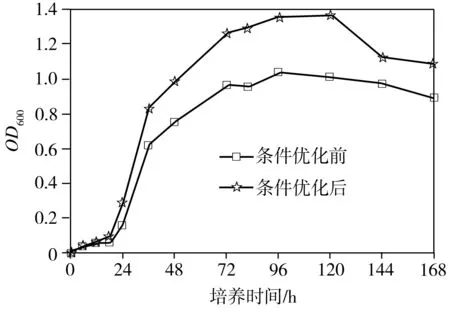
(a)生长量
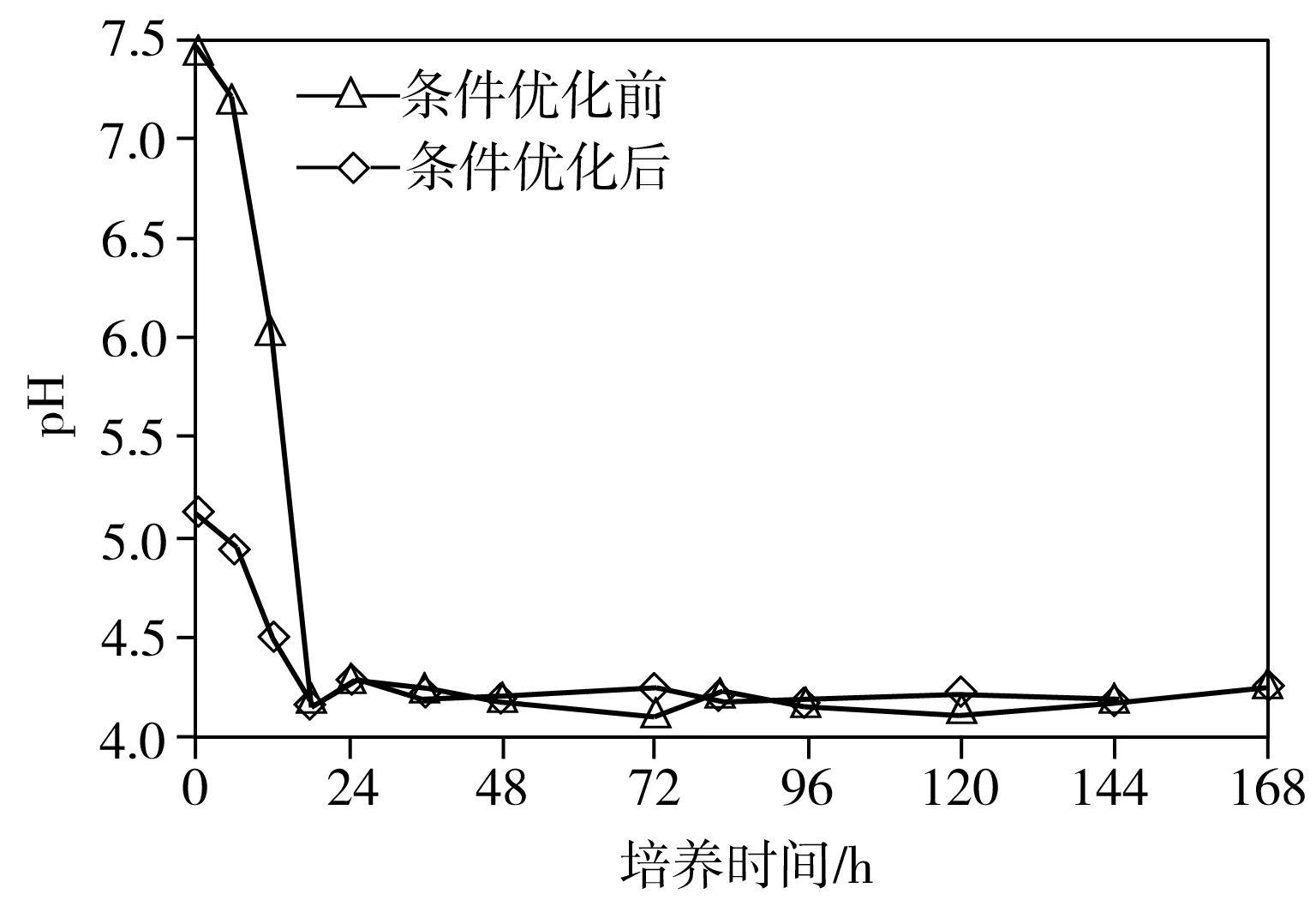
(b)pH值
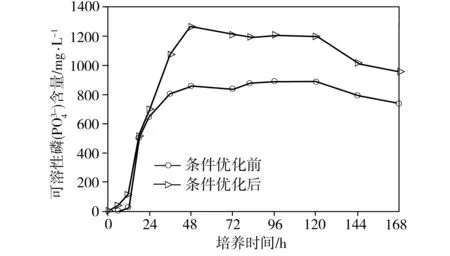
(c) 溶磷量
图6 条件优化前后菌株P2的生长量、pH值及溶磷量随时间变化曲线
Fig.6 Variations of growth, pH and phosphorous-solubilizing capacity of Strain P2 with time under optimized and non-optimized conditions
2.5 菌株P2对多种难溶性磷酸盐的溶解
难溶性磷会在石灰性土壤中转化为磷酸钙,在酸性土壤中转化成磷酸铁和磷酸铝,溶磷微生物可以将这些难溶性磷转化成植物可以吸收利用的磷。为进一步了解菌株P2适合施加的土壤类型,本文考察了溶磷菌P2在不同种类磷源中的生长量和溶磷率变化情况,结果如表2所示。以CaHPO4、羟基磷灰石、磷矿粉、Ca3(PO4)2作为磷源时,P2的生长状况较好,其中以CaHPO4为磷源的生长状况最好;以AlPO4、FePO4为磷源时,菌体生长较差。以CaHPO4、Ca3(PO4)2、羟基磷灰石作磷源时,溶磷菌P2的溶磷率较高,而其对磷矿粉、AlPO4、FePO4的溶磷率较低。Bashan等[16]认为,在筛选适合酸性土壤的溶磷微生物时,应以Al-P和Fe-P化合物作为磷源,而筛选适合碱性土壤的溶磷微生物时,应添加Ca-P型磷源。溶磷菌P2对CaHPO4、Ca3(PO4)2、羟基磷灰石的溶磷效果要优于对AlPO4、FePO4的溶磷效果,表明其更适合于施加到偏碱性土壤中。
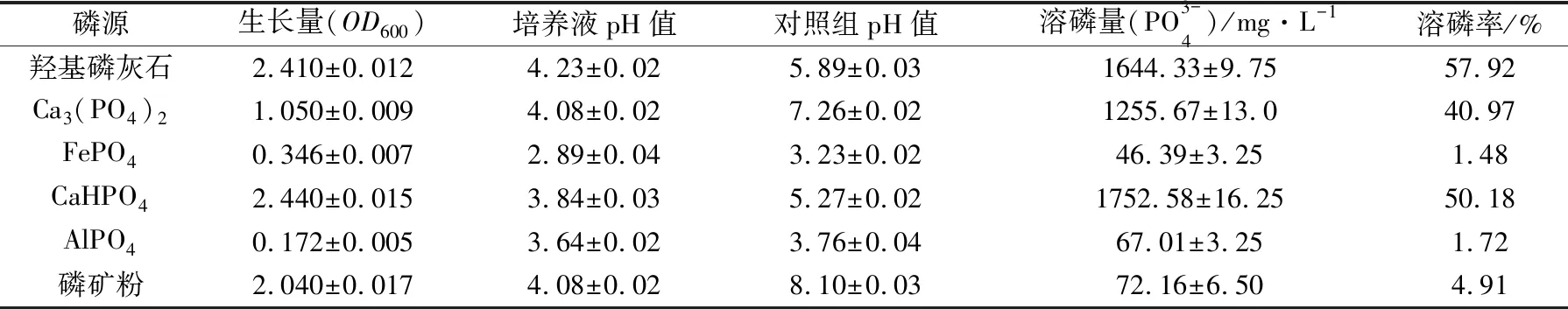
表2 菌株P2对不同难溶性磷酸盐的溶解实验结果
假单胞菌属是土壤中筛选出的主要溶磷微生物之一,很多研究报道都显示假单胞杆菌属菌株对难溶性磷酸盐具有较好的溶磷效果。孙珊等[17]筛选的一株假单胞菌属菌株GJT-1对磷酸钙和宜昌磷矿粉的溶磷量可分别达到224.51 mg/L和120.59 mg/L。刘辉等[18]筛选的一株荧光假单胞菌JW-JS1对磷酸钙的溶磷量最高可达到708.34 mg/L。郭莹等[19]研究的铜绿假单胞菌JM1对磷酸钙和磷酸铝的溶磷量分别为240.63 mg/L和92.73 mg/L。本研究筛选得到的台湾假单胞菌P2对这些难溶性磷酸盐的溶解能力与上述报道的数据相当,甚至更优。
2.6 菌株P2对难溶性磷酸盐的溶出液中有机酸分析
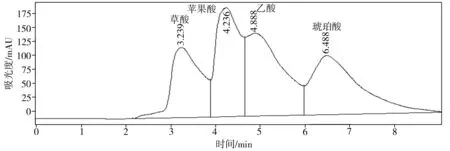
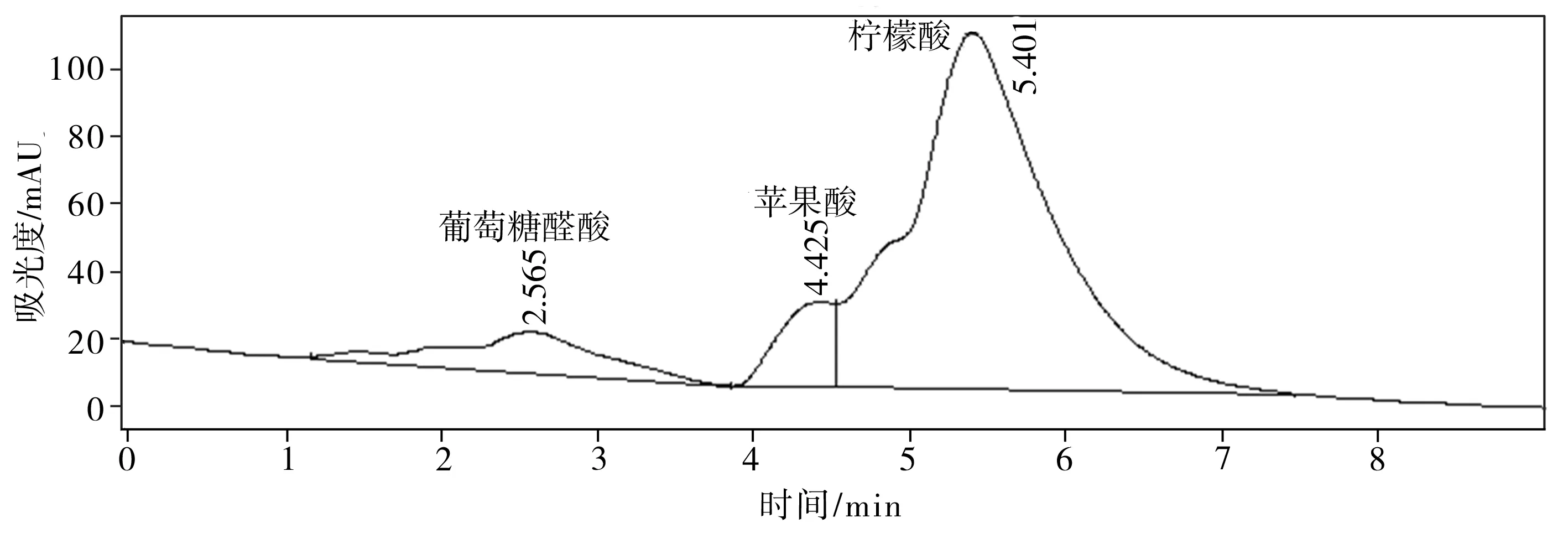
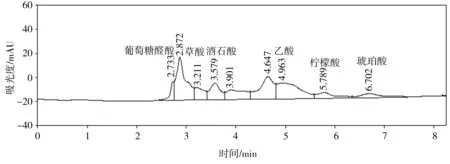
溶磷微生物溶解土壤中难溶性磷酸盐的机制与微生物分泌的有机酸有关。这些有机酸不仅可以降低环境的pH值,使得磷酸钙、磷酸铝、磷酸铁等溶解,而且能与难溶性磷酸盐中的铝、钙、铁、镁等金属离子螯合,释放出磷酸根离子[12,20-21]。通过高效液相色谱仪得出的菌株P2对难溶性磷酸盐的溶出液中有机酸分析结果如图7所示。比较以不同难溶性磷酸盐为磷源的培养液中总有机酸浓度(见表3),按浓度高低排序如下:羟基磷灰石>磷酸氢钙>磷酸钙>磷矿粉。
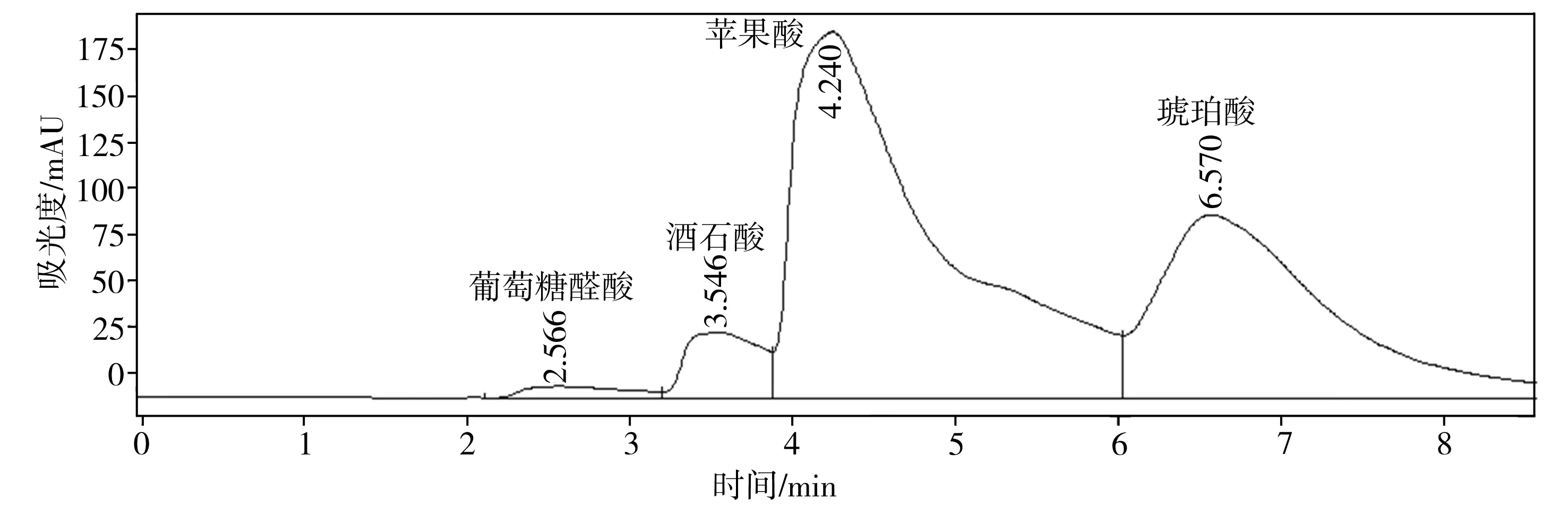
(a) 磷酸氢钙
(b) 羟基磷灰石
(c)磷酸钙
(d) 磷矿粉
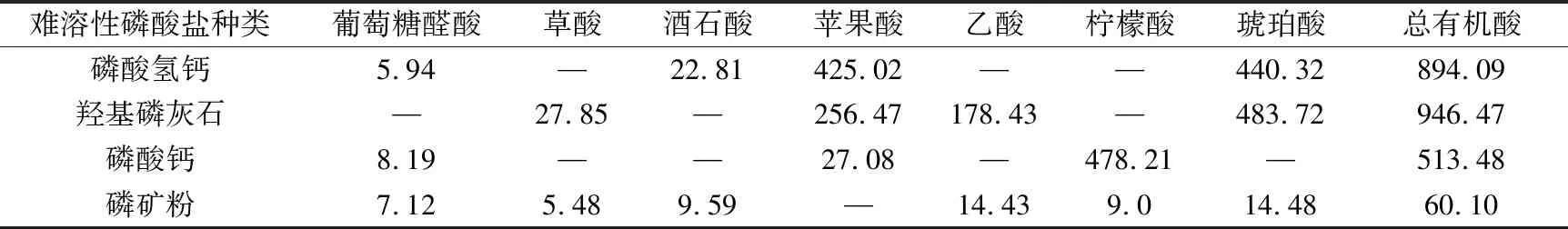
难溶性磷酸盐种类葡萄糖醛酸草酸酒石酸苹果酸乙酸柠檬酸琥珀酸总有机酸磷酸氢钙5.94—22.81425.02——440.32894.09羟基磷灰石—27.85—256.47178.43—483.72946.47磷酸钙8.19——27.08—478.21—513.48磷矿粉7.125.489.59—14.439.014.4860.10
对比表2和表3可知,磷的溶出率与总有机酸浓度之间总体存在正相关性,再次表明难溶性磷酸盐的溶解是一个依赖于酸的过程。
2.7 菌株P2对土壤有效磷含量的影响
为了检验菌株P2是否能够转化土壤中难溶性磷酸盐而改善土壤的供磷能力,将菌液按照10%的比例与供试土壤混合。经过3 d后,土壤中的有效磷含量从最初的8.63 mg/kg上升为12.66 mg/kg。由此可知,最初的土壤有效磷含量较低,属于低能力供磷水平,而施加菌株P2后,土壤有效磷含量提高,达到中等供磷水平,表明菌株P2能够改善土壤的供磷水平。
3 结论
(1)从武汉市园林科学研究所的车前草根际采集的土样中分离得到了一株具有溶磷能力的台湾假单胞菌P2。
(2)经单因素优化实验,得出最适合P2溶磷的条件为:碳源为葡萄糖、氮源为NH4Cl、初始碳源浓度25 g/L、初始氮源浓度0.15 g/L、培养温度30℃、培养液初始pH值为5、摇床转速150 r/min。优化条件后菌株P2的溶磷率可以达到41.37%,约为优化前的1.43倍。
(3)溶磷菌P2对多种难溶性磷酸盐均有一定的溶解能力,且对Ca3(PO4)2、CaHPO4、羟基磷灰石等Ca-P型磷源的溶磷效果要优于对AlPO4、FePO4的溶磷效果,即菌株P2适合于溶解石灰性土壤中的磷。
(4)磷的溶出是一个耗酸的过程,磷的溶出率与培养液中总有机酸浓度之间存在正相关性。
(5)菌株P2可以提高土壤的有效磷含量,明显改善土壤的供磷水平,具有良好的微生物肥料应用前景。
Isolation,identificationofPseudomonastaiwanesisanditsbio-solubilizationofinsolublephosphates
