胶质芽孢杆菌胞外多糖的发酵生产及结构鉴定
2019-10-10许桠楠史劲松许正宏
刘 爽,李 会,许桠楠,史劲松,许正宏
(1. 江南大学 药学院,江苏 无锡 214122; 2. 江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122)
细菌胞外多糖均具有独特的理化性质、流变学特性及其生理活性,使其在食品、医药、生物选矿及污水处理等领域具有潜在的应用前景[1]。不同种类细胞的胞外多糖之间,单糖及重复单元构成存在较大差异,相关的功能也存在差异,如:细菌产海藻酸钠可作为药物在体内运输的微载体,制作牙模等[2];肠膜状明串珠菌所分泌的葡聚糖可用作血浆替代物,用以治疗休克及失血[3];链球菌分泌的透明质酸可以用于眼科药品及人造皮肤[2];Martin等[4]发现某些细菌胞外多糖具有安眠效果,可以消除失眠人群对于化学药物的依赖;胶质芽孢杆菌胞外多糖不仅对改善免疫力具有显著作用[5],而且还具有解磷、解钾的功能[6]。细菌胞外多糖还可作为单糖的来源,如L-岩藻糖、L-鼠李糖等都来源于大分子多糖。这一类单糖化学合成或从自然界动植物资源中提取成本过高且产量不足,却有不可或缺的利用价值,因此,含有相应糖基的多糖则成为此类单糖的来源。如,肺炎克雷伯氏菌和阴沟肠杆菌所分泌的胞外多糖,其中均富含岩藻糖成分,可作为岩藻糖的来源[7]。
尽管细菌胞外多糖的种类繁多,但其生物合成途径却存在较多相似之处[8]。Lee等[9]研究发现,较高的通气量有利于多糖产量的提高及发酵液黏度的增大;Yang等[10]在发酵法制备芝多糖的研究中得到了相近的结果,较高的搅拌转速和通气速率对多糖的积累具有促进作用。多糖合成过程涉及一系列高耗能过程的氧化反应,为菌体自身生长及多糖合成提供所需能量。细菌胞外多糖的发酵过程对溶氧条件要求较高,在营养元素充足时,为菌体提供较好的溶氧条件将会促进多糖产量的提高[11]。目前对胶质芽孢杆菌胞外多糖的研究主要集中于菌株筛选及发酵工艺研究,但多糖产率较低,已报道的胶质芽孢杆菌胞外多糖发酵多采用分批发酵工艺,且产量较低,多数低于10 g/L[12-13]。细菌胞外多糖的合成分泌,将直接导致发酵体系的流变学特性发生改变。胞外多糖发酵过程中,发酵液黏度不断增大,将会表现出非牛顿流体的特性或假塑性流体的特点,当发酵液体现为非牛顿流体的特性时,发酵液中的菌体会形成不同的形态,多糖的性质也将会出现差异[1]。
本研究团队在前期工作中筛选获得一株胶质芽孢杆菌SM-01,在生长过程中该菌株能够产生一定含量的胞外多糖(BMPS)。为了进一步促进菌株生产胞外多糖的能力及应用范围,本文中,笔者重点研究搅拌转速和通气量对胶质芽孢杆菌产胞外多糖的影响,并进一步对所发酵生产的胞外多糖进行分离纯化,分析鉴定其多糖的结构组成,以期为胶质芽孢杆菌胞外多糖的工业化生产及应用开发奠定基础。
1 材料与方法
1.1 材料
胶质芽孢杆菌(Bacillusmucilaginosus)SM-01,保藏于中国菌种保藏中心,保藏号:CGMCC 5766。
斜面培养基(g/L): K2HPO4·3H2O 0.2、蔗糖 10.0、NaCl 0.2、尿素 0.1、CaCO35.0、MgSO4·7H2O 0.2、琼脂 20。
种子培养基(g/L):K2HPO4·3H2O 0.2、蔗糖 10.0、 NaCl 0.2、尿素 0.1、MgSO4·7H2O 0.2、CaCO35.0。
发酵培养基(g/L):K2HPO4·3H2O 0.2、葡萄糖 60.0、MgSO4·7H2O 0.6、NaCl 0.4、尿素 0.3、CaCO35.0。
以上培养基都需调节pH至 7.0~7.2。
1.2 方法
1.2.1 胶质芽孢杆菌的培养
种子液培养:将斜面保藏的菌种接种至种子培养基中,置于150 r/min、 30 ℃摇床上培养。
摇瓶发酵培养:将种子液以体积分数4%的接种量接至发酵培养基中,置于摇床上,在150 r/min、30 ℃条件下进行培养。
发酵罐培养:将种子液以体积分数4%接种量接至5 L发酵罐中,装液量3 L,培养温度30 ℃,通气量2 VVM(每分钟通气量与罐体实际料液体积比值),搅拌转速600 r/min(优化搅拌转速时换为其他搅拌转速)。
1.2.2 分析方法
菌体浓度测定:取1 mL发酵液,加入等体积2%盐酸,混匀,以除去残留的CaCO3。将原液稀释2~8倍后,分光光度计于600 nm波长处测定吸光值。
葡萄糖浓度测定:取2 mL发酵液,稀释100倍后,13 000 r/min离心10 min,取上清液,生物传感分析仪测定葡萄糖浓度。
粗多糖浓度测定:取15 mL发酵液,稀释1~10倍后,13 000 r/min离心20 min,以除去CaCO3及菌体。取上清液,加入3倍体积无水乙醇,混匀,4 ℃沉淀10 h后,7 000 r/min离心15 min,弃上清得粗多糖。将粗多糖真空干燥至恒质量,然后用分析天平称质量。
1.2.3 胶质芽孢杆菌胞外多糖粗提取工艺
以去离子水将发酵液稀释10倍,13 000 r/min离心20 min,以去除残留CaCO3及菌体。取上清液,旋转蒸发浓缩仪将上清液浓缩。向浓缩液中加入3倍体积无水乙醇,混合均匀,4 ℃沉淀10 h。沉淀结束后,7 000 r/min离心15 min,取沉淀,即为粗多糖。粗多糖溶于去离子水中,以Sevrage法除蛋白,蛋白除净后再次以无水乙醇沉淀获取多糖。粗多糖冷冻干燥,样品保存备用。
1.2.4 胶质芽孢杆菌胞外多糖分离纯化
1)粗多糖溶液制备。称取500 mg粗多糖,将其溶解于100 mL去离子水中,即为粗多糖溶液。
2)离子交换柱层析。安装层析柱,将处理好的阴离子交换填料DEAE-52缓慢加入层析柱,至填料离上端5 cm左右。以0.02 mol/L的NaCl溶液进行平衡,流速1.2 mL/min。层析柱平衡完毕,将5 mL粗多糖溶液加入层析柱,用重蒸水以1.2 mL/min流速洗脱,将过量粗多糖洗脱。洗脱后分别以浓度为0.1、0.25、0.5、0.75、1.0、1.25、1.5、1.75及2.0 mol/L的NaCl溶液进行分阶段洗脱,每一浓度洗脱5倍柱体积,流速1.2 mL/min。每隔2 min的洗脱液收集为1管,收集完毕以苯酚-H2SO4法测定多糖含量。
3)透析脱盐。按照洗脱曲线合并洗脱液,以旋转蒸发浓缩仪将洗脱液浓缩。浓缩液置于透析袋中,先以流水透析48 h,然后以去离子水透析48 h,每隔2 h将去离子水更换1次。透析结束后将多糖溶液浓缩,然后加入3倍体积无水乙醇,于4 ℃沉淀10 h。7 000 r/min离心15 min,获取沉淀冷冻干燥即为纯BMPS。
1.2.5 胶质芽孢杆菌胞外多糖纯度检验
1)蛋白含量测定。以Braford蛋白测定试剂盒说明书所述流程进行操作,制作标准曲线。配制质量浓度为5.0 g/L的多糖溶液,并进行梯度稀释,分别取不同质量浓度多糖溶液20 μL加入孔板。各孔中分别加入Braford 试剂200 μL,振荡均匀,室温静置10 min。酶标仪测定A595,根据标准曲线计算多糖中蛋白含量。
2)全波长扫描。配制质量浓度为2.0 g/L的多糖溶液,以0.22 μm微孔滤膜进行过滤。紫外全波长扫描范围200~800 nm。
3)凝胶渗透色谱。配制质量浓度为2.0 g/L的多糖溶液,以0.22 μm微孔滤膜进行过滤。滤液采用GPC-多角度激光散射联用系统(GPC-MALLS)进行测定,色谱柱为Shodex OHpak SB-806 HQ,流动相为0.2 mol/L NaCl溶液,流速为0.5 mL/min,柱温为30 ℃。此法可以同时检测多糖分子量。
1.2.6 胶质芽孢杆菌胞外多糖结构初步分析
1)红外光谱分析。取10.0 mg胶质芽孢杆菌胞外多糖样品置于玛瑙研钵中,加入500.0 mg KBr干粉末,充分研磨。用压片机将研磨粉末压制成薄片,薄片厚度控制在0.6~0.8 mm。红外光谱扫描波数范围为4 000~500 cm-1。
2)单糖组成分析。参照文献[14]的方法测定单糖组成。
3)糖醛酸含量测定。参照文献[15]的方法,制作葡萄糖醛酸标准曲线
1.2.7 样品中糖醛酸含量测定
取质量浓度5.0 g/L的胶质芽孢杆菌胞外多糖溶液,进行梯度稀释。按照标准曲线操作流程重复,于波长525 nm处测定吸光值。根据标准曲线计算BMPS中糖醛酸含量。
2 结果与讨论
2.1 5 L发酵罐中胶质芽孢杆菌胞外多糖的发酵生产
在胶质芽孢杆菌胞外多糖发酵过程中,随着菌体生长,多糖逐渐积累,发酵液黏度逐渐提高,发酵液中传氧、传质效果较差,从而限制了多糖的进一步积累[16]。在前期研究中,已对胶质芽孢杆菌SM-01摇瓶发酵的培养基成分及培养条件进行了优化(数据未显示),但由于摇瓶发酵本身存在较多限制条件,随着发酵液黏度增大,摇瓶发酵体系中传氧、传质效果变差且没有良好的应对措施,严重阻碍了胶质芽孢杆菌胞外多糖进一步积累。为了进一步促进多糖的工业化生产,笔者在5 L发酵罐进行了胶质芽孢杆菌胞外多糖的发酵研究。
2.1.1 搅拌转速对胶质芽孢杆菌产BMPS的影响
搅拌转速是细菌胞外多糖发酵过程中一个至关重要的因素。适宜的搅拌转速会保证良好的传氧,充足的溶氧能够为胞外多糖的合成提供能量供给,而均匀搅拌所达到的传质效果,能够使菌体与各种营养物质良好的接触,促进各种营养元素的快速摄取,以提高菌体生长速率及胞外多糖合成速率。因此,考察不同搅拌转速对发酵体系中多糖浓度及OD600的影响,结果见图1。
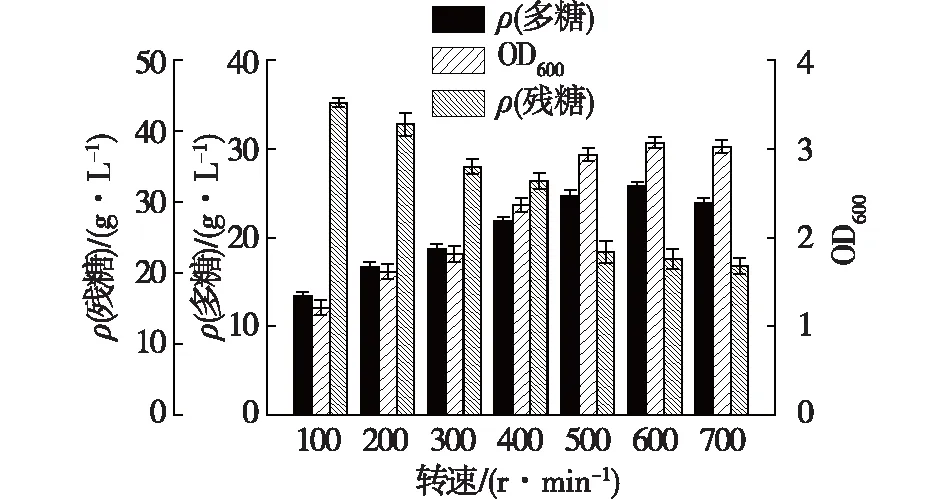
图1 搅拌转速对菌体生长和多糖浓度的影响Fig.1 Effects of agitation speed on cell growth and polysaccharide concentration
由图1可知:当转速为100 r/min时,多糖质量浓度最低,且此时OD600也最低;随着搅拌转速增大,胞外多糖浓度及OD600随之提高,并于转速为600 r/min时多糖浓度及OD600达到最高,分别为25.9 g/L及3.1;当转速超过600 r/min时,多糖浓度及OD600均随转速的升高而降低。发酵罐搅拌转速的提高会提升胶质芽孢杆菌胞外多糖发酵过程中传氧、传质速率,保证了发酵过程中能量与营养元素的充足供应,因此在转速为100~600 r/min时,随着搅拌转速提高,多糖浓度及菌体浓度也随之升高。此外,BMPS溶液为假塑性流体,发酵体系中剪切速率随搅拌转速的提高而增大,使得发酵液表观黏度下降。发酵液黏度下降对发酵过程中的传氧、传质效果具有促进作用,进而促进菌体生长及多糖合成。但当搅拌速度过高时,过高的剪切速率反而会对菌体正常生长及代谢活动带来伤害,因此在转速为600~700 r/min时,OD600随转速的升高而降低,最终导致多糖合成效率降低。
2.1.2 通气量对胶质芽孢杆菌产胞外多糖的影响
溶氧是胞外多糖发酵过程中一个重要环境因子。菌体自身生长代谢活动及胞外多糖合成过程都是耗能过程,会涉及一系列氧化反应。在胶质芽孢杆菌SM-01胞内,分子氧既可作为最终电子受体,又可作为菌体内某些化合物的结构成分。考察不同通气量对菌体生长及多糖合成的影响,结果见图2。
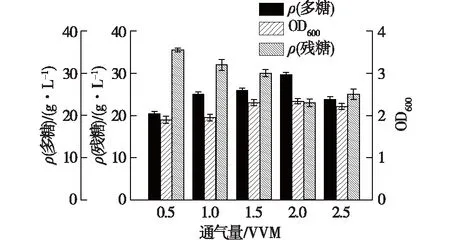
图2 通气量对菌体生长和多糖浓度的影响Fig.2 Effects of aeration rate on cell growth and polysaccharide concentration
由图2可知:当通气量为0.5 VVM时,胞外多糖浓度及菌体浓度最低;通气量为0.5~2.0 VVM时,发酵液中溶氧水平随通气量升高而升高,与此同时,菌体浓度及多糖浓度均有所提高并于通气量为2.0 VVM时,多糖质量浓度及OD600达到最高值,分别为29.8 g/L及2.3;当通气量为2.5 VVM时,OD600及多糖浓度都开始下降。这是因为分子氧对菌体而言,除了作为最终电子受体外,还能够产生对生物体有毒害作用的物质,如超氧基化合物及H2O2,这2种物质在互相作用时会产生毒性更强的自由基·OH,不利于菌体的生长及胞外多糖的合成。
2.2 胶质芽孢杆菌胞外多糖的分离纯化结果
2.2.1 粗多糖的制备
经离心、浓缩、去蛋白、醇沉、干燥后得到的粗多糖样品(图3)。将粗多糖溶解于去离子水中得到粗多糖溶液,光学显微镜检测结果显示并无菌体存在,表明多糖中已不含菌体。

图3 粗多糖样品Fig.3 Crude polysaccharide
2.2.2 胶质芽孢杆菌胞外多糖分离纯化
细菌胞外多糖为长链大分子结构,除寡糖重复单元聚合而成的主链之外,在多糖的主链之上还有较多侧链及基团。这些侧链及基团一般为带电子结构,能对胞外多糖与其他多糖复配时的作用效果产生影响,而细菌胞外多糖的吸附能力也主要取决于这些侧链修饰结构。一般而言,细菌胞外多糖为单一组分时,其侧链带电基团基本一致,不同多糖结构中,侧链带点基团间的差异决定了其与离子交换层析中所用填料之间结合程度的差异。基于这一特性,可利用离子交换柱层析将细菌胞外不同组分的多糖分离纯化。
选取用DEAE-52离子交换柱层析纯化胶质芽孢杆菌胞外多糖。以不同浓度的NaCl溶液作为洗脱液进行分阶段洗脱,结果如图4。
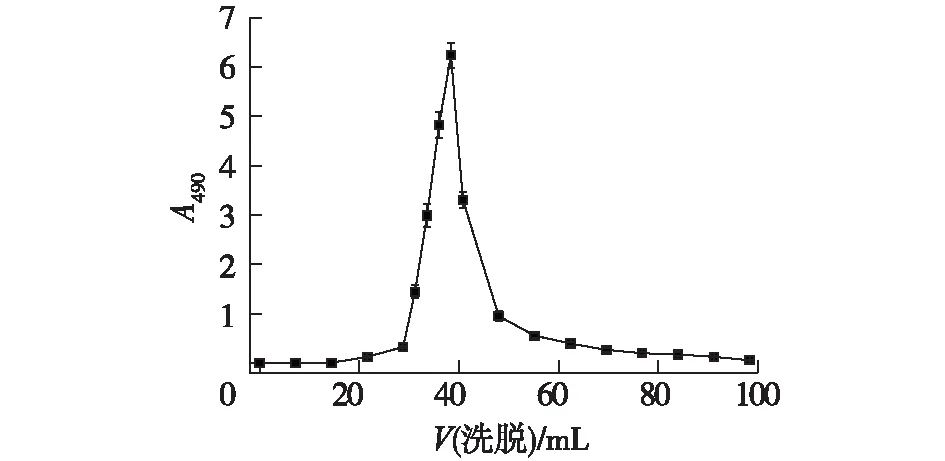
图4 DEAE离子交换柱层析Fig.4 Chromatography on DEAE ion exchange column
由图4可知:当洗脱液为0.5 mol/L NaCl溶液时出现洗脱峰,其他浓度NaCl溶液洗脱时均无明显洗脱峰出现。当洗脱液用量为40 mL时,出现峰形对称的洗脱峰,表明在该条件下所得多糖为单一组分。
洗脱得到的洗脱液,用透析法除去多糖中的无机盐离子及残留的各种小分子杂质后浓缩体积,以3倍体积无水乙醇4 ℃沉淀10 h,离心后冷冻干燥获得多糖样品。
2.2.3 胶质芽孢杆菌胞外多糖纯度检测结果
1)紫外全波长扫描及蛋白含量测定。对质量浓度为0.5 mg/mL的纯化多糖溶液进行紫外全波长扫描分析,结果如图5。由图5可知:该多糖溶液只在200 nm左右出现多糖类物质特征吸收峰,260、280 nm处均没有特征吸收峰,表明纯化过后的多糖中核酸及蛋白含量较低,多糖纯度较高。进一步对蛋白含量进行测定结果表明,纯化的多糖样品中蛋白质含量仅为0.9%,与紫外全波长扫描结果一致。
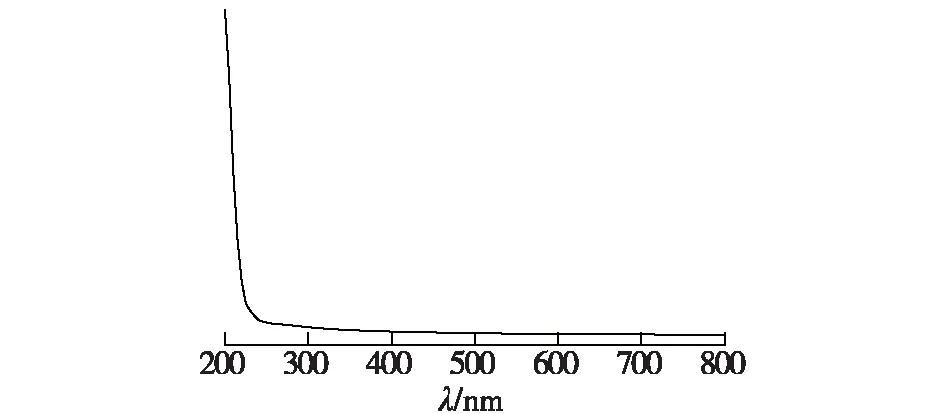
图5 紫外全波长扫描Fig.5 Ultraviolet full spectrum
2)凝胶渗透色谱。细菌胞外多糖为大分子化合物,其纯度检验的标准及方法与小分子化合物的标准及方法存在较大差异。多糖纯度检验通常有4种方式:超速离心法、高压电泳法、比旋度法和凝胶过滤法。凝胶过滤法是目前应用较为广泛且准确的方法,其原理为不同性状及分子量的多糖在不同大小孔径凝胶中的迁移速率存在差异,分子量较小的多糖在过滤过程中进入凝胶孔径中,因此迁移速率相对较慢,而分子量较大的多糖则具有较快的迁移速率,若经检测器检测到单一对称的峰,即可认为此多糖为单一组分。
本研究中,胶质芽孢杆菌胞外多糖经过离子交换柱层析等一系列分离纯化过程后,凝胶渗透色谱检测结果显示只有一个单一对称的峰出现(图6),表明得到的多糖纯度较高,为单一组分。
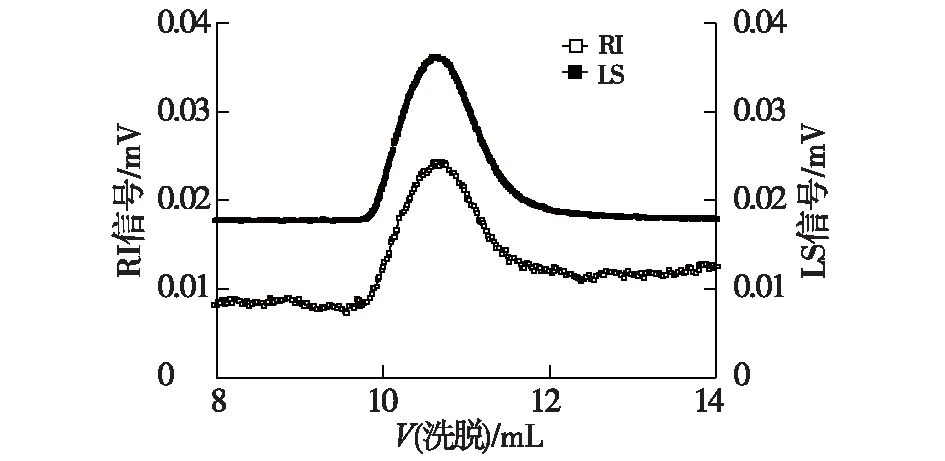
图6 凝胶渗透色谱分析图谱Fig.6 Analysis results of gel permeation chromatographic
2.3 胶质芽孢杆菌胞外多糖的结构初步分析结果
2.3.1 胶质芽孢杆菌胞外多糖的红外光谱分析
采用红外光谱扫描对纯化得到的胶质芽孢杆菌胞外多糖进行分析,结果见图7,将图7(a)中2 000~400 cm-1位置放大,得到图7(b)。由图7可知:1 413及1 600 cm-1为羧酸伸缩振动峰,说明多糖中有羧基存在,由此初步判定胶质芽孢杆菌胞外多糖为酸性糖;1 400~1 200及2 800~3 000 cm-1为亚甲基伸缩振动峰,是糖类化合物的特征吸收;3 405 cm-1为羟基伸缩振动峰,此测定结果与李洁等[14]对胶质芽孢杆菌胞外多糖的研究结果基本一致。
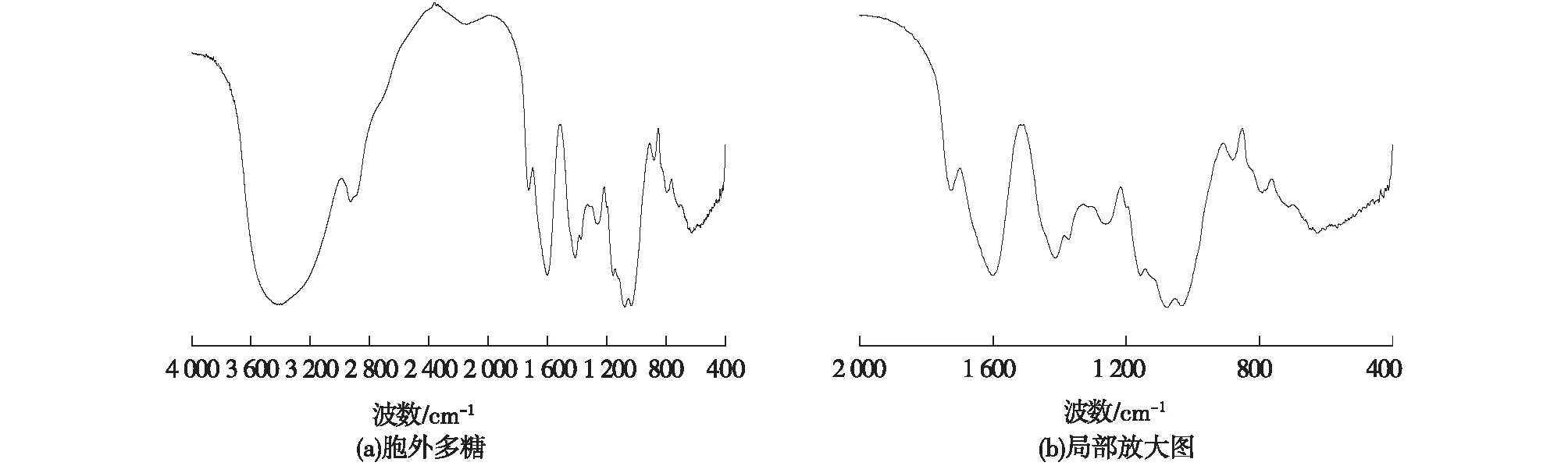
图7 胞外多糖红外光谱分析Fig.7 Infrared spectrum analysis of EPS
2.3.2 糖醛酸含量测定
较多细菌胞外多糖中都存在己糖醛酸,其可与四硼酸钠-硫酸作用后再与间羟基联苯互相作用产生有色物质,该有色物质最大吸收波长为525 nm,且525 nm处吸光值大小与糖醛酸含量之间具有良好线性关系。因此本研究以此法测定BMPS中糖醛酸含量,结果显示糖醛酸在BMPS中含量为24.6%。结合红外光谱分析结果可认定胶质芽孢杆菌胞外多糖为一种酸性多糖。离子色谱测定结果显示酸性糖为葡萄糖醛酸。
2.3.3 分子量测定
细菌胞外多糖分子量测定是多糖性质研究工作中一个重要方面。细菌胞外多糖的性质与其分子量之间存在密切的联系。如多糖水溶液黏度,其黏度不仅与多糖在水溶液中的浓度有关,还与多糖分子量存在关系。一般情况下,多糖水溶液黏度与其分子量之间呈正相关关系。不同分子量大小的多糖之间性质也存在差异,因此在细菌胞外多糖应用中,时常根据其具体应用要求选取合适分子量的多糖。
本研究中以凝胶渗透色谱检验多糖纯度的同时,可测定其分子量(图6)。经测定,胶质芽孢杆菌胞外多糖平均分子量为4.4×106,这一测定结果与李洁等[14]所测定胶质芽孢杆菌胞外多糖分子量处于同一数量级。
2.3.4 单糖组成测定
利用气相色谱检测单糖组成,结果见图8。
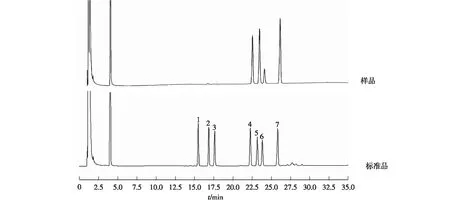
1—鼠李糖;2—半乳糖;3—木糖;4—甘露糖;5—葡萄糖;6—半乳糖;7—肌醇图8 单糖组成气相色谱图Fig.8 GC chromatogram of monosaccharides
由图8可知:分离得到的BMPS单糖由葡萄糖、甘露糖及半乳糖构成,摩尔比为3.2∶ 2.2∶ 1,单糖种类与李洁等[14]测定结果相同,但各单糖摩尔比存在差异。李洁等[14]以蔗糖为碳源对胶质芽孢杆菌进行培养,而本文笔者所用碳源为葡萄糖,推测碳源的差异是BMPS中单糖比例发生改变的原因。
3 结论
通过对5 L发酵罐发酵过程搅拌转速及通气量对胶质芽孢杆菌产胞外多糖的影响,最终确定了最适搅拌转速和通气量,并对胞外多糖BMPS进行分离纯化及初步结构分析。通过除菌体、除蛋白等粗提取工艺,进而以离子交换柱层析、透析脱盐等精细纯化过程,获得胶质芽孢杆菌胞外多糖BMPS纯品,经纯度检验其纯度较高,为蛋白质含量仅为0.9%的高纯度细菌胞外多糖,可用于后续研究。采用紫外全波长扫描、红外光谱分析、气相色谱分析、凝胶渗透色谱分析等技术对BMPS结构进行初步解析,确定了所得胶质芽孢杆菌胞外多糖为糖醛酸含量为24.6%的酸性糖,平均分子量为4.4×106,由葡萄糖、甘露糖及半乳糖构成,摩尔比为3.2∶ 2.2∶ 1。
国内已有胶质芽孢杆菌胞外多糖结构的相关研究报道。本文所研究的胞外多糖BMPS与已报道多糖相比,分子量处于同一数量级,但单糖组成有所差异,这可能是培养条件及营养因素不同引起。后续将在上述工作基础上,结合京都基因与基因组百科全书(KEGG)中胶质芽孢杆菌的中心代谢途径,解析以葡萄糖为碳源时菌体的胞外多糖生物合成途径,从而为代谢工程手段改造胶质芽孢杆菌提高胞外多糖合成效率提供理论基础。
