红冬孢酵母分子遗传操作技术研究进展
2019-10-10马冬石彭毅雯闻志强金明杰
马冬石,陈 震,彭毅雯,闻志强,金明杰
(南京理工大学 环境与生物工程学院,江苏 南京 210094)
红冬孢酵母(Rhodosporidium)属于担子菌门(Basidiomycota),是目前研究比较热门的一类产油酵母[1]。在优化的培养条件下(加上营养限制或者环境胁迫),红冬孢酵母的胞内油脂含量可达细胞干质量的70%[2]。另外,它还能高效合成类胡萝卜素,积累量甚至可达细胞干质量的36.2%[3]。该菌具有显著的工业微生物特征,如,能广泛利用各种碳源(包括己糖和戊糖)和氮源、可高密度培养、抗逆性强(可直接发酵木质纤维素水解液)等[4]。自20世纪50年代以来,红冬孢酵母一直被认为是重要的能源微生物和潜在的萜类化合物细胞工厂。
过去数十年中,该菌的研究主要集中在应用开发和生物加工过程控制等方面。近年来,随着环保压力的加大和化石燃料价格走高,利用代谢工程、合成生物学技术开发“加强版”红冬孢酵母生产可再生燃料和绿色化学品成为迫切需求。然而,由于遗传背景不清晰和分子操作技术匮乏,该菌的遗传改造一直进展缓慢。2012年,大连化物所赵宗保课题组的Zhu等[5]率先对圆红冬孢酵母(RhodosporidiumtoruloidesNP11)进行了测序,公布了圆红冬孢酵母的全基因组序列,这使得从分子水平深入研究该类微生物成为可能。此后,针对红冬孢酵母的组学研究、质粒转化、基因元件挖掘及遗传操作工具开发等开始出现并蓬勃发展。
组学的研究一定程度上促进了红冬孢酵母合成生物学元件(如复制子、启动子、终止子和筛选标记等)的挖掘,但尚未发现在红冬孢酵母中有功能的复制元件。目前,红冬孢酵母的遗传操作载体一般为线性DNA片段、自杀质粒或者T-DNA质粒(主要配合根癌农杆菌介导转化Agrobacteriumtumefaciensmediated transformation(ATMT)使用)。由于红冬孢酵母同源重组效率较低,外源基因的定点整合、靶基因无痕敲除的成功报道很少,缺乏成熟的遗传操作技术已成为红冬孢酵母代谢工程改造为“细胞工厂”的主要障碍[1,4]。本文中,笔者对红冬孢酵母分子遗传操作技术的发展进行了梳理和归纳,以期为该菌分子遗传改造研究指明方向。
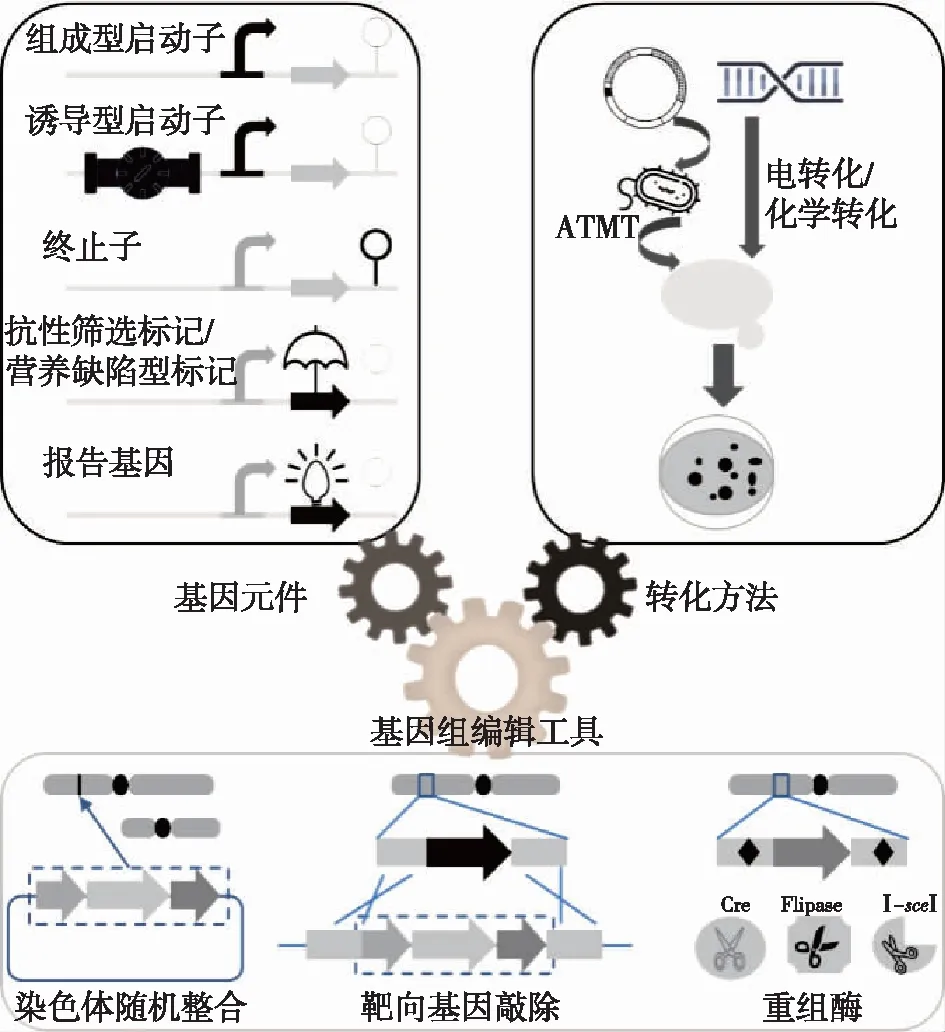
图1 红冬孢酵母分子遗传操作工具技术Fig.1 Genetic technique development of Rhodosporidium
1 更多的合成生物学元件有待挖掘、表征和应用
合成生物学元件是遗传操作工具的重要组成部分。新元件的挖掘和应用有望持续改善遗传操作技术的效率。同其他真核生物一样,红冬孢酵母中的基因表达模块结构也是“启动子-功能基因-终止子”,其中的“功能基因”包括筛选标记、报告基因等元件(图1)。过去数十年的研究已经积累了一批启动子、终止子、筛选标记和报告基因等载体元件,这些亦可用于红冬孢酵母。
红冬孢酵母中可用的启动子元件基本上是通过挖掘其基因组而得到,分为组成型和诱导型2种。Wang等[6]以潮霉素抗性梯度和潮霉素基因转录水平为评价依据,基本上确定了R.toruloidesY4中的PPGI、PPGK、PFBA、PTPI和PGPD等组成型启动子的强弱排序。Liu等[7]鉴定了R.toruloidesATCC 10657的PGPD1启动子,并以荧光素酶为报告基因表征了圆红冬孢酵母油脂合成的6个重要基因启动子,包括PACC1、PACL1、PFAS1、PFAT1、PDUR1和PLDP1等[8]。其中,PLDP1启动子的强度是PGPD1启动子的4~11倍,而PGPD1启动子普遍被认为是酵母中最强的启动子之一。此外,他们还开发了一个可被D-氨基酸严谨诱导的PDAO1启动子系统[9],此系统依赖于诱导物(如D-丙氨酸)浓度,在D-氨基酸诱导下,PDAO1启动子可增强10倍,有很好的应用潜力。在其他研究中,马斯佳[10]鉴定了受磷酸盐浓度严谨调节的启动子PPHO89,受葡萄糖浓度严谨调节的启动子PADH2和PGAL1;而Johns等[11]鉴定和表征了PNAR1、PICL1、PCTR3和PMET16等诱导型启动子,充实了可调节元件的工具箱。
在酵母中,终止子通常是基因终止密码子下游的一段长度在数百碱基以内可以发挥终止其mRNA转录作用的序列,一般含有(T-rich)..TA (T) GT..(AT-rich)..TTT和TTTTTATA 特征序列。目前已有多种红冬孢酵母的內源终止子用于异源基因的表达,如Thsp、Tgpd等[12],同时还发现某些来自花椰菜花叶病毒(Cauliflowermosaicvirus)的终止子T35s和来自根癌农杆菌(A.tumefaciens)的终止子Tnos也能在红冬孢酵母中发挥转录终止功能[13]。
完善的载体系统还需要有效的筛选标记和报告基因。酵母转化系统中常用的筛选标记有营养缺陷型筛选标记和抗生素抗性筛选标记。目前在红冬孢酵母中,可用的营养缺陷型标记仅有URA3[14]和LEU2[15],而抗性标记有HYG、BLE、NAT和G418等[12-13]。多轮的抗性标记表达盒整合实验表明[13],HYG、BLE和NAT这3种标记甚至可同时在该菌中发挥作用,使突变株可同时耐受多种抗生素。报告基因如荧光素酶(luciferase)、(增强型)绿色荧光蛋白(GFP)等也开始被用于启动子表征和菌株筛选中[7,9]。
总体来说,红冬孢酵母的元件仍不丰富,如在酿酒酵母中常用的RNA聚合酶Ⅲ型启动子(可启动sgRNA这样的小RNA)以及YFP、RFP、CFP和HIS等报告基因或营养缺陷型筛选标记仍有待开发、验证。另外,核定位信号(nuclear localization sequence,NLS)作为基因编辑系统的重要元件,也有待鉴定和表征[16]。因此,继续尝试引进和挖掘新的基因元件仍然十分迫切。
2 外源基因转化步骤繁琐且转化率低
高效、可靠的外源基因转化方法及遗传操作技术是工业微生物代谢工程改造的前提条件。目前尚未在红冬孢酵母中发现内生性游离质粒,也没有证实任何染色体自主复制序列(autonomously replicating sequence,ARS)或着丝粒(CEN)序列可作为游离质粒的复制元件在红冬孢酵母中有功能[17]。因此,红冬孢酵母的转化载体基本上都是整合型的。
红冬孢酵母的外源基因转化研究始于1985年。Tully等[15]报道称聚乙二醇(PEG)介导的原生质体转化可将苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)基因随机整合至该菌的染色体上,1 μg DNA约转化1 000转化子。由于原生质体转化法对高度依赖于菌株的原生质体制备操作繁琐,后续研究开始转向根癌农杆菌介导的转化法(ATMT)[7,12]。ATMT转化适用于各种红冬孢酵母,但转化效率随着筛选标记的不同而有所不同,转化效率从70至1 000转化子(以一个转化平板计算)[7]。农杆菌转化操作简单,但过程繁琐,从构建质粒、制备供体农杆菌到红冬孢酵母转化子筛选完成,耗时近2周。乙酸锂/聚乙二醇(PEG)介导的化学转化法也被尝试用于R.toruloidesDMKU3-TK16的转化。该转化方法非常简便,易于操作,但转化效率仍然偏低,1 μg DNA仅转化25 转化子[18]。最近,电转化已经被发展成为一种新的红冬孢酵母转化方法[17,19],不同菌株的转化率亦不同,其转化效率为40~1 000 CFU(以1 μg DNA计)不等。化学转化和电转化代表了红冬孢酵母转化研究的新方向,但转化效率仍有待提高。
目前,ATMT仍然是最可靠和主流的研究方法[1],但问题是T-DNA是大概率地以非同源末端连接(non-homologous end joining, NHEJ)随机插入的方式被整合到基因组上,而不是以游离状态与染色体上靶标基因进行同源重组,这导致了转化子中发生过同源重组的突变株比例极低,必须开发出合适的方法有效过滤掉随机插入导致的突变株。在T-DNA中携带致死基因负筛选标记,使随机插入突变株无法在筛选培养基中生长是1种较好的过滤策略。该方法已经在不少真菌(如大丽轮枝菌(Verticilliumdahliae))中尝试成功,可为红冬孢酵母的ATMT转化提供借鉴[20]。
另外,低的转化率仍然是所有转化方法的痛点。目前红冬孢酵母的转化效率最高在103转化子(以1 μg DNA计)(或105个细胞)级别,这使得依赖于高转化效率的遗传操作工具如转座子突变等可能无法使用。同时也意味着,当出现频率低于1/1 000时,正转化子仍然很难获得。因此需要耗费大量的人力、物力来增加总转化子数量,同时还要借助反筛标记或其他方法过滤掉大量的背景菌株。由此可知,优化转化条件及筛选复制子仍是突破转化效率瓶颈的重点方向。
3 遗传操作工具开发进展缓慢
科学家在红冬孢酵母中已经实现了初步的外源基因的过表达或者内源的有特殊表型的基因(便于筛选)的插入失活,但存在基因元件使用效率低、精准的定点整合或者基于同源重组的基因删除操作还不能有效开展等问题。
由于尚无游离质粒可用,目前的红冬孢酵母转化载体主要是线性DNA、Ti质粒或者自杀质粒等整合型载体。这意味着非整合元件在细胞内的作用时间较短(一个细胞分裂周期),效率也就不可能高。而某些得重复使用的整合元件(如抗性标记等)则必须回收。鉴于此,孙文怡[16]证实Cre/loxP位点特异性重组系统和FLP/FRT重组酶系统在红冬孢酵母中可用,并用FLP/FRT系统回收抗性marker,实现了外源基因的多轮随机整合。另外,归巢内切酶Ⅰ——sceⅠ也可以被用于重要筛选标记的回收[21]。
精确的遗传改造的另一个挑战是圆红冬孢酵母的同源重组效率较低。Sun等[22]以ATMT转化八氢番茄红素脱氢酶基因CRT1的同源重组敲除盒,测试出R.toruloidesNP11的同源重组效率约为2%。Koh等[23]利用ATMT转化敲除盒以同源重组方式敲除CAR2基因(编码胡萝卜素环化酶)时,敲除株仅占全部转化子的10.5%,而以Ku70基因(编码KU70/80异质二聚体中的一个亚基敲除后,菌株的非同源末端连接效率降低)敲除株为底盘细胞时,CAR2基因的同源重组敲除率(敲除株占全部转化子比例)大幅提升至75.3%,不过总转化子数量下降约一个数量级。这说明Ku70的敲除虽降低了T-DNA随机插入染色体的能力,过滤掉了大量的随机插入突变株(从6 152下降至885),从而减少了正突变株的筛选工作量,但对同源重组效率的提升贡献有限。因此,必须挖掘红冬孢酵母的内源同源重组元件并加以强化,或者引入外源的同源重组元件来提升该菌的同源重组效率,促进遗传操作工具开发和应用。
低的同源重组效率以及低的转化效率和载体元件效率共同限制了基于同源重组的遗传操作工具的使用。目前热门的CRISPR/Cas系统尚未在红冬孢酵母中成功应用,且报道非常少,推测原因可能有:1)缺少复制子,使得CRISPR/Cas系统的部分元件(如游离时起作用的同源臂、转录后成熟的sgRNA等)只能是在一个细胞分裂周期内起作用;2)低的同源重组效率使得DNA双键断裂并修复成功的概率较低;3)低的转化效率进一步降低了正转化子出现的可能性。
4 总结与展望
最近几年,红冬孢酵母因其生理、代谢特性和应用开发潜力引起了学术界和工业界的广泛兴趣。系统生物学(包括基因组学、转录组学、蛋白组学和代谢组学)已经基本上阐明了红冬孢酵母基因组的组成、代谢途径及其生理和对环境压力响应的分子机制,同时也辅助挖掘和表征了不少内源的基因元件(启动子、筛选标记和终止子等)。新的转化方法(如化学转化和电转化)的出现和发展,一定程度上加速了红冬孢酵母的功能基因鉴定和代谢工程改造研究。另外,很多在酿酒酵母或者解脂耶氏酵母中已经应用的转化方法、遗传工具、筛选标记或者报告系统已经被引入红冬孢酵母。遗憾的是,同源重组效率低以及尚无可用的游离质粒限制了目的基因的靶向插入和精确敲除。缺乏高效、精确的基因组编辑技术仍是红冬孢酵母平台菌株开发的一大障碍。
在合成生物学时代,以人工智能挖掘海量的组学数据,丰富红冬孢酵母的基因元件库,同时引入已在其他微生物如解脂耶氏酵母、酿酒酵母中成功应用的遗传技术,新的合成生物学工具(如CRISPR/Cas系统)应用成果有望很快面世。新一代的生物铸造技术结合自动化的高通量平台,将改写红冬孢酵母的分子遗传改造研究格局,持续推动其学术和经济价值的开发。
