酪丁酸梭菌清除饲料中玉米赤霉烯酮的能力
2019-10-10郑文秀赵倩如朱丽英
郑文秀,赵倩如,江 凌,黄 和,朱丽英
(1.南京工业大学 药学院,江苏 南京 211800; 2.南京工业大学 生物与制药工程学院,江苏 南京 211800; 3.南京工业大学 食品与轻工学院,江苏 南京 211800;4.南京工业大学 化学与分子工程学院,江苏 南京 211800)
随着饲料产业的发展,谷物和动物饲料受到真菌毒素的污染已成为目前全球亟待解决的严重问题。在过去的10年中,工厂、研究机构和监督部门都将注意力集中于饲料安全上[1]。据统计,全世界每年有25%的粮食作物会受到真菌毒素的污染[2],如黄曲霉毒素(aflatoxins,AFs),玉米赤霉烯酮(zearalenone,ZEN)等。
ZEN是一种非甾体雌激素真菌毒素,主要由几种镰刀菌产生,尤其是禾谷镰刀菌和黄色镰刀菌,其最初于1962年从发霉的玉米中分离出来[3]。ZEN污染主要发生在谷物中,例如玉米、小麦、大麦、黑麦和高粱等。而玉米作为能量饲料不仅被全世界养殖业广泛使用,而且是发展养殖业不可或缺的支柱饲料。
目前,全球玉米的70%~80%都用于饲料,我国50%用作饲料,因此玉米有“饲料之王”的美称[4]。由于不适宜的气候条件和环境因素,玉米可能在生长、储存、运输和加工的各个环节受到ZEN的污染,导致ZEN在玉米及其副产品中富集,从而对食品安全构成严重威胁[5]。 动物摄入ZEN污染的饲料后,健康遭受严重损害,造成生长和繁殖表现缺陷。而ZEN的雌激素活性可以进入食物链,人类食入受污染的有毒素残留物的家禽产品,如肉类、肝脏或鸡蛋,可能也会导致健康受损,诱发中枢性性早熟,生殖问题以及导致一些乳腺癌发病率的增加[6]。为了保护人类和动物的健康,欧盟对ZEN设定了严格的限制:未加工谷物在食品中的定量为100 μg/kg,未加工玉米在饲料中的定量为350 μg/kg。根据文献[7]的报道,目前中国设定饲料中ZEN的最大残留限量为500 μg/kg,谷物和谷物制品为60 μg/kg。
鉴于ZEN对动物和人类的严重危害,如何利用有效的手段清除饲料中ZEN已成为全球关注的热点问题,物理法、化学法和生物法是人们现在研究常用的三大方法。其中,物理法包括添加营养惰性吸附剂和挤压蒸煮,常用的营养惰性吸附剂为铝硅酸盐和含有黏土的铝硅酸盐,然而其商业用途由于成本高而受限制;挤压蒸煮是现代食品加工新技术之一,尽管能提高产品质量和安全性,但仍需证明ZEN的毒性或生物活性已降低或完全消除[8]。化学法包括使用高浓度的臭氧、H2O2进行处理,可以部分破坏ZEN,但是缺少ZEN代谢物及其潜在毒性的信息[8]。生物法则是解决真菌毒素污染最具前景的方法,据报道多种细菌和真菌的生物降解能力已被表征[9],因而通过微生物降解作用或吸附作用将毒素清除或降解为无毒产物已是目前研究的热点。
酪丁酸梭菌是一种广泛应用于饲料、医药和化工等行业的厌氧菌株。在饲料领域,农业部批准酪丁酸梭菌可作为新型饲料添加剂,以提高牲畜的免疫力水平和营养价值,减少抗生素的使用,其主要代谢产物丁酸可以作为动物生长代谢所需的营养元素。与抗生素相比,在饲料中添加酪丁酸梭菌具有绿色无污染、无耐药性和无有害残留等特点,现正在逐渐被广泛应用于动物饲料行业中[10]。
笔者对其清除液体中ZEN能力和影响因素进行了系统研究,将酪丁酸梭菌进行活菌培养、热处理和酸处理,在不同菌浓条件下吸附ZEN,利用高效液相色谱(HPLC)检测样品中ZEN含量,以确定酪丁酸梭菌对ZEN的清除率和各个因素的影响。并且对酪丁酸梭菌驯化培养,比较其清除率,以期为今后研究酪丁酸梭菌在动物饲料中的脱毒作用奠定一定的研究基础。
1 材料与方法
1.1 实验菌种
酪丁酸梭菌(Clostridiumtyrobutyricum)CCTCC W428,由食品与轻工学院实验室保存[10]。
1.2 材料与试剂
酵母粉、蛋白胨,英国Oxoid公司;甲醇,上海萨恩化学技术有限公司;葡萄糖、NaCl、牛肉浸膏、十二水合磷酸氢二钠、可溶性淀粉、无水乙醇、NaOH,上海国药集团化学试剂有限公司;KH2PO4、无水乙酸钠、KCl,广东光华化学厂有限公司;HCl、分析纯,上海凌峰化学试剂有限公司;ZEN,以色列Fermentek公司;乙腈、色谱纯,北京百灵威科技有限公司;L-半胱氨酸盐酸盐、刃天青,美国Sigma公司。
发酵培养基:蛋白胨10 g/L,牛肉浸膏10 g/L,葡萄糖5 g/L,NaCl 5 g/L,无水乙酸钠3 g/L,酵母浸粉3 g/L,可溶性淀粉1 g/L,L-半胱氨酸盐酸盐0.5 g/L,刃天青0.05%(质量分数);pH 6.8。
磷酸盐缓冲液(PBS,0.1 mol/L,pH 7.4):十二水合磷酸氢二钠 2.9 g、KH2PO40.2 g、NaCl 8 g和KCl 0.2 g溶解于去离子水中,定容至1 L。
ZEN储备液:精密称量10 mg,用色谱级乙腈溶解,并定容至10 mL,配成1 mg/mL标准储备液,于-20 ℃保存待用。
1.3 仪器与设备
YXQ-1型厌氧培养箱,上海跃进医疗器械有限公司;SW-CJ-1FD型超净工作台,苏州净化有限公司;Ultrospec 3300 pro型分光光度计,美国Amersham Biosciences公司;WGL-230B型电热鼓风干燥箱,天津市泰斯特仪器有限公司;3K15型台式冷冻离心机,德国Sigma公司;HH-4型恒温水浴锅,太仓实验仪器厂;UltiMate 3000型戴安高效液相色谱仪,美国Dionex公司;DMC 2900型显微镜,德国徕卡仪器有限公司。
1.4 实验方法
1.4.1 菌种的活化和培养
取-80 ℃甘油管保存的菌种,37 ℃静态厌氧培养24 h,得到一级种子。继续转代2次,以三级种子作为发酵母种,接入含100 mL生长培养基的500 mL厌氧瓶中,接种量为5%(体积分数),37 ℃下静态厌氧培养待用。
1.4.2 酪丁酸梭菌清除ZEN能力的测定
酪丁酸梭菌的处理方法,结合参考文献[12]并稍有修改,酪丁酸梭菌37 ℃静态培养12 h后取样,采用血球计数板法测定菌体质量浓度[13],调整菌体密度为1.0×1010个/mL于4 ℃、3 000 r/min离心10 min,菌体用PBS缓冲液洗涤,倒掉上清液,将菌体重悬于1 mL 培养基中,内含20 μL 1 mg/mL ZEN,分别于37 ℃ 孵育2、 4、 6、 8、10、12和24 h,反应结束后,离心取上清液,用HPLC分析上清液中的ZEN含量。采用相同的处理方法,控制其他影响因素一定,探究反应温度(20 、30、37和42 ℃),培养基pH(4.0、5.0、6.0、7.0和8.0),初始菌体密度(1.0×108、1.0×109、1.0×1010和1.0×1011个/mL)对酪丁酸梭菌清除ZEN的影响。
酪丁酸梭菌的预处理方法,结合参考文献[14]并稍有修改,分为活菌组、热处理组和酸处理组。酪丁酸梭菌37 ℃静态培养12 h后取样,控制菌体密度为1.0×108、1.0×109、1.0×1010和1.0×1011个/mL分别于4 ℃、3 000 r/min 离心10 min,菌体用PBS缓冲液洗涤。活菌组(37 ℃、4 mL PBS缓冲液孵育1 h),热处理组(4 mL PBS缓冲液中煮沸1 h),酸处理组(37 ℃、4 mL 2 mol/L HCl 中孵育1 h)处理后,酸处理的菌体用PBS洗涤2次。将获得的菌体重悬1 mL 培养基中,内含1 mg/mL ZEN 20 μL,混匀后于37 ℃孵育24 h,离心取上清液,用HPLC分析ZEN的含量。以不含菌体的培养基和ZEN溶液为空白对照。ZEN清除率(Y)计算式见式(1):
(1)
式中:S为酪丁酸梭菌处理后上清液中毒素的峰面积,S0为空白对照毒素的峰面积。
1.4.3 酪丁酸梭菌菌株的驯化
为了达到更好的清除ZEN毒素的效果,对其进行菌种的驯化。100 mL的厌氧瓶中加入50 mL培养基,然后在第一代菌株的培养基中加入1 mg/mL的ZEN 20 μL(ZEN添加量可忽略不计),37 ℃培养10 h接种到第二代,并在10 h时取样,稀释适当倍数后用可见光分光光度计于600 nm读取菌悬液的OD值,为提高实验准确性,单次实验做3组平行试验。
第二代菌株的培养基中加入40 μL的ZEN,随后依次多加入20 μL的ZEN,直至传代到第50代。选取驯化后的菌种,3 000 r/min离心10 min,除去上清液,PBS缓冲液洗涤获得菌体。选取3个初始菌体密度:1.0×109、1.0×1010和1.0×1011个/mL,分别进行酸处理和热处理,方法同上,用HPLC检测分析驯化后酪丁酸梭菌清除ZEN的含量。
1.4.4 高效液相色谱的检测条件
取一定量的ZEN标准储备液,用乙腈分别稀释成浓度25、20、15、10和5 μg/mL的标准工作液,用于标准曲线的制作。参照参考文献[15]中使用的检测条件,根据本实验实际情况进行改进,使用C18色谱柱 (250 mm× 4.6 mm,5 μm),测试条件为流动相乙腈和水的体积比60∶ 40,流速1.0 mL/min,进样量20 μL,柱温30 ℃,选用紫外检测器,检测波长254 nm。样品过0.22 μm有机滤膜,装入自动进样瓶中,用HPLC进行分析。
2 结果与讨论
2.1 ZEN标准曲线的绘制
为了对酪丁酸梭菌的脱毒效果进行定量考察,根据标准工作液的质量浓度与峰面积关系制作了标准曲线Y=2 375.91+41 547.56x,R2=0.999,见图1。
由图1可知:在5~25 μg/mL的质量浓度范围内,线性关系较好。

图1 ZEN标准曲线Fig.1 The standard curve of ZEN
2.2 酪丁酸梭菌对ZEN的清除效果
2.2.1 时间对清除效果的影响
以初始菌体密度为1.0×1010个/mL的酪丁酸梭菌重悬于1 mL培养基(pH 4.0),添加最终ZEN质量浓度为20 μg/mL,于37 ℃下孵育2、4、6、8、10、12和24 h,清除毒素ZEN结果见图2。

图2 时间对酪丁酸梭菌清除ZEN的影响Fig.2 The impact of time on the removal of ZEN by Clostridium tyrobutyricum
由图2可知:酪丁酸梭菌吸附清除ZEN是个持续的过程。在2 h时清除率为28.4%;在24 h后,达到最高值31.0%。随着孵育时间的增加,细胞生长将会逐渐减慢,吸附发生后,细胞表面的结构及其所带电荷发生了改变,当细胞生长力较强时,ZEN无法吸附到细胞表面;而当细胞表面改变,细胞生长力降低,ZEN与细胞结合则相对容易,因此细胞吸附毒素的量总体呈逐渐上升趋势[16]。但也有研究表明[17-18]:细胞吸附毒素是一个快速可逆的过程,当吸附达到一定时间后,少量毒素也会释放到溶液中,出现毒素清除率降低的情况,推测细胞与毒素之间结合的比较松散,而后毒素将被细胞重新结合。
2.2.2 温度对清除效果的影响
温度也是影响细胞结合ZEN的一个因素,因为细胞有合适的生长温度,毒素也有存在的最适温度。以初始菌体密度为1.0×1010个/mL的酪丁酸梭菌重悬于1 mL培养基(pH 4.0),添加最终ZEN质量浓度为20 μg/mL,分别于20 、30 、37和42 ℃下孵育24 h,清除毒素ZEN结果见图3。
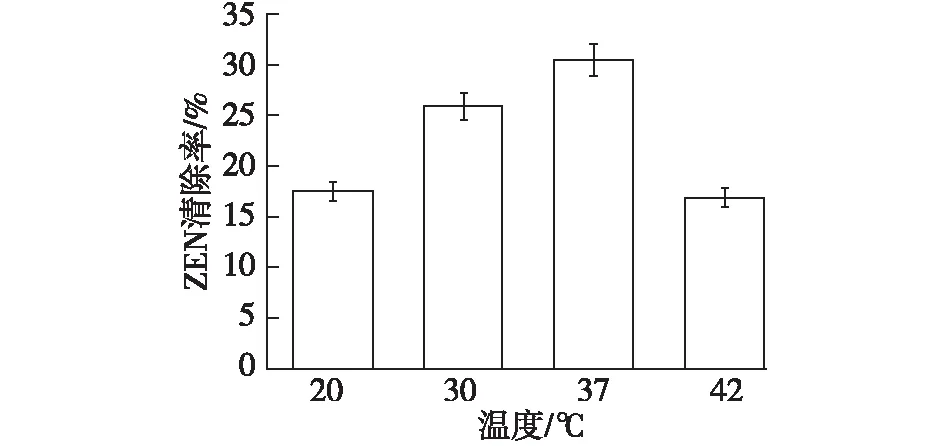
图3 温度对酪丁酸梭菌清除ZEN的影响Fig.3 The impact of temperature on the removal of ZEN by Clostridium tyrobutyricum
由图3可知:温度为37 ℃时ZEN清除率最高,推测可能与此温度下菌体生长代谢活力最强有关[11]。
2.2.3 pH对清除效果的影响
以初始菌体密度为1.0×1010个/mL的酪丁酸梭菌重悬于1 mL 培养基(pH 分别为4.0、5.0、6.0、7.0和8.0),添加最终ZEN质量浓度为20 μg/mL,于37 ℃下孵育24 h,清除毒素ZEN结果见图4。
由图4可知:不同pH环境下,细胞吸附ZEN的效果也有差别,因为ZEN在不同pH溶液中的分子结构有所不同。ZEN是一种内酯型结构,在碱性环境的条件下可以将酯键打开。根据Miao等[16]的研究表明,ZEN有2种酚式羟基。当pH小于7时,ZEN主要以内酯型的形式存在,因其非极性疏水作用,ZEN更易被细胞壁的非极性成分吸附或者进入内部的非极性孔道;当初始pH上升,在碱性环境的条件下可以将酯键打开,ZEN将形成阴离子,使其难与细胞表面的亲水极性成分结合。因此,当pH为4时,细胞对毒素的吸附效果较好。
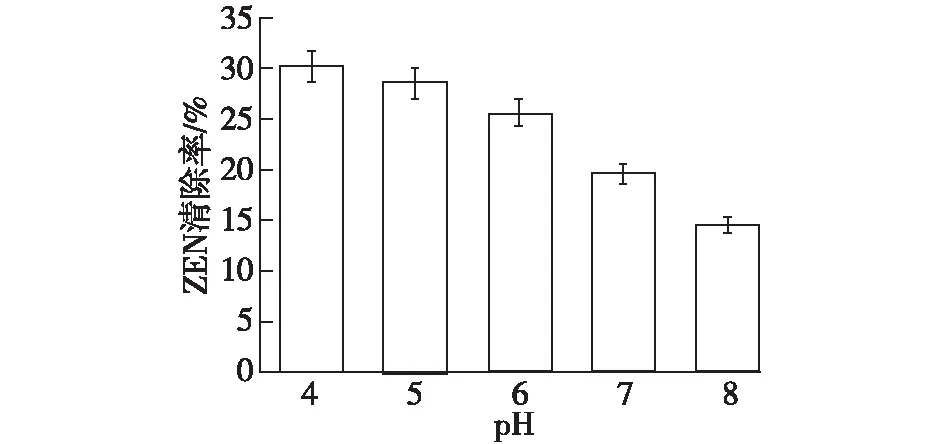
图4 pH对酪丁酸梭菌清除ZEN的影响Fig.4 The impact of pH on the removal of ZEN by Clostridium tyrobutyricum
2.2.4 不同预处理方法对清除效果的影响
为了考察酪丁酸梭菌清除ZEN的能力,选择4种菌体密度1.0×108、1.0×109、1.0×1010和1.0×1011个/mL,分别通过使用不同处理方法对酪丁酸梭菌细胞进行处理,其对玉米赤霉烯酮的清除效果见图5。
由图5可知:当菌体密度为1.0×108个/mL时,酪丁酸梭菌对ZEN就展现了清除的能力,随着菌体浓度的升高,ZEN清除率也逐渐增大,尤其是菌体密度为1.0×1011个/mL时,活菌组(31.9%)、热处理组(44.2%)和酸处理组(50.2%)的清除效果远远超过菌体密度为1.0×108个/mL,显示出菌株处理ZEN最好的清除效果,但是与菌体密度为1.0×1010个/mL时的清除效果相当,说明菌体密度的增大,有利于ZEN含量的降低,但当菌密度超过一定后,对清除毒素的效果就不显著了,这与Zhao等[17]利用植物乳酸菌吸附ZEN的研究结果类似。
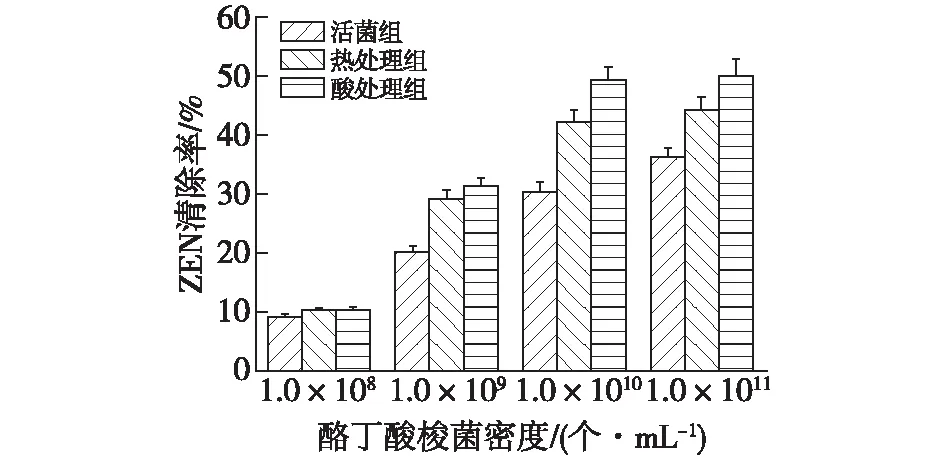
图5 不同细胞密度对清除ZEN的影响Fig.5 The impact of cell density on the removal of ZEN under different treatments
除此以外,当菌体密度一定时,通过对比活菌组,热处理组和酸处理组清除毒素的效果,发现酪丁酸梭菌经过热和酸处理后,清除毒素的能力明显增强,且经过酸处理后的酪丁酸梭菌在菌体密度为1×1010个/mL时,清除率可达49.3%,而热处理组为42%,活菌组为30.4%,分别增加了7.3%和18.9%。这样的结果可能有几种解释:1)热处理和酸处理可能改变了活有机体的原始结合位点,并且暴露了新的结合位点[14],这样细胞的结合位点对ZEN的亲和力就可能增加,从而表现出更好的清除效果;2)酪丁酸梭菌的细胞壁主要成分是多糖和肽聚糖,经过热处理可能会导致蛋白质变性,或者多糖与肽和蛋白质之间形成了美拉德反应产物;3)经过酸处理,多糖的糖苷键断裂,单体被释放,进一步可转化成醛。肽和蛋白质间的酰胺键也被破坏,产生肽和氨基酸,且可能改变了肽聚糖的结构和细胞壁的厚度,从而孔径增加[17-18],有利于细胞对ZEN的吸附清除。由此推断,酪丁酸梭菌清除毒素的机制是吸附作用;且通过热处理和酸处理,酶失去活性,这也证明了酪丁酸梭菌清除毒素不是在酶的作用下转化为其他物质。
2.3 酪丁酸梭菌菌株对高浓度ZEN的驯化研究
为了增强酪丁酸梭菌清除ZEN的能力,达到更好的清除效果,成为饲料添加剂中清除毒素的高效菌株,将其进行适应性驯化培养,使其能够在有毒素的环境中具备较高的耐受力和活动能力。将ZEN添加进酪丁酸梭菌的培养基中,以20 μL ZEN为起点,每代培养10 h后接种于下一代,每一代的培养基中均逐代增加20 μL ZEN,以此规则驯化50代,最后一代的ZEN添加量为1 000 μL,终浓度20 μg/mL。50代酪丁酸梭菌生长第10 h连成的生长曲线图见图6。
由图6可知:从第1~第15代,酪丁酸梭菌生长第10小时的OD均较低,说明菌体生长缓慢,从第16代开始,酪丁酸梭菌OD逐渐增加,生长迅速,说明酪丁酸梭菌对ZEN的耐受性已逐渐增强,生存能力也逐渐增加。经过适应性驯化培养,猜想酪丁酸梭菌菌株的某种表型或者生理特性发生了改变,但目前具体机制不明,有待研究。且驯化后的酪丁酸梭菌不排除具有其他有害特性的可能,还有待进一步探究驯化后酪丁酸梭菌的代谢产物变化及毒性分析,继而进行安全性评估。
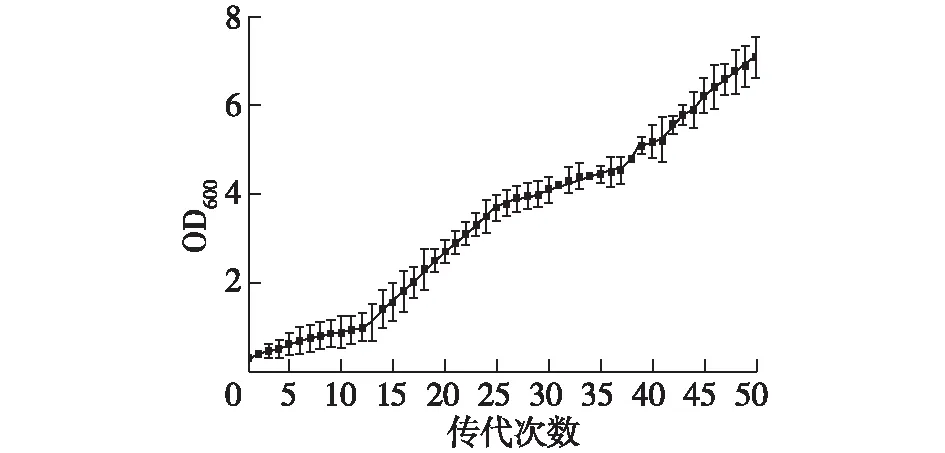
图6 酪丁酸梭菌生长曲线Fig.6 Growth curve of Clostridium butyricum
为了进一步测试驯化后的酪丁酸梭菌清除ZEN的能力,选择1.0×109、1.0×1010和1×1011个/mL 3种菌体密度,同样进行热处理和酸处理,清除效果见图7。
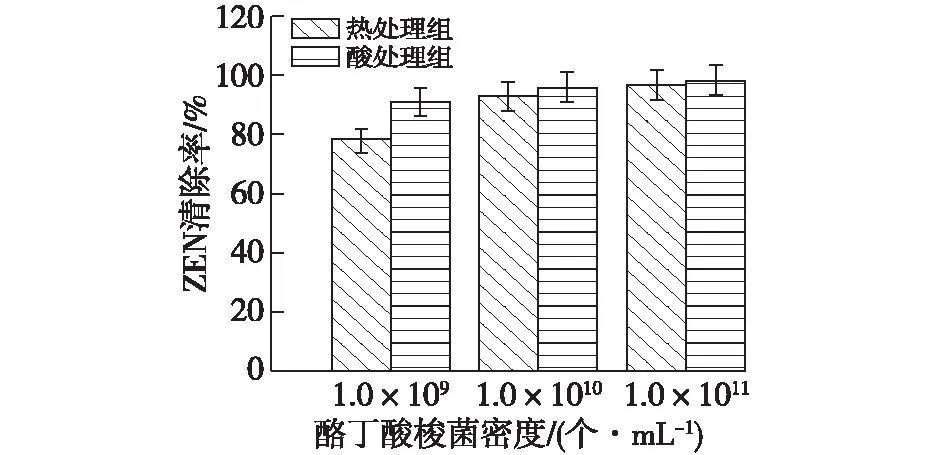
图7 驯化后不同处理条件下细胞密度对清除ZEN的影响Fig.7 The impact of cell density on the removal of ZEN under different treatments after domestication
由图7可知:驯化后的菌株清除ZEN的能力得到了显著地提高,当菌体密度达到1.0×1011个/mL时,经过酸处理后的酪丁酸梭菌对毒素的吸附效果最好,可吸收ZEN达98.5%,并且酸处理组比未驯化酸处理组提高了48.3%,热处理组比未驯化热处理组提高了53.1%。总体来说,酸处理后的清除效果优于热处理。由此证明,通过连续培养驯化菌株的过程能够获得一株耐ZEN毒素性能较好的驯化菌株,同时,成功获得具有生长优势的驯化菌株说明了ZEN浓度逐渐增加的条件下能够提高菌株的耐受性能,维持菌株的细胞活性并保证其稳定生长。考虑到将来会将驯化的酪丁酸梭菌运用于实际中,除了其安全性有待考察外,将其加入饲料中吸附毒素后,饲料还需要进行冲刷、洗涤和烘干等步骤,以及时去除吸附毒素的酪丁酸梭菌菌体。
3 结论
酪丁酸梭菌作为新型的饲料添加剂,不仅能够促进家禽肠道内其他有益菌的快速生长,维持菌群平衡,在本文中得到验证还能够吸附饲料中的ZEN,起到有效清除饲料中毒素的效果。笔者考察了孵育时间、温度、pH及初始菌浓对酪丁酸梭菌吸附ZEN效果的影响,且通过使用不同的处理方法对酪丁酸梭菌细胞进行处理,热处理组和酸处理组吸附ZEN的效果明显高于活菌组,并且菌体密度控制在1.0×1011个/mL时,经过酸处理的酪丁酸梭菌清除ZEN的效果最佳。随后酪丁酸梭菌经过50代的连续培养驯化,其清除ZEN的能力明显提高,在毒素环境中的生存能力也逐渐增强,同样的,驯化后的酪丁酸梭菌经酸处理后,初始菌体密度为1.0×1011个/mL,培养基pH为4.0,于37 ℃孵育24 h时,对ZEN的清除率可达到98.5%,实现了吸附的最佳效果。
由此,本研究为酪丁酸梭菌清除饲料中的ZEN毒素奠定了研究基础,有望对饲料的改良提供理论依据,具有良好的应用前景。
