常见电子介体对大肠杆菌微生物燃料电池产电性能的影响
2019-10-10刘海霞李雪明宋天顺谢婧婧
刘海霞,李雪明,宋天顺,2,谢婧婧,2,3
(1.南京工业大学 生物与制药工程学院,江苏 南京 211800;2.南京工业大学 材料化学国家重点实验室,江苏 南京 210009;3.江苏省先进生物制造协同创新中心,江苏 南京 210009)
随着能源危机的日益加重,开发绿色能源已经成为目前迫切的研究方向之一[1-3]。微生物燃料电池(microbial fuel cell,MFC)是一种应用前景广泛的绿色能源系统[4-7],它利用产电微生物的新陈代谢,降解有机底物,产生胞外电子和质子,电子通过阳极传递至阴极,质子通过质子交换膜由阳极室转移至阴极室,从而实现将储存在有机底物中的化学能转化为电能[4-7]。MFC是以微生物菌株作为催化剂,通过微生物代谢将存储于生物质中的化学能转化为电能的一种环保装置[8-12]。
在MFC中,电化学活性微生物由于其细胞膜上具有电活性的氧化还原酶,可以与电极直接发生电子传递,但大多数的微生物菌株不能和电极直接发生电子转换,为提高非电化学活性微生物氧化底物传递电子的效率,需要借助适量电子介体的帮助[13-17],以显著改善电子的转移速率。用于这类MFC的有效电子介体应具备以下特性[18-21]:①良好的稳定性、溶解性且不能被细菌代谢。②易穿过细胞壁,易获取电子。③电极上氧化还原反应速率快,可逆性好。
本文中,笔者以3种电子介体(中性红、亚甲基蓝和甲基紫精)为对象,研究它们对大肠杆菌BL21(DE3)生长抑制情况及对其MFC产电性能的影响,以期为后续的研究提供基础数据。
1 材料与方法
1.1 材料及仪器
大肠杆菌BL21(DE3)为南京工业大学谢婧婧教授课题组长期保存菌株。
蛋白胨、酵母粉、铁氰化钾、葡萄糖、NaCl等实验试剂均为市售分析纯。
M9培养基(g/L):葡萄糖4、NH4Cl 1、NaCl 0.5、Na2HPO44.756、NaH2PO42.452。
LB培养基(g/L):蛋白胨10、酵母粉5、NaCl 10;自然pH。
阴极液组(g/L):KCl 0.13、Na2HPO411.53、NaH2PO42.772、K3Fe(CN)613.2。
GRP-905型隔水式电热恒温培养箱,上海森杰实验仪器有限公司;数据采集器,美国吉时利电子有限公司;电化学工作站,上海辰华仪器有限公司;H型 MFC反应器,广西理化有限公司。
1.2 MFC反应器构建
采用双室微生物燃料电池反应器,结构如图1所示,阳离子交换膜(Nafion 117,美国杜邦公司)将阴、阳两室隔开,两室溶液体积均为250 mL。阴阳极电极材料均为石墨毡,阴、阳电极物理表面积均为25 cm2×2,阴阳极之间通过钛丝相连,除实验因素外,外接电阻均为1 000 Ω。MFC 均置于25 ℃恒温生化培养箱中运行。阳极液由95% M9培养基和5% LB培养基构成。
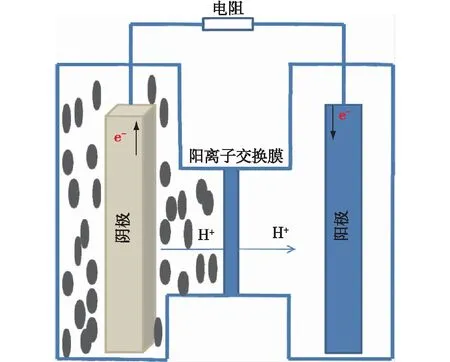
图1 微生物燃料电池原理工作图Fig.1 Mechanism for microbial fuel cell
1.3 实验方法
1.3.1 常见电子介体对大肠杆菌BL21(DE3)的生长抑制实验
常见电子介体对菌的生长抑制情况是通过菌液涂布计数比较得出,具体步骤为:①菌种的液体活化。准备灭菌后的液体LB,以10%的接种量活化从冰箱中保存的大肠杆菌BL21(DE3)菌株,在恒温摇床(200 r/min)中37 ℃培养12 h,待用。②制备含有不同浓度电子介体的LB平板。配制含有不同质量浓度的中性红和亚甲基蓝(0、0.2、0.4、0.6、0.8和1.0 g/L)的LB平板。由于甲基紫精,也叫百草枯,生物毒性大,因此平板制备浓度要低于中性红和亚甲基蓝。配制含有不同质量浓度(0、0.01、0.02、0.03、0.04和0.05 g/L)甲基紫精的LB平板。③菌液涂布计数。将活化后的菌液等量稀释涂布于LB平板上,涂布结束后将平板放置在37 ℃恒温培养箱中培养12 h,然后对平板上长出的大肠杆菌BL21(DE3)菌落进行计数,确定其生长抑制情况。
1.3.2 常见电子介体对大肠杆菌BL21(DE3)MFC产电性能影响
依据电子介体对大肠杆菌BL21(DE3)的生长抑制结果,选择合适的实验浓度,开展同一浓度下不同电子介体对大肠杆菌BL21(DE3)MFC产电性能的影响实验,选择对MFC产电能力提高显著的电子介体后再进行浓度优化实验。
1.4 MFC性能参数测定及计算
1.4.1 电压和电流
电压(U)由山特(深圳)电子有限公司数据采集器每间隔10 min 自动记录储存。电流由I=U/R(R为实际外接电阻)计算得到[21-23]。
1.4.2 电池表观内阻及功率密度曲线
采用稳态放电法测定MFC的表观内阻。分别测量MFC在不同外电阻(5 000、4 000、3 000、2 000、1 000、800、600、400、200、100、50和30 Ω)条件下稳定放电时的外电阻电压,并通过I=U/R得到电流,输出功率(P)是根据P=IU得出[24]。以电流为横坐标,电压为纵坐标,绘制所得曲线为极化曲线。极化曲线是用来表征电压与电流关系的曲线,将极化曲线的欧姆极化区部分数据线性拟合所得斜率即为电池表观内阻。再以电流为横坐标,各外阻条件下产生的功率密度为纵坐标绘制曲线,即得电池功率密度曲线,功率密度曲线是用来表示电流和功率密度关系的曲线[17,22-24]。
1.4.3 循环伏安曲线测定
循环伏安法(CV)使用CHI660D型三电极系统恒电位仪(上海辰华仪器有限公司)进行测定。其中,阳极对应工作电极,阴极对应对电极,Ag/AgCl电极对应参比电极。扫描电压为-1.0~1.0 V,扫描速度为20 mV/s,同时监测电流响应值[17,25-27]。
2 结果与讨论
2.1 常见电子介体对大肠杆菌BL21(DE3)生长抑制情况
人工电子介体虽然能够帮助大肠杆菌BL21(DE3)将电子传递到电极上,但也会对其生长有一定的抑制作用。因此,在进行产电性能影响实验之前,有必要确定所选择电子介体对大肠杆菌BL21(DE3)的生长抑制浓度范围。
考察大肠杆菌BL21(DE3)在含有不同质量浓度的中性红、亚甲基蓝以及甲基紫精的LB平板上的生长情况,结果见图2。

图2 电子介体对大肠杆菌BL21(DE3)生长的影响Fig.2 Effects of electron mediator on the growth of E. coli BL21(DE3)
由图2可知:大肠杆菌BL21(DE3)含有不同浓度的中性红平板上的菌落数分别为100、94、85、79、68和65个。尽管中性红为无毒染料,但是生长抑制实验证明,随着浓度的增加,中性红对大肠杆菌BL21(DE3)生长的抑制也随之增加。可能的原因是中性红延长了菌落生长的时间,因此在24 h内计数出现上述结果,当延长计数时间后,发现高浓度平板上继续会有新的菌落出现。
大肠杆菌BL21(DE3)在不同浓度的亚甲基蓝的LB平板上的生长的菌落数分别为100、30、1、1、1和1 个。当亚甲基蓝的质量浓度大于0.4 g/L时,在24 h内大肠杆菌BL21(DE3)在平板上几乎没有菌落生成,观察生成的菌落形态,发现其菌落大小明显小于低浓度平板上的菌落。说明添加高质量浓度(>0.4 g/L)亚甲基蓝的对大肠杆菌BL21(DE3)生长抑制显著。
大肠杆菌BL21(DE3)在含有不同浓度甲基紫精的LB平板上的生长的菌落数分别为100、55、43、1、1和1个。在质量浓度超过0.03 g/L及以上浓度的甲基紫精LB平板上都只有1个菌落生长,同亚甲基蓝类似,这说明甲基紫精对于大肠杆菌BL21(DE3)生长抑制较明显。
电子介体对于大肠杆菌BL21(DE3)的生长抑制从高到低依次是甲基紫精、亚甲基蓝、中性红。
2.2 常见电子介体对大肠杆菌BL21(DE3)MFC产电性能影响结果
2.2.1 大肠杆菌BL21(DE3)MFC产电性能比较
考虑到未来实验放大要求,所以实验应当筛选合适的电子介体,还必须满足添加量少且提高效果显著的要求,结合菌株生长抑制实验,实验最终确定研究质量浓度为0.02 g/L的中性红、亚甲基蓝、甲基紫精对大肠杆菌BL21(DE3)MFC产电性能的影响,结果如图3~5和表1所示。
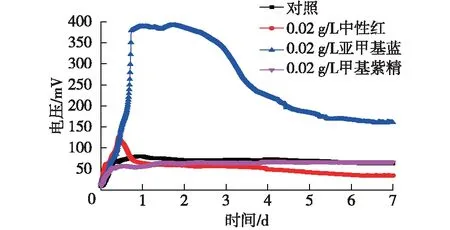
图3 不同电子介体实验组MFC输出电压Fig.3 Voltage output of the MFC with different electron mediator
由图3可知:添加亚甲基蓝对大肠杆菌BL21(DE3)产电性能的提高是最显著的,MFC能够达到的最高稳定电压值为389 mV;添加中性红的实验组,MFC能够达到的最高电压值为130 mV,并且电压峰值(130 mV)只维持了6 h左右;添加甲基紫精的实验组,MFC能够达到的最高稳定电压值只有70 mV,而对照组MFC能够达到的最高稳定电压值为80 mV。亚甲基蓝的输出电压较对照组的提高了386%,添加甲基紫精的实验组输出电压与对照组相比没有提高,中性红组的输出电压提高不显著。

表1 添加常见电子介体各实验组MFC的最大输出功率密度及表观内阻

图4 常见电子介体MFC的功率密度及极化曲线Fig.4 Power density (a) and polarization curve (b) of the MFC
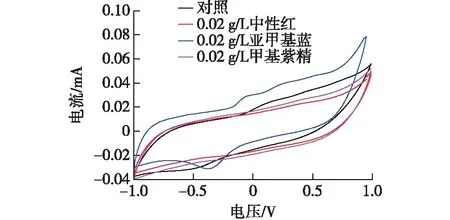
图5 常见电子介体MFC循环伏安曲线Fig.5 Different electron mediator circulation volt-ampere curve
由图4和表1可知:添加亚甲基蓝的实验组产电能力最优,其所测得的最大输出功率密度高达160 mV/m2,而对照组仅为18 mV/m2;甲基紫精组和中性红组的最大输出功率分别为3.8和5.2 mV/m2。对各实验组MFC极化曲线欧姆区进行线性拟合后得到各MFC的表观内阻,其中亚甲基蓝组的表观内阻最低,约为159 Ω;中性红组的表观内阻约为380 Ω;甲基紫精组的表观内阻约为278 Ω,对照组的表观内阻为290 Ω。由此可见,添加亚甲基蓝的表观内阻最小,较对照组降低约52%。
由图5可知:亚甲基蓝实验组测得的氧化还原电流响应值最高,且明显较对照组MFC信号强,中性红次之,甲基紫精与对照组无明显差异。CV分析证明添加亚甲基蓝的MFC组能够提高大肠杆菌BL21(DE3)MFC的产电性能,由此可以确定亚甲基蓝作为电子介体可以增强阳极电极的电化学活性,这与输出电压、功率密度和极化曲线的结论一致。这可能是由于亚甲基蓝具有从细菌细胞膜上高效转移电子的能力。
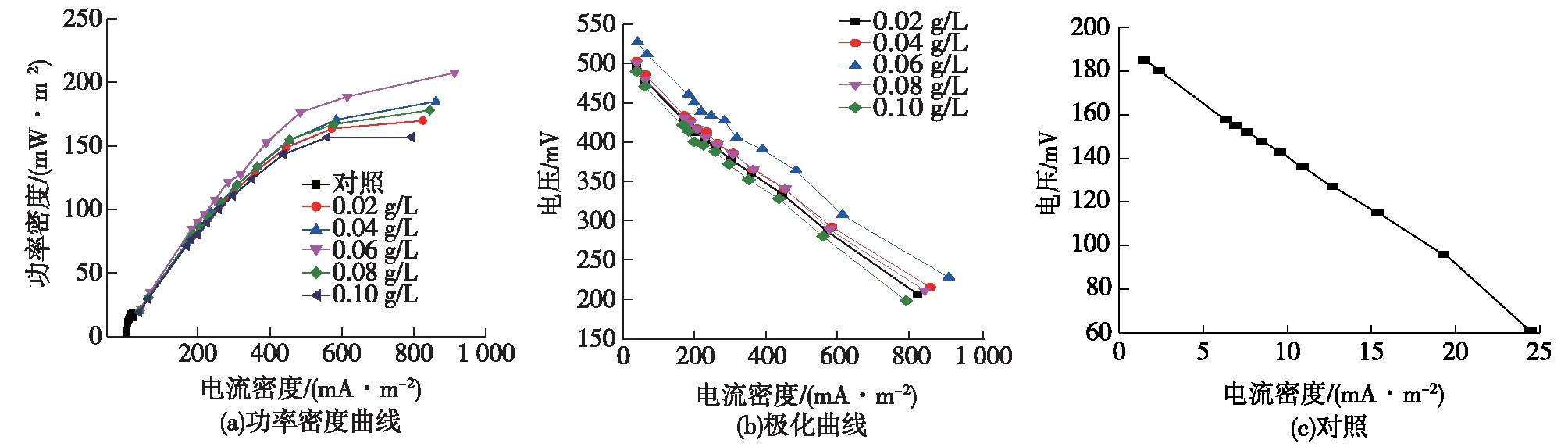
图7 添加不同浓度亚甲基蓝的MFC功率密度及极化曲线Fig.7 Power density (a) and polarization curve of MFC (b) with different concentration of methylene blue
2.2.2 亚甲基蓝浓度优化
在0.02 g/L中性红、亚甲基蓝和甲基紫精作用下,添加亚甲基蓝对大肠杆菌BL21(DE3)的产电能力提高最显著,因此考察不同质量浓度的亚甲基蓝对提高大肠杆菌BL21(DE3)MFC产电性能的影响,结果如图6~8和表2所示。
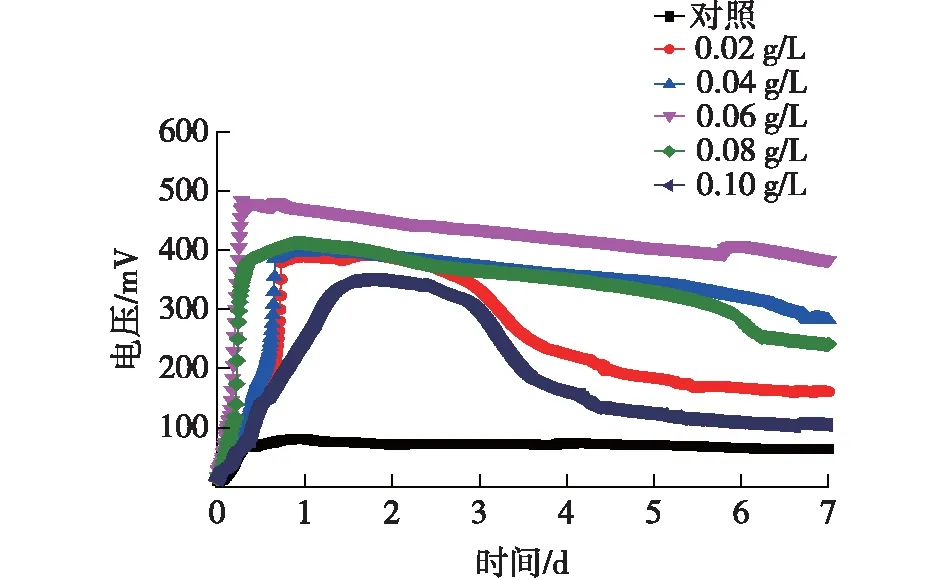
图6 添加不同浓度亚甲基蓝的各实验组MFC输出电压Fig.6 Voltage output of the MFC with different concentration of methylene blue
由图6可知:添加0.02 g/L亚甲基蓝实验组MFC能够达到的最高稳定电压值为389 mV;添加0.04 g/L亚甲基蓝实验组MFC能够达到的最高稳定电压值为380 mV;添加0.06 g/L亚甲基蓝实验组MFC能够达到的最高稳定电压值为500 mV;添加0.08 g/L亚甲基蓝实验组MFC能够达到的最高稳定电压值为375 mV;添加0.10 g/L亚甲基蓝实验组MFC能够达到的最高稳定电压值为300 mV,对照组MFC能够达到的最高稳定电压值为80 mV,分别较对照提高了386%、375%、525%、371%和275%。
由图7和表2可知:添加0.02 g/L亚甲基蓝实验组MFC所获得的最大输出功率密度为160 mV/m2;添加0.04 g/L亚甲基蓝实验组MFC所获得的最大输出功率密度为184 mV/m2;而0.06 g/L亚甲基蓝实验组的产电能力最优,其所获得的最大输出功率密度高达208 mV/m2;添加0.08 g/L亚甲基蓝实验组MFC所获得的最大输出功率密度为178 mV/m2;添加0.10 g/L亚甲基蓝实验组MFC所获得的最大输出功率密度为156 mV/m2,对照组MFC的最大输出功率密度为18 mV/m2。
对各实验组MFC极化曲线欧姆区进行线性拟合得到的各MFC表观内阻结果发现:添加0.02 g/L亚甲基蓝实验组MFC表观内阻为159 Ω,添加0.04 g/L亚甲基蓝实验组MFC表观内阻为153 Ω,添加0.06 g/L亚甲基蓝实验组表观内阻为140 Ω,添加0.08 g/L亚甲基蓝实验组MFC表观内阻为157 Ω,添加0.1 g/L亚甲基蓝实验组MFC表观内阻为172 Ω,对照组的表观内阻为290 Ω,分别比对照组降低45.1%、47.2%、51.7%、45.8%和40.6%。
由图8可知:添加0.06 g/L亚甲基蓝实验组的氧化还原电流响应值最高,之后依次为添加0.04、0.08和0.02 g/L亚甲基蓝的实验组。CV分析证明加入0.06 g/L亚甲基蓝的阳极比其他浓度的亚甲基蓝能够更好地提高大肠杆菌MFC产电性能。输出电压、功率密度及极化曲线和循环伏安扫描等结果表明不同浓度亚甲基蓝中能够提高大肠杆菌MFC产电性能的最佳质量浓度为0.06 g/L。
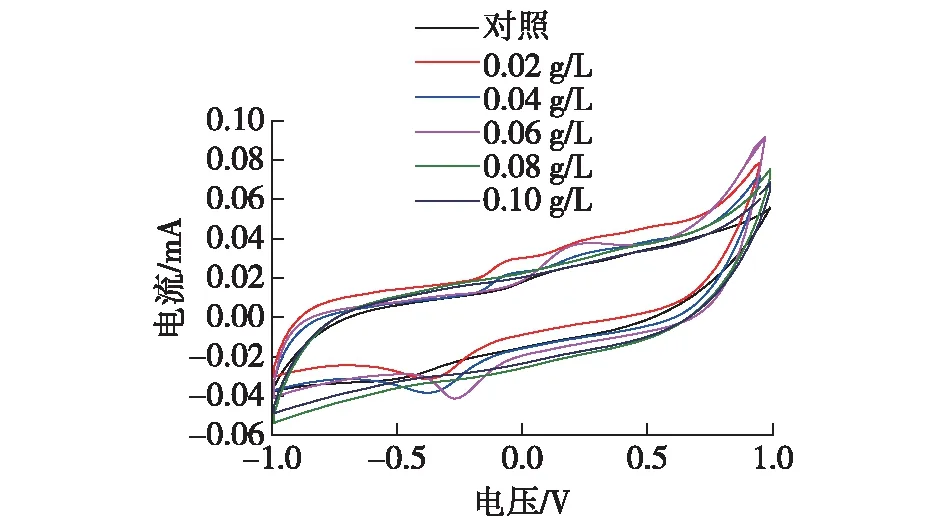
图8 添加不同浓度亚甲基蓝MFC实验组的循环伏安曲线Fig.8 Cyclic voltammogram of the MFC with different concentration of methylene blue

ρ(亚甲基蓝)/(g·L-1)00.020.040.060.080.10Pmax/(mW·m-2)18160184208178156表观内阻/Ω290159153140157172
3 结论
电子介体对于大肠杆菌BL21(DE3)的细胞毒性从高到低依次是甲基紫精、亚甲基蓝、中性红。
比较添加相同质量浓度电子介体检验大肠杆菌BL21(DE3)MFC的产电性能、输出电压、功率密度、极化曲线和CV等,结果表明添加亚甲基蓝对大肠杆菌BL21(DE3)MFC的产电性能提高最为显著。亚甲基蓝的最佳添加质量浓度为0.06 g/L,此时MFC能够达到的最高稳定电压值为500 mV。
