高效液相色谱法对白酒中的L-乳酸和D-乳酸的手性分离和测定
2019-09-28赵振宇李清亮王和玉
江 锋,赵振宇,聂 叶,李清亮,刘 松,王和玉
(贵州茅台酒股份有限公司,贵州仁怀 564501)
乳酸(Lactic acid)学名2-羟基丙酸,结构式为CH3CHOHCOOH,相对分子质量为90.08,由于分子内含有一个不对称碳原子,因此具有旋光异构现象[1],可区分为L-乳酸和D-乳酸,当两者以等比例混合时,即成为内消旋的DL-乳酸。
目前,分离和测定L-乳酸与D-乳酸手性对映体的方法主要包括酶法[2]、气相色谱(GC)[3]、气质联用(GC-MS)[4]、毛细管电泳(CE)[5]、液质联用(LCMS)[6]、手性高效液相色谱法(HPLC)[7]以及柱前衍生将手性对映体改变成非手性物质再用HPLC 测定的方法[8]。不同的方法都有局限性,如酶法测定步骤多,酶易失活,测定误差大;EDTA 定钙法测量误差大,对乳酸的两种对映体无法精确定量,如果采用普通的有机酸色谱柱,是无法区分乳酸的两种对映体的。
自然界中天然的乳酸是L-乳酸,D-乳酸主要通过合成产生。D-乳酸的合成方法可以分为化学合成法、酶法和微生物发酵法。乳酸是白酒中重要的有机酸,其含量的多少对白酒的口味和后味有较大影响,国内暂无白酒中乳酸构型的文献报道。因此,建立能快速、灵敏和高效拆分检测白酒中两种乳酸对映异构体的方法非常必要。
本研究利用手性色谱柱中青霉胺与二价铜离子配位体,对乳酸的两种对映体的络合能力的不同[9],将L-乳酸和D-乳酸进行拆分并定量,研究了该法对于乳酸标准品和酒样样品的乳酸检测重现性,还研究了在白酒中添加L-乳酸和D-乳酸标准品后的检测回收率,最后用该法检测了20 种市售白酒中的L-乳酸和D-乳酸含量。
1 材料与方法
1.1 材料、试剂及仪器
样品:白酒,包括浓香型、酱香型、清香型等市售的白酒20种。
试剂:L-乳酸,色谱纯,98%纯度,Sigma-Aldrich 公司出品;D-乳酸,色谱纯,93%纯度,Sigma-Aldrich 公司出品;异丙醇,天津市科密欧化学试剂开发中心。
仪器设备:超高效液相色谱仪(Agilent 1260 Series)带二极管阵列检测器、手性柱Chirex 3126(D)-penicillami(4.6 mm i.d×250 mm L,5 μm)(美国菲罗门)、分析天平(METTLER TOLEDO XP205)、纯水仪(艾科浦RM-220);Talboys 数显型多管式旋涡混合器(美国);KQ-500DA 昆山超声仪器(昆山舒美);BLC-1玻璃砂芯过滤装置,0.45 μm滤膜(安捷伦,再生纤维素滤膜)。
1.2 试验方法
1.2.1 样品前处理
取1 mL 酒样置于10 mL 离心管中,加入4 mL超纯水,旋涡振荡混匀,经水系0.22 μ m 的微孔滤膜过滤后用于液相色谱测定。
1.2.2 色谱条件
流动相:2 mmol/L 的5%异丙醇流动相溶液配制,称取CuSO4·5H2O 0.500 g,加入50 mL双蒸水溶解,转移至100 mL 的容量瓶中,加入50 mL 的色谱纯异丙醇,再用双蒸水定容至1000 mL,用0.45 μ m孔径的合成纤维素滤膜进行真空超滤,超声波脱气;流动相流速为1 mL/min;柱温30 ℃;二极管阵列检测器,检测波长为254 nm;标准品和样品溶液用前均经过0.22 μm滤膜过滤;进样量为5 μL。
1.2.3 标准曲线的制作
分别准确称取一定量的L-乳酸、D-乳酸标准品,用超纯水溶解并定容于100 mL 容量瓶中,配成L-乳酸、D-乳酸标准液,然后进行稀释,分别配成0.020mg/mL、0.050mg/mL、0.100mg/mL、0.200mg/mL、0.400 mg/mL、0.600 mg/mL、0.800 mg/mL 的标准溶液。上机前经0.22 μ m的微孔滤膜过滤。
1.2.4 定性与定量
将相同色谱条件下的样品色谱图与乳酸标准液色谱图进行对照,根据保留时间确定样品中的L-乳酸、D-乳酸。用外标法定量,计算出样品中L-乳酸和D-乳酸的含量。
1.2.5 精密度试验
取一定浓度的L-乳酸、D-乳酸标准品溶液,连续进样6 次,观察L-乳酸和D-乳酸的保留时间及峰面积,计算RSD值。
1.2.6 重现性试验
取同一个酒样6 份,观察保留时间和峰面积,计算保留时间和峰面积的RSD值。
1.2.7 回收率试验
分别向已知L-乳酸、D-乳酸浓度的酒样中加入3 种浓度的L-乳酸、D-乳酸标准品溶液,取5 μL注入液相色谱仪,重复进样3 次,观察保留时间和分析含量,计算保留时间的RSD 值和含量的回收率。
2 结果与讨论
2.1 手性柱HPLC 法对乳酸标准品与白酒中乳酸的手性拆分和检测
乳酸2种对映体手性拆分HPLC图谱见图1。
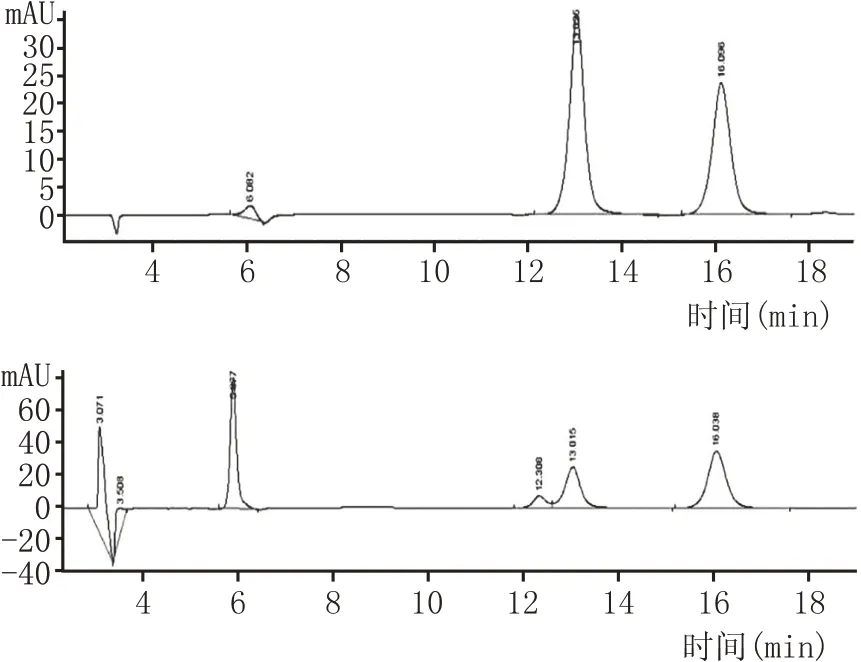
图1 乳酸2种对映体手性拆分HPLC图谱
由图1可知,乳酸对映体L-乳酸的出峰时间约为13.0 min,D-乳酸的出峰时间约为16.0 min,根据乳酸标准品的浓度和峰面积,得L-乳酸标准曲线方程为Y=2.05X+0.673,回归系数R2=0.999;D-乳酸的标准曲线方程为Y=1.633X+0.86,回归系数R2=0.999。式中X 为乳酸浓度(g/L),Y 为乳酸的峰面积。
根据标准曲线方程和图1 的出峰时间与峰面积,可计算L-乳酸和D-乳酸的含量,可知该白酒酒样中以D-乳酸为主,D-乳酸的含量占乳酸总量的86%以上。本研究利用手性柱Chirex 3126 检测L-乳酸和D-乳酸,Chirex 3126 是一种配体交换柱,以固相化与过渡金属离子(Cu2+)配位的配体为固定相,基于流动相中的配体与固定相的配体间交换平衡以及稳定性来分离L-乳酸和D-乳酸[9]。
2.2 精密度试验
对待测L-乳酸、D-乳酸标准品平行测定6 次,结果表明精密度满足分析要求,其结果见表1。
2.3 重复性试验
取酒样1样品,连续取6份,测定L-乳酸、D-乳酸的含量,其结果见表2。
2.4 回收率试验
为了考察测定结果的准确性,进行了回收率的测定,结果见表3。可以看出,L-乳酸的回收率分别为98.47%、100.75%、100.71%,RSD 分别为0.13%、0.59%、0.75%;D-乳酸的回收率分别为107.88%、105.65%、100.1%,RSD 分别为0、0.75%、1.17%。回收率在98.47%~107.88%之间,RSD小于2%,说明该方法测定结果比较可靠。

表1 精密度试验
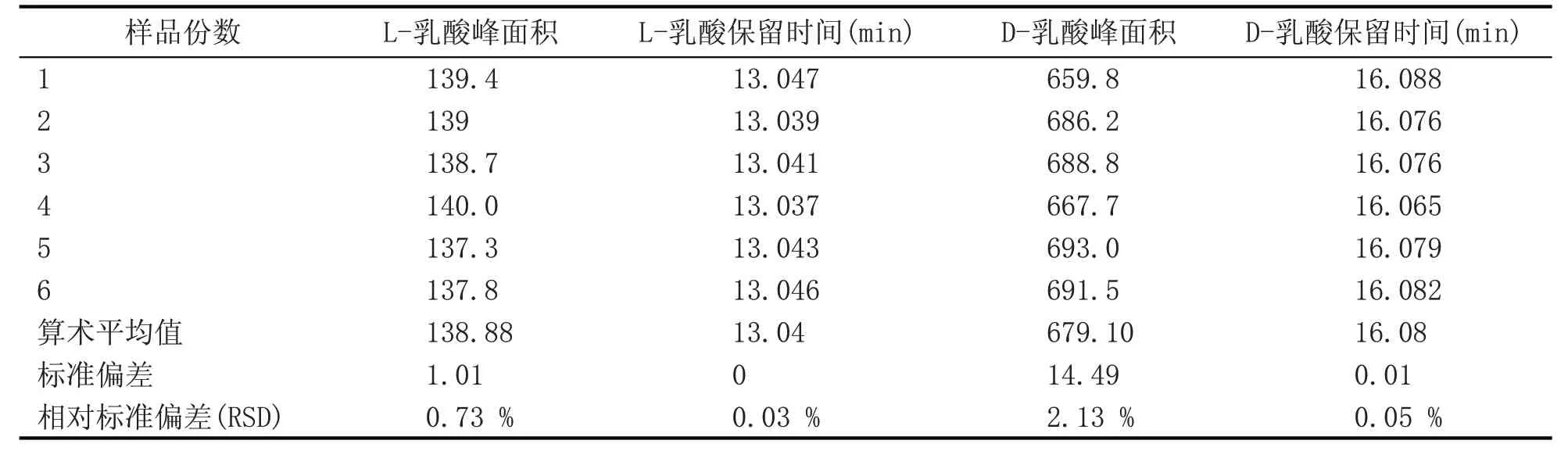
表2 重复性试验
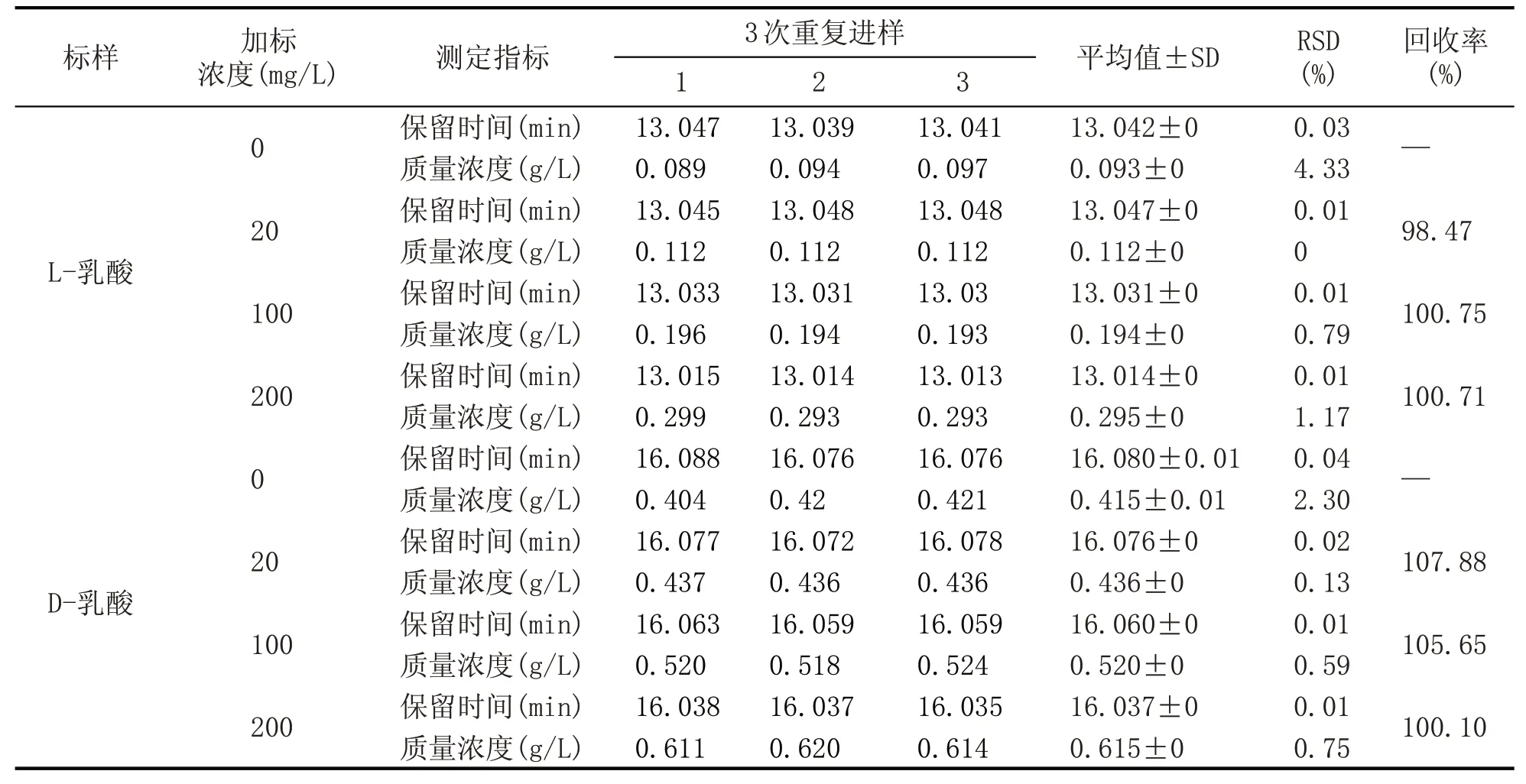
表3 回收率试验
2.5 最低检出限的测定
用L-乳酸、D-乳酸标准溶液进行逐步稀释后,进行HPLC 分析,以3 倍信噪比计算最低检出限为5 mg/L。
2.6 利用手性柱HPLC 法检测白酒产品中L-乳酸和D-乳酸的含量
利用手性柱HPLC 方法测得白酒样品JY1—JY20 中L-乳酸和D-乳酸含量,酒样包括浓香型、酱香型、清香型等市售的白酒。白酒中L-乳酸和D-乳酸的含量见表4。
结果表明,大部分酒样里D-乳酸明显高于L-乳酸,只有JY10、JY13、JY16 的L-乳酸与D-乳酸含量相近。
3 结论
采用高效液相法和手性柱可以将白酒中的L-乳酸和D-乳酸分开,L-乳酸和D-乳酸的标准曲线在0.020~0.800 g/L 范围线性良好,两者的线性相关系数都为0.999。白酒中L-乳酸和D-乳酸的回收率分别是98.47%~100.75%和100.10%~107.88%。该方法操作简便,精密度和准确度高,适用于白酒中L-乳酸和D-乳酸的测定。
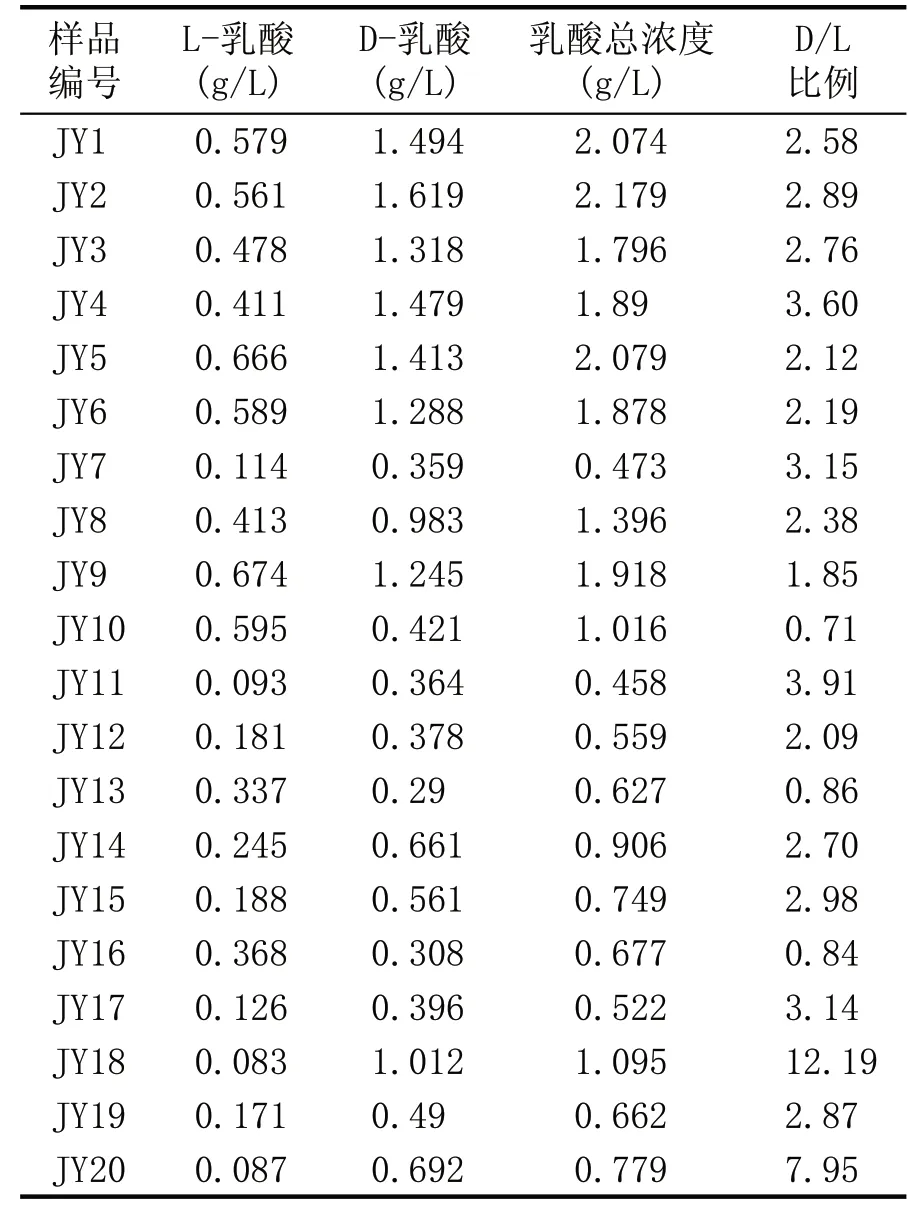
表4 20种市售白酒的L-乳酸和D-乳酸含量
