应用生物信息学定向筛选产角鲨烯的微生物研究分析
2019-09-28陈良强胡光源王和玉
陈 笔,陈良强,胡光源,王和玉,王 莉,杨 帆
(贵州茅台酒股份有限公司技术中心,贵州仁怀 564500)
角鲨烯是一种高度不饱和直链三萜烯类化合物,具有抗癌、抗肿瘤、抗氧化等生物活性[1],广泛应用于医药、食品和化妆品等工业领域[1-2]。角鲨烯虽广泛存在于动物[3]、植物和微生物[4]体内,但是深海鲨鱼的肝油目前仍是角鲨烯最为主要的来源。通过筛选高产或基因改造微生物菌株[5]发酵获取角鲨烯具有生产周期短、不受时间和地域限制、易操作等优点[6-7],为解决角鲨烯资源的匮乏问题开辟了一条新途径。
目前,文献中筛选高产角鲨烯菌株的方法主要是通过非目标性的大量筛选,然后再测定角鲨烯的产量。例如,王晓龙[6]从红树林的腐叶中分离得到高产角鲨烯菌株Pseudozymasp.SD301,Bhattacharjee 等[9]从蜂蜜中分离得到产角鲨烯德氏孢圆酵母,Brid 等[10]在汉逊德巴利酵母、深红螺菌和构巢曲霉等微生物中检出角鲨烯。同时,随着微生物基因组、转录组和蛋白质组等数据的日益丰富[11],大量数据表明微生物有非常丰富的次级代谢产物合成基因簇,运用任何一种单一的培养基均无法完全反映菌株的代谢产物生产能力[12]。为激活沉默基因,充分挖掘微生物产角鲨烯的潜力,需根据不同微生物的特点尝试多种培养基,并不断优化培养基配方[13-14]。这种传统非目标性的筛选和培养优化方法周期较长,并且检测角鲨烯的方法较为复杂,会耗费大量的时间、精力与资金[15-16]。因此,利用生物信息学提高筛选效率和挖掘微生物产角鲨烯的潜力有着重要的经济意义。
茅台酒作为酱香型白酒典型代表,存在多种生物活性成分,而角鲨烯就是其中之一[8],这表明茅台酒酿造过程中可能存在具有合成角鲨烯能力的微生物。因此,利用生物信息学数据库对角鲨烯的合成代谢途径及关键基因进行分析,再与茅台酒酿造过程中的优势酵母代谢通路数据进行比对,筛选获得具有完整角鲨烯合成代谢通路的候选菌株;并根据候选菌株产角鲨烯代谢通路的关键酶特性和底物要求,优化候选菌株的培养基,激活沉默基因,充分挖掘微生物产角鲨烯的潜力。
1 材料与方法
1.1 材料、试剂及仪器
候选菌株:扣囊复膜孢酵母(SaccharomycopsisfibuligerasMT001)、粟酒裂殖酵母(Schizosaccharo-mycespombe MT002)和库德里阿兹威氏毕赤酵母(Pichia kudriavzeviiMT003),均从茅台酒的酿造过程中分离,且已全基因组测序并保藏于茅台微生物菌种库。本文报道的3 株酵母的原始序列数据已保存在中国科学院北京基因组研究所大数据中心(BIGD)的GSA 档案中,登记号为CRA001596,可在http://bigd.big.ac.cn/gsa上公开查阅。
试剂:角鲨烯(色谱纯),美国sigma 公司;葡萄糖、蛋白胨、酵母膏、磷酸氢二钾、氯化钠、硫酸镁、硫酸锰、乙酸和无水乙醇均为分析纯,国药集团。
仪器设备:KS4000i 摇床,德国艾卡公司;380R离心机,德国Hettich 公司;LRH-250 恒温培养箱,上海飞越实验仪器有限公司;IEC61010-1 超净工作台,新加坡艺思高科技有限公司;CL-32L 全自动蒸汽灭菌器,日本ALP 株式会社;G1888A-7890A-5975C 顶空-气相色谱-质谱联用仪(HS-GC-MS),美国Agilent公司。
1.2 试验方法
1.2.1 代谢通路与关键酶查询
利用KEGG pathway 数据库查询角鲨烯代谢途径,并明确其代谢通路及参与反应所需关键催化酶。
1.2.2 候选菌株关键酶基因的完备性
基于3 株候选菌株全基因组测序数据及其预测的氨基酸序列,再与KEGG 数据库对比,确定每株候选菌株产角鲨烯关键酶基因的完备性。
1.2.3 候选菌株的发酵验证
发酵培养基:称取葡萄糖50 g,蛋白胨20 g,酵母膏10 g,磷酸氢二钾1 g,氯化钠1 g,硫酸镁0.1 g,硫酸锰0.05 g于容器中,加入1 L纯水,溶解后分装到250 mL三角瓶,每瓶100 mL,于121 ℃灭菌15 min。挑取1 环候选菌株的菌苔于发酵培养基,以30 ℃、180 r/min 培养16 h 作为种子液。用血球计数板对种子液的酵母数量进行计数,再将种子液接种于上述发酵培养基进行培养,接种后培养液中的菌落数量约为1×106cfu/mL,培养条件为30 ℃、180 r/min振荡培养5 d。每组设3个平行。
1.2.4 基于生物信息学激活沉默基因
配制好发酵培养基,柠檬酸在灭菌前加入,乙酸在灭菌后加入,使发酵培养基中乙酸和柠檬酸终浓度为0、2 g/L、5 g/L、10 g/L、15 g/L、30 g/L、40 g/L和60 g/L,每组设3 个平行。接种候选菌株的种子液到发酵培养基,接种后培养液中的菌落数量约为1×106cfu/mL,培养条件为30 ℃、180 r/min 振荡培养5 d。
1.2.5 角鲨烯含量测定
参照文献[8],采用顶空-气相色谱-质谱联用仪(HS-GC-MS)测定发酵液中角鲨烯的含量。具体方法为:将发酵液8000 r/min 离心10 min 后进行液液微萃取(LLME),取上清液10 mL,加适量Na-Cl过饱和,再加1 mL的戊烷-乙醚(1∶3)萃取剂,迅速旋紧瓶盖,涡旋振荡1 min,静置分层后,吸取有机相0.5 mL 于液相小瓶中,氮吹浓缩至0.1 mL,吸取1 μL 浓缩有机相进GC-MS 分析。采用标准谱图比对和标准品比对,对目标物进行定性,内标标准曲线法进行定量。
2 结果与分析
2.1 角鲨烯代谢途径的关键酶
通过查询KEGG pathway 数据库,发现角鲨烯的骨架成分合成主要有两条代谢途径:一是MVA(mevalonate pathway,甲羟戊酸)途径,该途径在20世纪60年代被发现[17],主要存在于高等真核生物和个别细菌中[18];另一条是MEP/DOXP(1-deoxy-Dxylulose-5-phosphatepathway,脱氧木酮糖-5-磷酸)途径,其主要存在于细菌和原生动物中[19],在高等动物和真菌中不存在,但在绿色植物中,MEP/DOXP 和MVA 途径共存于分离的细胞室中。这两条代谢通路所需关键酶如图1所示。
其中,MVA 途径是以乙酰Co-A 为底物,乙酰乙酰CoA 经过HMG-CoA 酶催化缩合形成3-羟基-3 甲 基 戊 二 酰-CoA[20],HMG-CoA 随 后 被HMG-CoA 还原酶还原为甲羟戊酸[21],再经过一列系列生化反应,甲羟戊酸被缩合形成法尼基焦磷酸(FPP)[20];最后,角鲨烯合成酶将FPP 催化合成角鲨烯[22],途径中的关键酶如表1 所示。MEP 途径是发生在质体内,以丙酮酸或3-磷酸甘油醛为底物,经过中间体2-甲基赤藓醇磷酸(MEP)和1-脱氧木酮糖-5-磷酸(DOXP),再合成异戊烯焦磷酸(IPP)和DMAPP[23],之后合成角鲨烯的反应通路与MVA 途径相同[24]。
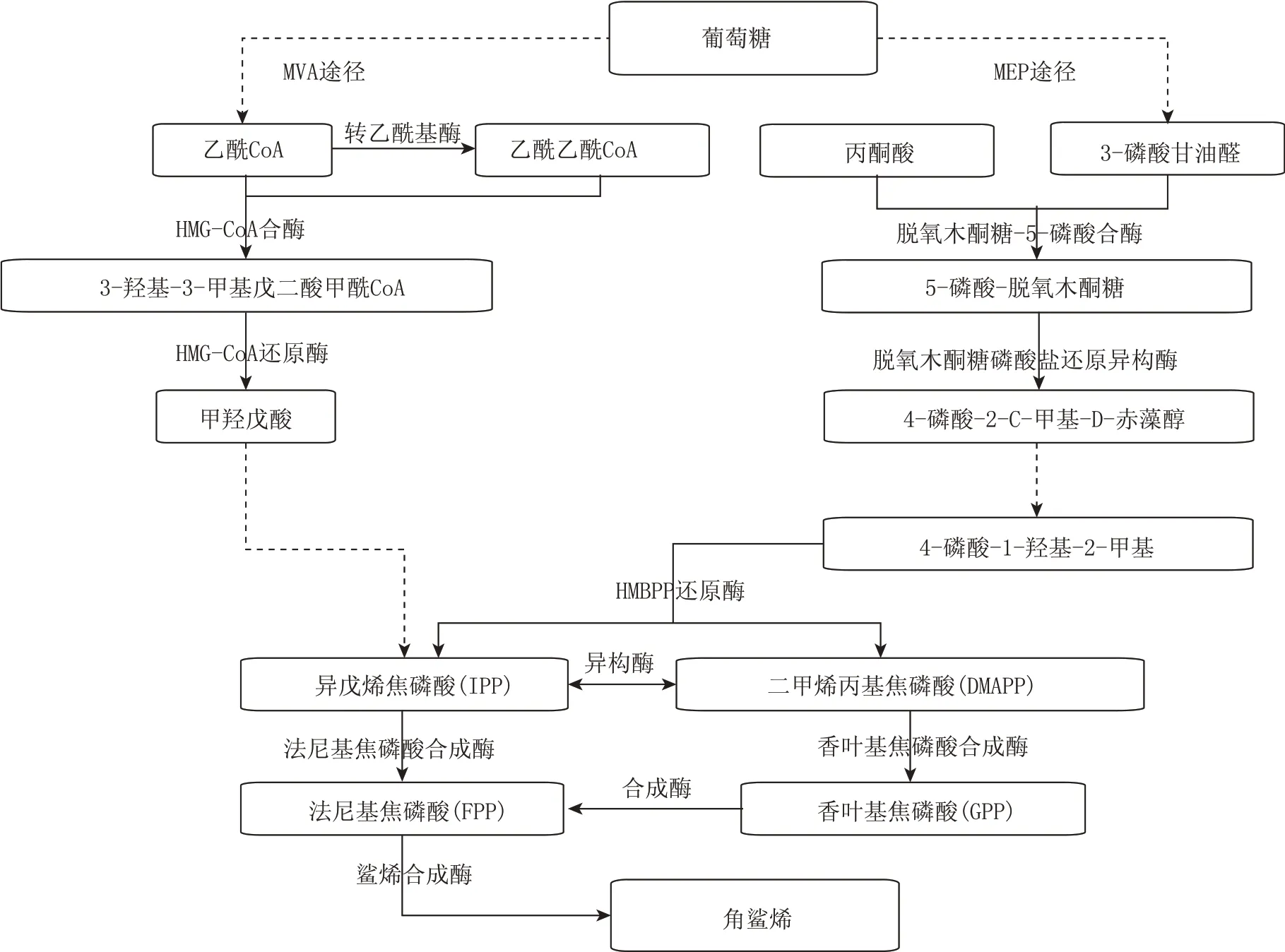
图1 角鲨烯MVA和MEP产生途径示意图
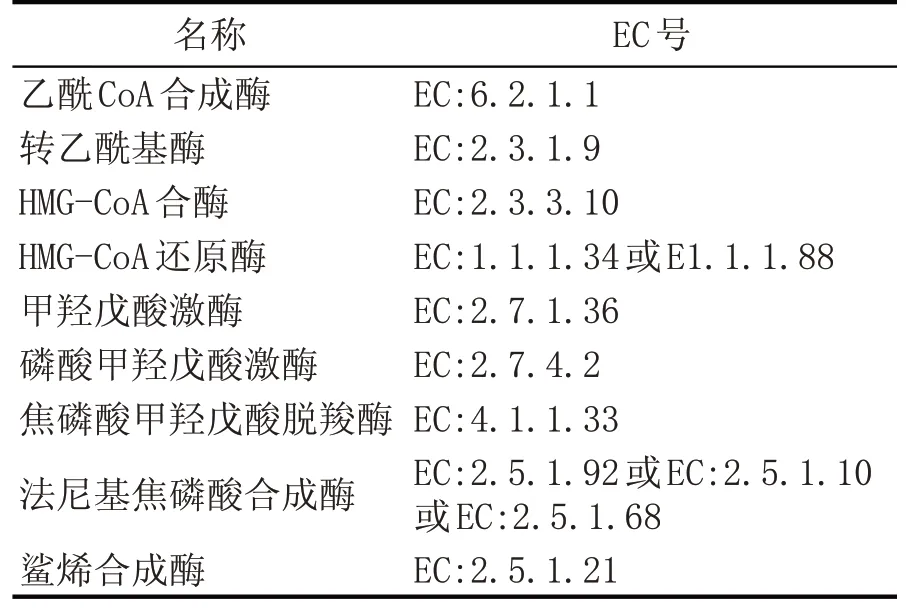
表1 MVA途径合成角鲨烯所需要的关键酶类
2.2 候选菌株关键酶基因的完备性
根据相关研究报道[1],真核微生物的角鲨烯合成能力高于原核微生物,因此本研究选取了茅台酒酿造过程中的3 株优势酵母作为研究对象[25]。将3株候选酵母菌株的KEGG 功能注释分析结果与角鲨烯代谢通路相关信息进行比对,结果如表2 所示:发现只有粟酒裂殖酵母(S.pombeMT002)具有完备的MVA 途径合成角鲨烯所需关键酶基因;扣囊复膜孢酵母(S.fibuligerasMT001)缺少法尼基焦磷酸合成酶基因,库德里阿兹威氏毕赤酵母(P.kudriavzeviiMT003)缺少磷酸甲羟戊酸激酶和法尼基焦磷酸合成酶基因。与其他研究结果相同[1,26],全基因组解析结果显示,酵母等真核微生物具有MVA途径,不具备MEP途径[19]。
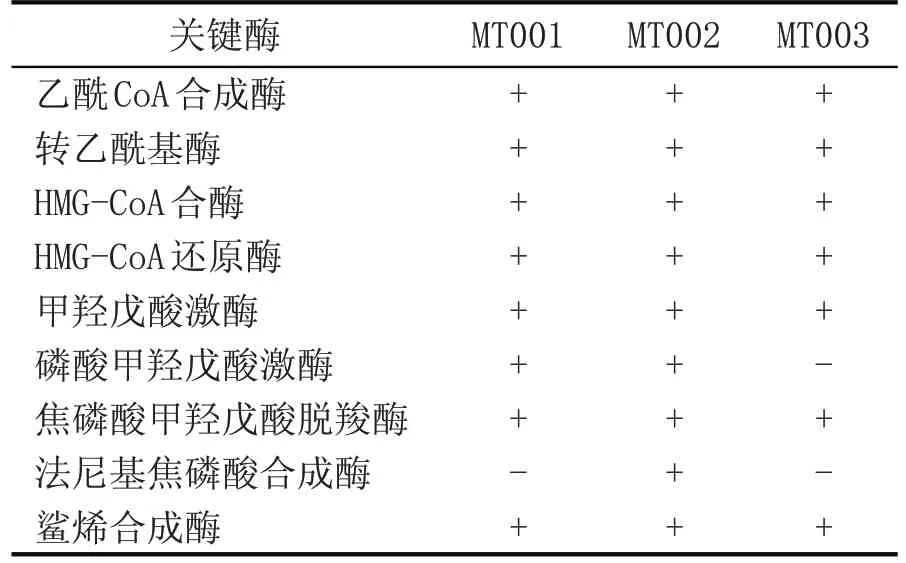
表2 候选菌株MVA途径关键酶基因注释情况
2.3 候选菌株的产角鲨烯发酵验证
为验证候选菌株产角鲨烯的能力,并与生物信息学的预测结果进行比对,本研究以常规的葡萄糖为碳源,接种粟酒裂殖酵母(S.pombeMT002)、扣囊复膜孢酵母(S.fibuligerasMT001)和库德里阿兹威氏毕赤酵母(P.kudriavzeviiMT003)进行发酵,但在所有发酵液中均未检测到角鲨烯(表3)。在MT001 和MT003 发酵液中未检测到角鲨烯,可能是因为缺少角鲨烯合成关键酶基因,与生物信息学分析结果相一致;而粟酒裂殖酵母MT002 没有合成角鲨烯,则可能是相关代谢基因没有表达,因此需要进一步调整培养条件对其验证。

表3 发酵液中候选菌株的角鲨烯产量 (μg/g干菌体)
2.4 基于生物信息学激活沉默基因
基于粟酒裂殖酵母全基因组数据的KEGG 功能注释分析,其代谢途径中合成乙酰CoA的最直接底物有柠檬酸和乙酸,因此本研究在发酵培养基中添加了乙酸和柠檬酸以促进乙酰CoA的产量。
对不同酵母菌株在不同有机酸浓度下发酵液中的角鲨烯含量进行分析,结果显示,角鲨烯含量分布存在较大差异。从表4 可以看出,添加柠檬酸均不能促进3 株酵母生成角鲨烯,但在添加一定的乙酸(5~15 g/L)后,可以在粟酒裂殖酵母MT002的发酵液中检测出疑似角鲨烯的物质,经过对发酵液中目标峰进行标准品比对及NIST 谱库比对,确认检测到角鲨烯(图2)。
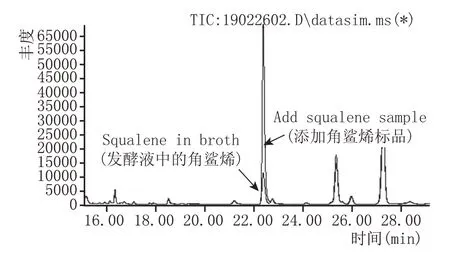
图2 液液微萃取结合GC-MS检测到发酵液中角鲨烯的总离子流图

表4 不同乙酸和柠檬酸浓度下菌株产角鲨烯的含量 (μg/g干菌体)
当乙酸浓度低于2 g/L 时,发酵液中检测不到角鲨烯;当乙酸浓度为10 g/L 时,角鲨烯含量最高可达14.71 μg/g菌体;当乙酸浓度升到15 g/L时,角鲨烯含量开始降低,可能是高浓度的乙酸会抑制菌体生长[27],进而减少角鲨烯的合成。由于茅台酒发酵过程中最主要的有机酸是乳酸和乙酸[25],因此酒醅中的乙酸可能是促进茅台酒中角鲨烯合成的重要条件。
目前,提高角鲨烯的产量主要通过培养基和发酵条件的优化,以及使用工程改造菌株。例如,通过添加盐酸特比奈芬或茉莉酸甲酯来抑制角鲨烯单加氧酶的活力[28];或者通过调节氧浓度、接种量、氮源和发酵时间等来提高酿酒酵母的角鲨烯产量[29-30]。生物信息学显示,大部分微生物都有非常丰富的次级代谢产物生物合成基因簇,但在传统培养条件下不能被表达,被称为沉默基因[12]。本研究筛选得到的粟酒裂殖酵母虽然具有完备的角鲨烯MVA 代谢通路所需关键酶基因,但在含葡萄糖等常规营养成分的培养基中不能合成角鲨烯;在培养基中加入特定浓度的乙酸之后,成功使粟酒裂殖酵母合成了角鲨烯。推测可能是因为乙酸刺激了粟酒裂殖酵母表达乙酸-CoA连接酶,激活了这个沉默基因,提高了乙酰CoA的浓度,从而提高了角鲨烯产量。虽然粟酒裂殖酵母在乙酸刺激下的应激反应和代谢调控变化还需要进一步的研究确定,但就我们所知,目前尚未有使用本研究思路以及通过添加乙酸促进角鲨烯合成的研究报道。
3 结论
本研究利用生物信息学数据库对角鲨烯的合成途径及关键基因进行分析,并结合已测序完成的白酒酿造过程中微生物全基因组数据,定向筛选出具有完备角鲨烯代谢途径关键酶基因的粟酒裂殖酵母;然后根据其代谢途径特征,添加特定浓度的乙酸促进角鲨烯合成,推测这可能是激活了沉默基因。本研究提供了一条挖掘目标菌株产角鲨烯潜力的新思路,避免了因非目标性试验耗费的时间、精力和金钱。虽然最终得到的菌株角鲨烯产量与文献报道存在差距[31],但本研究方法具有一定的针对性和有效性,对其他微生物代谢产物的挖掘也同样具有重要的借鉴意义。
