注射鼠神经生长因子对痉挛型脑瘫运动功能的改善作用
2019-09-24牛国辉朱登纳袁向东宋舜意赵云霞王明梅
牛国辉 朱登纳 袁向东 宋舜意 王 军△ 王 鑫 赵云霞 王明梅
1)郑州大学第三附属医院儿童康复科,河南 郑州 450052 2)商丘市第一人民医院儿内科,河南 商丘 476000 3)新乡市中心医院康复科,河南 新乡 453000
脑性瘫痪是儿童主要致残性疾病之一,其中痉挛型脑瘫所占比例最多(60%~70%)[1-3]。鼠神经生长因子(nerve growth factor,NGF)作为神经营养因子家族的成员之一,在神经系统中分布广泛,具有营养神经元、保护和修复受损神经的作用[4-6]。本课题组三家医疗机构(郑州大学第三附属医院、新乡市中心医院、商丘市第一人民医院)在传统康复疗法的前提下,评价不同途径注射鼠神经生长因子改善痉挛型脑性瘫痪的运动功能情况及用药安全性。
1 资料与方法
1.1一般资料选择2013-09—2015-09在郑州大学第三附属医院、商丘市第一人民医院、新乡市中心医院门诊和住院的痉挛型脑性瘫痪患儿。本研究通过郑州大学第三附属医院医学伦理委员会批准。共招募符合纳入标准及排除标准的患者900例,随机分为对照组、穴位注射组、肌内注射组3组。最后864例完成临床试验和随访,脱失36例,其中不愿继续接受治疗9例,失访14例,应用其他神经营养药物或中药制剂13例。
864例患者中,对照组296例,穴位注射组281例,肌内注射组287例。3组性别、年龄、GMFCS分级及治疗前Gesell评分、粗大运动功能评估(GMFM)、改良Ashworth肌张力评定、表面肌电图(sEMG)测定等方面差异均无统计学意义(P>0.05),具有可比性。见表1。
1.2纳入标准(1)年龄9个月~3岁,性别不限;(2)符合2007年《中华物理医学与康复杂志》发表的《小儿脑瘫的诊断标准和分型》中的诊断条件及分型;(3)粗大运动功能分级系统(GMFCS)分级Ⅰ~Ⅲ级;(4)同意按期进行观察者;(5)已阅读受试者须知,同意并签署书面知情同意书。
1.3排除标准(1)目前正参加其他临床研究或在近4周内参加过其他临床研究的患者;(2)4周内正接受其他神经营养药物治疗的患者;(3)进行性疾病所致的中枢性瘫痪及正常儿一过性运动落后;(4)严重的肝肾疾病、血液系统疾病、自身免疫病、慢性严重感染等;(5)预计在3个疗程的完整观察期内按时复诊有困难的患者;(6)研究者认为不宜入选的其他原因。
1.4退出与脱落标准如发生下列情况之一,须退出本观察:(1)观察过程中,患者不愿继续接受治疗(包括疗效不佳、对治疗产生的不良反应无法耐受),其结果将纳入安全性分析;(2)合用其他神经营养药物或中药制剂者;(3)发生严重不良事件;(4)连续失访2次者。
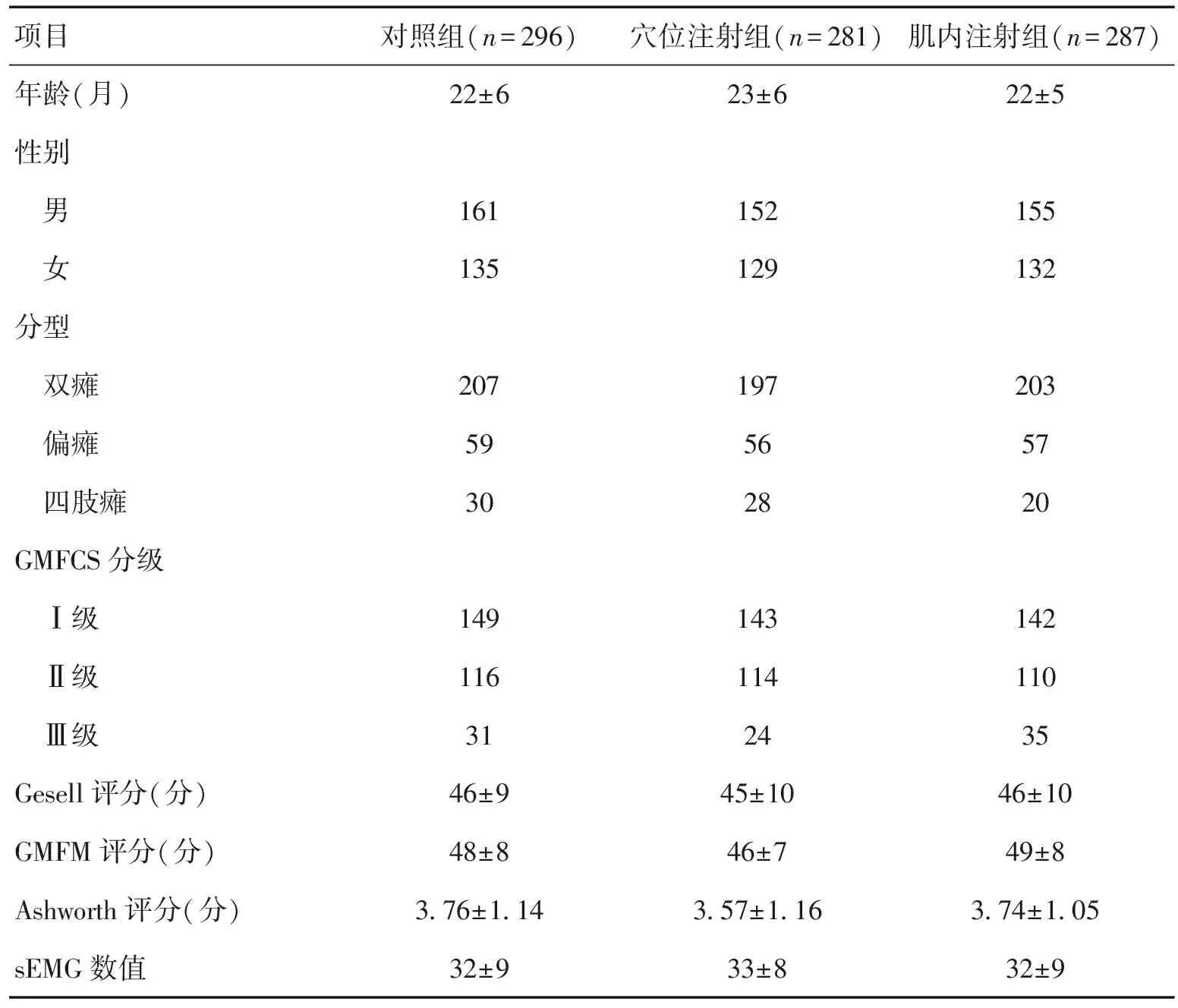
表1 3组一般资料对比
1.5治疗方法对照组仅予常规综合康复治疗(包括功能训练、推拿、物理因子治疗等),3周一疗程,每疗程结束后休息2周,共治疗3个疗程。每疗程结束后进行评估。
穴位注射组在常规综合康复治疗的基础上,每周二、四、六采用穴位注射鼠神经生长因子(NGF由厦门北大之路生物工程有限公司生产,商品名;恩经复,规格18 μg≥9 000 AU)1支,用灭菌用水4 mL稀释;穴位选取方法:NGF应用于患儿头皮运动区(上点在前后正中线的中点向后移0.5 cm处,下点在眉枕线和鬓角发际前缘相交区,上下两点的连线即为运动区),选取左、右各2个共4个穴位,每个穴位注射药物1 mL;每疗程10次,每疗程结束后休息2周,开始下一疗程,共3个疗程。
肌内注射组在常规综合康复治疗的基础上每周二、四、六肌内注射鼠神经生长因子。每疗程10次,每疗程结束后休息2周,开始下一疗程,共3疗程。
1.6疗效评估与观察指标
1.6.1 主要评估指标:采用盖泽尔发育量表(Gesell)评定大运动功能的改善情况,粗大运动评定量表(Gross Motor Function Measure-88,GMFM-88)评定下肢运动功能。
注射前及注射后第1、2、3疗程采用改良的Ashworth痉挛评定量表评定肌张力(0:无肌张力的增高;Ⅰ:肌张力稍有增高,受累部位在关节活动范围内被动屈曲,或伸展时出现“卡住”和“突然释放”感,或在关节活动范围的最后出现最小的阻力;Ⅰ+:肌张力增高,表现为轻微的卡住感,且在剩余的关节活动范围内<1/2关节活动度(range of motion,ROM)一直伴有最小的阻力;Ⅱ:在大部分关节活动范围内肌张力明显增高,但受累部位被动活动容易;Ⅲ:肌张力严重增高,被动活动困难;Ⅳ:受累部位僵直于屈曲或伸展位。为统计方便,将量表中等级评价的0、Ⅰ、Ⅰ+、Ⅱ、Ⅲ、Ⅳ级分别定为1、2、3、4、5、6分。
治疗前及治疗后第1、2、3疗程进行表面肌电图(surface electromyography,sEMG)数值测定,以对治疗前后肌张力改善情况进行量化比较。患儿俯卧位,放松状态下,双下肢伸直,将电极片置于肌腹,测量静息状态、被动状态、主动状态下数值,因患儿易哭闹紧张,配合度较差,故采用被动状态关节牵伸下sEMG数值评估肌张力情况。
1.6.2 安全性观察指标:血常规、尿常规、血生化(肝肾功能)、心电图、不良事件记录。

2 结果
2.13组治疗前后各时间点Gesell评分比较3组治疗前Gesell评分差异无统计学意义(F=0.40,P>0.05);3组在提高Gesell评分方面差异有统计学意义(F=6.49,P=0.003);分组因素与治疗前后Gesell评分有交互作用(F=105.36,P<0.001)。穴位注射组、肌内注射组治疗后各时间点评分均高于对照组,治疗后穴位注射组各个疗程评分均高于肌内注射组(F=88.24、154.58、234.31,P<0.05)。见表2。
2.23组治疗前后各时间点GMFM评分比较3组治疗前GMFM评分无明显差异(F=1.78,P>0.05);3 组治疗后GMFM分值均提高,且3组在提高GMFM评分方面差异有统计学意义(F=7.64,P=0.001);分组因素与治疗前后GMFM评分有交互作用(F=83.82,P<0.001)。穴位注射组、肌内注射组治疗后各时间点评分均高于对照组,穴位注射组治疗后各个疗程评分均高于肌内注射组(F=121.38、161.65、287.97,P<0.05)。见表3。
2.33组治疗前后各时间点Ashworth评分比较3组治疗前Ashworth评分无明显差异(F=2.55,P>0.05);3 组Ashworth分值均降低,且3组在降低Ashworth评分方面差异有统计学意义(F=10.71,P<0.001);分组因素与治疗前后Ashworth评分有交互作用(F=11.39,P<0.001)。穴位注射组、肌内注射组治疗后各时间点评分均低于对照组,穴位注射组治疗后各个疗程评分均低于肌内注射组(F=211.93、425.44、138.58,P<0.05)。见表4。
2.43组治疗前后各时间点sEMG评分比较3组治疗前sEMG评分无明显差异(F=0.36,P>0.05);3组sEMG评分均随着治疗时间延长而降低(F=361.50,P<0.001),3组在降低sEMG评分方面差异有统计学意义(F=5.95,P=0.004);分组因素与治疗前后sEMG评分之间有交互作用(F=11.75,P<0.001)。穴位注射组、肌内注射组治疗后各时间点评分均低于对照组,穴位注射组治疗后各个疗程评分均低于肌内注射组(F=111.03、130.40、177.41,P<0.05)。见表5。

表2 3组治疗前后Gesell评分比较分)
注:与对照组比较,aP<0.05,bP>0.05;与肌内注射组比较,CP<0.05,dP>0.05

表3 3组治疗前后各时间点GMFM评分比较分)
注:与对照组比较,aP<0.05,bP>0.05;与肌内注射组比较,CP<0.05,dP>0.05

表4 3组治疗前后各时间点Ashworth评分比较分)
注:与对照组比较,aP<0.05,bP>0.05;与肌内注射组比较,CP<0.05,dP>0.05
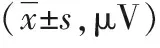
表5 3组治疗前后各时间点sEMG数值比较
注:与对照组比较,aP<0.05,bP>0.05;与肌内注射组比较,CP<0.05,dP>0.05
2.5药物安全性评估对血常规、尿常规、肝肾功能、心功能均无影响;用药前后心电图无明显变化。用药过程中未见发热、皮疹、头痛、头晕、恶心、胸闷、心悸、腹痛等不良反应。穴位注射组注射部位轻微红肿3例,肌内注射组注射部位轻微红肿2例,均未做特殊处理,1 d左右消失。
3 讨论
脑性瘫痪是导致儿童残障的主要疾患之一,我国<14 岁儿童中,脑瘫患儿约500万,按每年1 600万新生儿数量估算,每年新发生脑瘫约4万[7-12]。脑性瘫痪主要表现为运动障碍,伴或不伴有感知觉和智力缺陷,运动发育和姿势异常是脑瘫的核心表现,同时运动障碍与智力残疾和癫痫相关联[1,13-15],临床康复治疗和研究应以解决脑瘫患儿的运动功能障碍为主[2,16-20]。脑瘫患儿中痉挛型占60%~70%[3,21-23]。因患儿均有不同程度的运动障碍,参与社会活动受到一定限制,所以提高痉挛型脑瘫儿童的运动功能,可以改善大部分脑瘫儿童的生存质量。
根据小儿的生长发育特点,其生后至3岁以前是大脑发育较快的时期,在这段时间内神经细胞体积增大,树突增多,神经髓鞘化逐步完成,所以脑的可塑性较大[24-30]。如果在这一时期给予恰当的药物治疗,并结合综合的康复治疗,可能促进脑的快速发育[31-36]。依据脑的可塑性理论,对已经出现异常表现的高危儿进行早期康复干预可以改善姿势和纠正异常运动模式,避免或减轻继发性残损的发生,从而降低脑瘫功能障碍程度[37-40]。本研究发现,3岁以下脑瘫患儿给予恰当的综合康复治疗,均能降低肌张力、改善患儿的运动功能,所以临床工作中要尽早准确诊断;一旦确诊脑瘫,应尽早开始康复治疗。
NGF是神经系统最重要的生物活性分子之一,是由118个氨基酸组成的蛋白质,对调节神经元的生长、发育、分化、存活及损伤神经的再生修复具有重要作用和临床意义[4-6,41-43]。NGF在神经损伤后可以表达上调,但这种表达持续时间较短,所以表达量不足以全面而持久保护受损神经[7,44-45]。因此,外源性供给NGF是促进神经修复的一个途径。鼠神经生长因子和人类的神经生长因子同源性高达90%以上,所以在功能上也极其相似[8,46-47]。YIN等[9]发现,鼠神经生长因子能够促进神经胶质纤维酸性蛋白的表达,从而在神经损伤的修复中发挥作用。鼠神经生长因子促进认知功能和运动功能恢复的原因之一可能是促进海马区神经元的修复及前体细胞分化,从而加快损伤神经功能的重建,建立持久的神经通路。恩经复(注射用鼠神经生长因子)是从鼠颌下腺分离提取出的一种高活性蛋白,具有较高的药物经济性,具有三高特点:高纯度、高比活性、高稳定性。以往研究[16-17]发现,NGF能明显改善脑瘫患儿神经系统症状,改善预后,但缺乏大样本的数据支持。故本研究联合省内3家大型三甲医院进一步研究NGF的有效性及安全性,并确定较优的注射途径,统一诊断标准和分型,统一疗效判定标准和观察指标,在对照组综合治疗的基础上,分为穴位注射组与肌内注射组,结果发现,鼠神经生长因子穴位注射组与肌内注射组在降低肌张力(Ashworth评分、sEMG数值)、提高运动功能(Gesell评分、GMFM评分)方面均优于对照组。
穴位是中医学中的瑰宝,不同的穴位刺激具有不同的功效。头为诸阳之首,是脏腑经络汇聚之所,头部穴位注射可激发经气、疏通经络、补益气血、强筋健骨,从而纠正患儿肢体畸形及异常姿势,促进肢体功能的恢复。穴位注射是一种目前广泛应用的中西医结合的治疗方法,具有穴位刺激兼有药物的双重作用。鼠神经生长因子穴位注射,一方面刺激穴位,疏通经络;另一方面利用药物的作用,增强疗效。两者联合应用可使早期受损的脑细胞得到及时的修复,使神经纤维的髓鞘化、突触结构及网络功能发育成熟。本研究发现,在降低肌张力(Ashworth评分、sEMG数值)、提高运动功能(Gesell评分、GMFM评分)方面,鼠神经生长因子穴位注射组优于肌内注射组。
临床试验中未发现肝、肾、心脏等功能损害。本研究在用药过程中也未见头痛、发热、皮疹等不良反应。仅出现注射部位轻微红肿,其中穴位注射组3例,肌内注射组2例,说明鼠神经生长因子临床应用安全性较好。
对于3岁以下痉挛型脑瘫患儿,穴位注射鼠神经生长因子配合功能训练、推拿等综合康复治疗,能够有效降低肌张力,提高运动功能,疗效优于其他两种康复治疗方案,且不良反应少,安全性高。
