超声耦合不同酸度柠檬酸脱苦溶液对苦杏仁品质特性的影响
2019-09-23史芳芳张清安
史芳芳,张清安
超声耦合不同酸度柠檬酸脱苦溶液对苦杏仁品质特性的影响
史芳芳,张清安
(陕西师范大学食品工程与营养科学学院,西安 710119)
【】探究超声耦合不同pH柠檬酸溶液脱苦对苦杏仁颜色等品质特性的影响;利用相关性分析明确各指标间的关系,以简化脱苦酸溶液对苦杏仁品质的评价指标;运用多元数据处理对不同酸度脱苦溶液进行分类,为科学合理选择脱苦溶液从而减少苦杏仁营养及感官品质损失提供理论依据。以苦杏仁为研究对象,首先利用高效液相色谱仪、分光光度计、质构仪等仪器对苦杏仁的质构、β-葡萄糖苷酶活性、苦杏仁苷和水分含量等进行测定,并评定脱苦后杏仁的感官特性。同时,测定脱苦溶液中总酚、蛋白质、还原糖、可溶性固形物的含量,并采用单因素方差分析、相关性分析对测定结果进行显著性和相关性分析。利用主成分分析(PCA)、聚类分析(CA)等多元数据处理方法,对6种不同酸度脱苦液中相关数据进行综合分析。与未脱苦杏仁相比,6种不同酸度脱苦溶液处理后,脱苦杏仁的颜色、硬度、脆性、咀嚼性、回复性、胶着性及感官评价结果均存在显著差异,且脱苦杏仁中水分含量增多,β-葡萄糖苷酶活性变化显著。当脱苦柠檬酸溶液pH为5时,苦杏仁脱苦所需时间最短,仅需90 min,且苦杏仁中各营养物质损失较少、口感也较好。通过相关性分析可知,各指标间具有一定的相关性。PCA、CA的分析结果一致,即二者均可将6种脱苦溶液分为3大类,且同一大类中各脱苦溶液之间的相关理化指标差异不显著。综合分析,pH为5的柠檬酸溶液可以作为超声快速脱除苦杏仁苦味的较优脱苦溶液,这样既可以加速苦杏仁脱苦,又能减少苦杏仁中营养物质的流失,最大程度保持苦杏仁固有的口感特性,可为苦杏仁的产业化快速脱苦提供有力支撑。
苦杏仁;脱苦溶液;质构;感官评定;主成分分析;聚类分析
0 引言
【研究意义】苦杏仁属蔷薇科李属李亚科杏属植物的种子[1-2],含苦杏仁苷约为0.15%—5.5%[3],油脂(45%—67%)[4]、蛋白质(25%—27%)[5]、糖类、粗纤维、维生素及多种微量元素等[6],具有很高的营养和经济价值[7-8]。中国苦杏仁的年产量可达2.5×104t[9],居世界首位。苦杏仁苷是苦杏仁中的重要功能成分之一,其本身无毒,但在酸、酶及加热等条件下极易发生水解产生苯甲醛和氢氰酸等产物,而氢氰酸是一种对人体有极大潜在危害的剧毒物质[10],因此脱苦已成为苦杏仁加工的必经工序。传统的脱苦工艺多以水或柠檬酸溶液作为脱苦溶剂,经长时间浸泡使苦杏仁苷溶出或分解,从而达到脱苦目的,但存在能耗大、时间长等弊端。同时,脱苦过程中,苦杏仁中大量的蛋白质、糖类等物质也会随苦杏仁苷溶到脱苦溶液中,造成苦杏仁中营养物质的大量损失[11]。柠檬酸作为食品添加剂,在食品工业中常用做风味调节剂、护色剂等[12],使用柠檬酸水溶液对苦杏仁进行脱苦一方面不会因柠檬酸迁移至苦杏仁中而引起脱苦杏仁的食用安全性问题;另一方面,苦杏仁苷在酸性条件下相对较为稳定,有利于后续对其进行回收;同时,少量苦杏仁苷降解的氢氰酸在酸性条件下也易挥发或者发生水解反应转化为无毒物质甲酸[13]。此外,真空[14]、微波[15]、超声[16]等技术被报道用于苦杏仁的辅助快速脱苦,也取得了一定的脱苦效果。脱苦杏仁作为苦杏仁加工的主要中间商品——“光中杏仁”,其本质是经脱苦、干制后的杏仁,目前市场占有率大概在70%以上,其主要消费形式是加工杏仁浆、杏仁油茶或经复水制作凉拌菜。作为一种商品,光中杏仁的颜色、口感等是评价其品质和价格的重要因素,而脱苦过程对苦杏仁的颜色、口感、品质形成具有重要影响。但当前无论是传统的水或柠檬酸溶液脱苦,还是超声等辅助快速脱苦,都缺少对脱苦杏仁质构、感官及其与杏仁中部分理化指标相关性的系统研究。这已成为亟待解决的制约苦杏仁加工提质增效的关键技术瓶颈之一。【前人研究进展】范学辉等[17]对苦杏仁脱苦方法进行了综述,并对各种脱苦方法的优缺点进行了比较;SILEM等[18]通过数学模型研究了苦杏仁脱苦过程中苦杏仁苷及其风味变化;许绍惠等[19]采用酶解法对山杏仁脱苦,发现其可溶性糖含量和粗纤维等物质的含量略有减少;姜伟等[20]综述了山杏仁油的理化性质及其在生物燃料、医药和食品等方面的综合开发应用;SONG等[11]对苦杏仁传统脱苦后脱苦水中理化指标的变化进行了研究;李军等[13]研究了浓度为0.24 g∙L-1的柠檬酸溶液对苦杏仁进行真空脱苦;朱蓓薇等[21]分别用10%氯化钠、0.1%柠檬酸和0.15%亚硫酸钠为脱苦溶剂优化了苦杏仁的脱苦工艺。但上述报道多是针对传统脱苦工艺所开展的相关研究。【本研究切入点】笔者课题组前期初步研究表明,超声波可以极大缩短苦杏仁的脱苦时间,而且不同溶液脱苦对苦杏仁的口感等特性有较大影响,甚至有些脱苦溶液会使杏仁变得无法食用(如用pH为2的柠檬酸溶液或者乙醇溶液),但其原因尚不明确。【拟解决的关键问题】拟采用现代分析手段对苦杏仁的颜色、质构、苦杏仁苷和β-葡萄糖苷酶等进行测定,并对脱苦杏仁进行感官评价;同时测定脱苦溶液中总酚、蛋白质、还原糖、可溶性固形物等含量,最后对测定结果进行显著性和相关性分析,从而找到影响脱苦杏仁口感的关键因素,为苦杏仁的产业化快速脱苦提供依据。
1 材料与方法
试验于2018年3—10月在陕西师范大学食品工程与营养科学学院进行。
1.1 材料与仪器
1.1.1 材料与试剂 苦杏仁:2017年7—9月采收,购于陕西省西安市西北药材市场;β-葡萄糖苷酶试剂盒:购于Beijing Solarbio Science &Technology Company;柠檬酸:食品级,西安晶博试剂有限公司;氢氧化钠、碳酸钠、丙三醇:分析纯,天津天力化学试剂有限公司;牛血清蛋白、考马斯亮蓝G250:分析纯,国药集团化学试剂有限公司;3,5-二硝基水杨酸:分析纯,上海科丰实业有限公司;葡萄糖:分析纯,天津市泰兴试剂厂;盐酸:分析纯,洛阳昊华化学试剂有限公司;福林酚(Folin- Phenol):分析纯,Sigma公司;没食子酸、苦杏仁苷标准品(98.42%):色谱纯,成都曼思特生物科技有限公司;甲醇(99.9%):色谱纯,Fisher Scientific公司;试验所用水为纯净水,购于陕西娃哈哈乳品有限公司。
1.1.2 主要仪器设备 超声波多频清洗机:SB- 500DTY型,宁波新芝生物科技股份有限公司;电子天平:HANGPING JA 2003型,上海仪器仪表厂;紫外可见色谱检测器:UV230Ⅱ型,大连伊利特分析仪器有限公司;色谱柱温箱:ZW230Ⅱ型,大连伊利特分析仪器有限公司;色谱高压恒流泵:P230Ⅱ型,大连伊利特分析仪器有限公司;反相液相色谱柱:TC-C18(250 mm×4.6 mm,5 μm),安捷伦科技有限公司;全自动色差计:SC-80C型,北京康光光学仪器有限公司;质构仪(物性测试仪):TA.XT.Plus型,英国Stable Micro System公司;pH计:PHS-3C型,上海仪电科学仪器股份有限公司;鼓风干燥箱:101型,北京科伟永兴仪器有限公司;紫外可见分光光度计:TU-1810型,北京普析通用仪器有限公司;阿贝折射仪:2WAJ型,上海光学仪器一厂。
1.2 方法
1.2.1 样品前处理 称取大小均匀、颗粒饱满、无病虫害的苦杏仁适量,按料液比1﹕10(g∙mL-1)加入100℃的水,浸泡5 min后捞出,迅速揉搓去皮即得脱皮苦杏仁,一部分用作原样,另一部分作为后续试验样品[17]。
1.2.2 配制不同pH的脱苦溶液 配制pH为2、3、4、5、6、7的柠檬酸水溶液各5.0 L。
1.2.3 样品制备 精确称量360.0000 g脱皮苦杏仁于烧杯中,按料液比1﹕12(g∙mL-1)加入配制好的柠檬酸溶液(pH 2)4 320 mL,进行超声脱苦(超声温度55℃、频率59 kHz、功率300 W)[22],间隔取样,每次取样30 g苦杏仁和360 mL脱苦溶液,直至脱苦完成(苦杏仁中苦杏仁苷残留量低于0.91 mg∙g-1时便尝不出苦味[23]),随后取部分样品进行质构测定,其余样品于-20℃保存备用。其余不同pH(3、4、5、6和7)的柠檬酸溶液耦合超声脱苦试验按上述操作进行。最终得到6组脱苦杏仁样品,供后续试验。
1.2.4 脱苦杏仁颜色指标测定 采用SC-80C型全自动台式色差计对脱苦杏仁进行测定,采用*、*、*,△E色值表示。
1.2.5 脱苦杏仁质构测定指标及参数设置 测定参数指标包括硬度、脆性、附着性、弹性、黏聚性、胶着性、咀嚼性和回复性等。参数设置详见表1。

表1 物性测试仪的参数设置
1.2.6 脱苦杏仁感官评定[24-25]为提高鉴评的科学性,所选感官鉴评人员须经过培训,并且拥有良好的食品专业素养。鉴评前3 d不可食用辛辣食物,鉴评过程中每位鉴评人员单独评定,并做到每个样品评定结束后漱口,休息2 min后继续下一样品。感官评价方法详见表2。
1.2.7 脱苦后杏仁中水分含量的测定 采用GB 5009—2016中的直接干燥法。
1.2.8 脱苦杏仁中β-葡萄糖苷酶活力的测定 按照β-葡萄糖苷酶试剂盒说明书进行。
1.2.9 脱苦溶液中总酚含量测定 采用Folin-Ciocalteu比色法(FC法)[26]。
1.2.10 脱苦溶液中蛋白质含量测定 采用考马斯亮蓝G250法[11]。
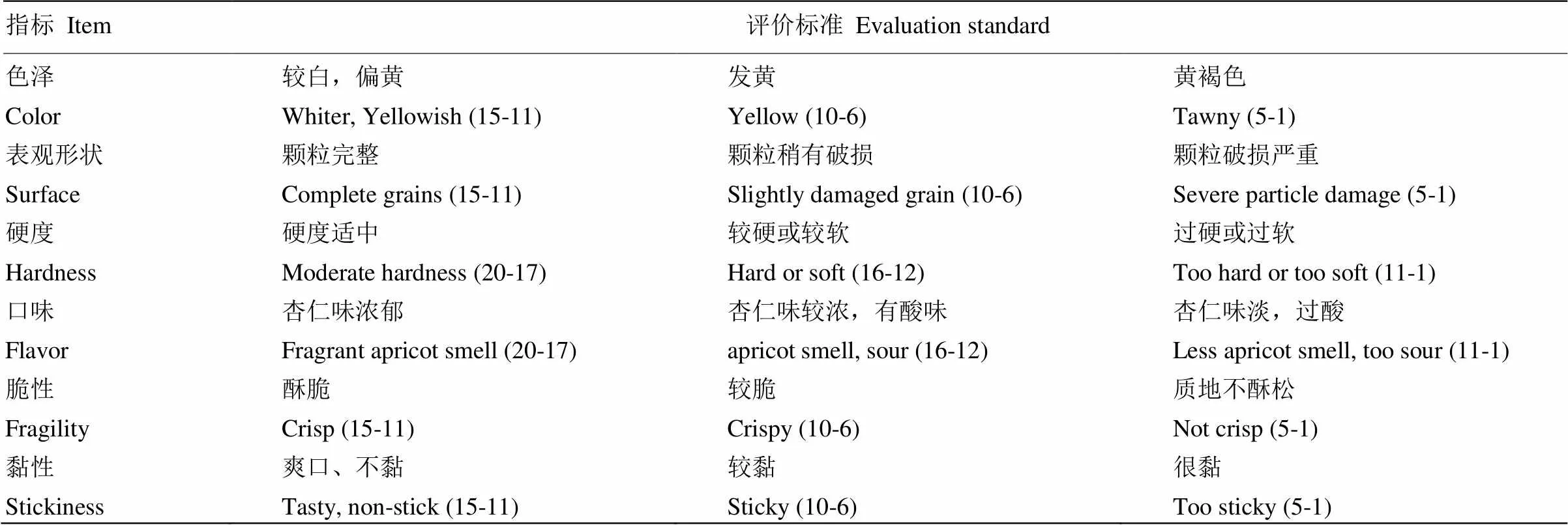
表2 苦杏仁感官评价表
1.2.11 脱苦溶液中还原糖含量测定 采用3,5-二硝基水杨酸比色法[11]。
1.2.12 脱苦溶液中可溶性固形物的测定 使用阿贝折射仪测定。
1.3 数据分析
以上所有指标测定均重复3次,测定结果用“平均值±标准差”表示。数据显著性、相关性分析、主成分分析和聚类分析均采用SPSS 20.0进行,取<0.05为显著相关,<0.01为极显著相关。此外,采用Excel、Origin2017进行相关图表的绘制。
2 结果
2.1 超声耦合不同pH柠檬酸溶液脱苦对苦杏仁苷的影响
由图1可知,以不同pH柠檬酸水溶液作为脱苦液,经超声诱导脱苦后,苦杏仁苷含量均呈现下降趋势,先急剧降低随后平缓下降。可能原因是最初时间内苦杏仁中苦杏仁苷含量高,浓度梯度大使苦杏仁苷溶出较快;随着苦杏仁苷在苦杏仁中含量的减少以及脱苦溶液中含量的增加,浓度梯度减小从而降低了苦杏仁苷的溶出速率。与传统的热水脱苦法相比,超声波耦合柠檬酸溶液脱苦可以明显加速苦杏仁苷的溶出和降解,从而将原有的6—7 h脱苦时间缩短到2 h以内[16-17,27]。另外,超声介导下脱苦溶剂的pH不同,苦杏仁脱苦所需时间也不同;最长时间为105 min,此时柠檬酸水溶液的pH为6;当pH为4和5时,苦杏仁脱苦所需时间最短,仅需90 min。脱苦时间根据高效液相色谱所测定的苦杏仁苷量确定,当脱苦杏仁中苦杏仁苷残留量低于0.91 mg∙g-1时即为脱苦完成[23]。苦杏仁在pH为5左右的脱苦溶液中脱苦较快,这与相关文献报道基本一致[28]。
2.2 超声耦合不同pH柠檬酸溶液脱苦对苦杏仁颜色的影响
从图2可看以出经过不同pH柠檬酸水溶液耦合超声脱苦处理后的苦杏仁颜色差异不大,表面变化也不明显。由表3可以看出,*值均在90以上,且不同酸液处理之间变化不显著,表明脱苦杏仁的亮度受酸液的影响较小;*为红绿值,正值表示红色,负值表示绿色,脱苦杏仁的*值全为正,表明脱苦杏仁的颜色略微偏红;*为黄蓝值,正值表示黄色,负值表示蓝色,*值全为正值,表明脱苦后苦杏仁颜色偏黄,这与图2肉眼所能看到的结果基本一致。△E为色差综合偏差量,一般△E大于3意味着该颜色的差异可以被人眼直接识别,表3中脱苦杏仁的色差综合偏差量均大于3,而且不同处理之间也有一定差异,说明不同酸液耦合超声脱苦对苦杏仁颜色值有一定影响。与传统热水脱苦结果相比,有明显差异,传统脱苦过程由于时间较长,因此颜色比较白[27]。
2.3 超声耦合不同pH柠檬酸溶液脱苦对苦杏仁品质特性的影响
2.3.1 对脱苦杏仁质构的影响 食品质构影响其食用时的口感质量,是评价食品品质的重要指标。质构仪可对食品的质构特性做出科学、全面的评价,其评价指标主要包括硬度、脆性、附着性、弹性、黏聚性、胶着性、咀嚼性和回复性等8项。本研究对超声耦合不同pH柠檬酸溶液脱苦的杏仁颗粒进行了质构测定,从表4可以看出,不同酸液脱苦对苦杏仁的脆性、咀嚼性有显著影响,大于对脱苦杏仁硬度、胶着性、附着性、弹性、黏聚性和回复性等的影响。食品的脆性直接反应口感,也直接影响食品的硬度、咀嚼性和黏聚性。上述结果表明,超声耦合不同pH柠檬酸溶液脱苦时,酸度会对苦杏仁的质构产生直接影响,进而影响脱苦杏仁的口感,最终影响其食用性和商品价值特性。

A、B、C、D、E、F分别表示pH为2、3、4、5、6、7时柠檬酸水溶液耦合超声脱苦图。不同小写字母表示差异显著(P<0.05)。下同

表3 超声耦合不同pH柠檬酸溶液脱苦后杏仁色值的比较
同列不同小写字母表明不同品种之间差异显著(<0.05)。下同
Different lowercase letters in the same column mean significant differences (<0.05). The same as below

图2 超声耦合柠檬酸溶液脱苦后苦杏仁表观颜色
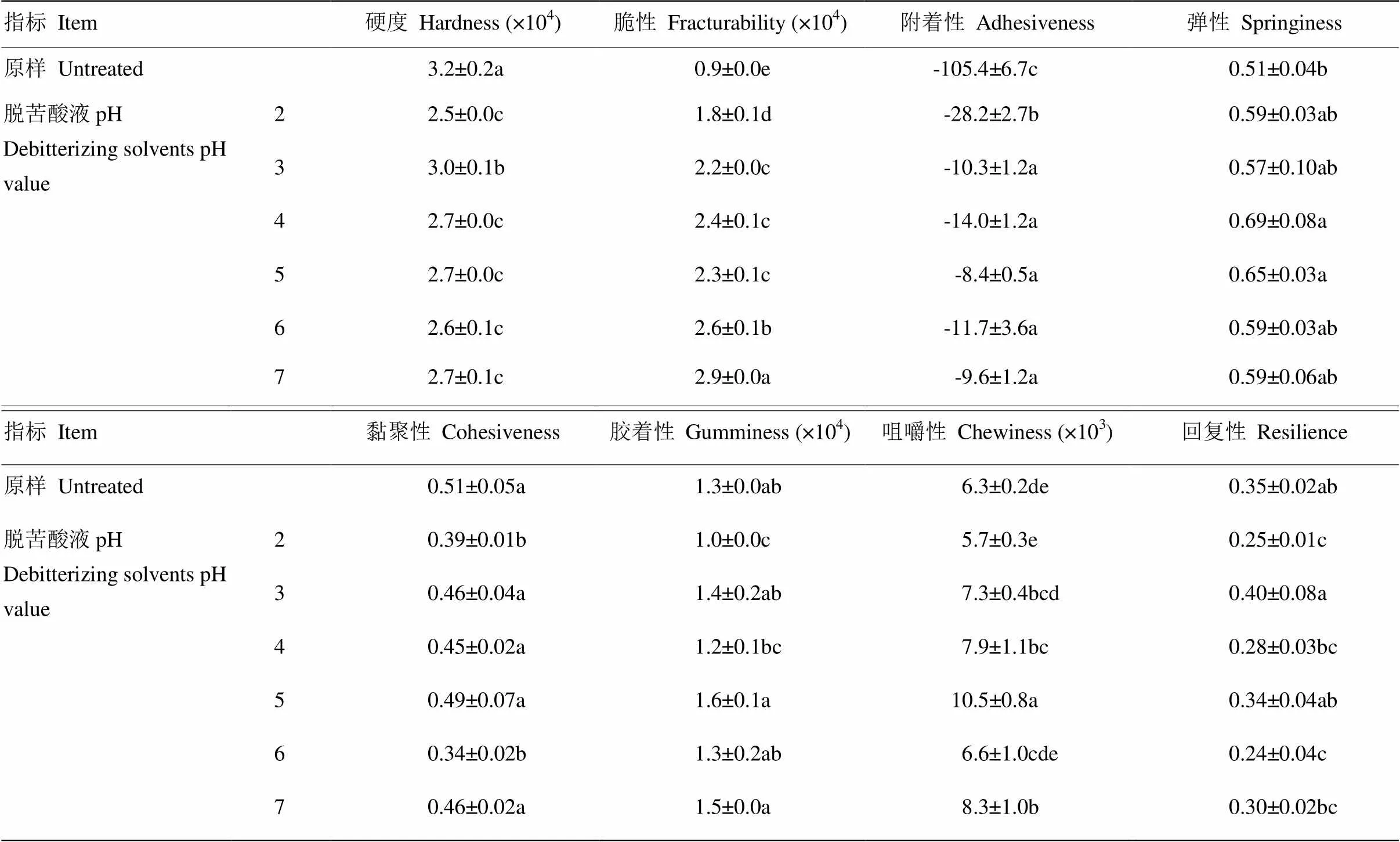
表4 超声耦合不同pH柠檬酸溶液脱苦对苦杏仁质构的影响
2.3.2 对脱苦杏仁的感官评定 以表2为标准,分别对脱苦杏仁的色泽、表观形状、硬度、口味、黏性和脆性等进行感官评定。由图3感官鉴评结果可以看出,超声耦合pH为5的柠檬酸溶液脱苦后苦杏仁色泽最好,pH为6时苦杏仁的色泽最差;经pH为6、7的脱苦溶液脱苦后,苦杏仁表面有破损,表观形态较差;经pH为4、5的脱苦溶液脱苦后,苦杏仁硬度适中;经pH为2的脱苦溶液脱苦后苦杏仁过软。当pH为2、3的脱苦溶液处理后苦杏仁变酸,杏仁味弱,口感较差,导致脱苦后苦杏仁质地不酥脆。对于黏性而言,脱苦后苦杏仁黏性评分均高于原样,可能是脱苦使苦杏仁中水分含量增多所致。经综合评价,pH为5的柠檬酸水溶液耦合超声脱苦后苦杏仁口感最好,pH为2时苦杏仁口感最差。

A:色泽 Color;B:表观形状 Surface;C:硬度 Hardness;D:口味 Flavor;E:脆性 Fragility;F:黏性 Stickiness;G:总分 Total score
2.3.3 对脱苦杏仁及脱苦溶液中部分理化指标的影响 由图4-A可知,经过脱苦后杏仁中水分含量较原样均有显著增多,说明在脱苦过程中苦杏仁中自由水含量增多;而含水量的增加,使苦杏仁中的苦杏仁苷更易溶出,同时也会造成苦杏仁中营养物质例如蛋白质、还原糖等的流失。传统脱苦过程中,除去水分外,苦杏仁的质量损失量在14%左右[27]。同时,了解水分含量的变化也为脱苦杏仁的后续加工如干制以及计算比较物质的干基含量等提供理论依据和基础数据。β-葡萄糖苷酶是一种重要的苦杏仁苷酶,苦杏仁苷在该酶的作用下逐步降解,从而脱除苦味,因此,β-苦杏仁苷酶活力的大小直接影响苦杏仁的脱苦效率[28-32]。从图4-B可以看出,与原样相比,pH为4—6时,β-葡萄糖苷酶活力较高,pH为2时β-葡萄糖苷酶活力最低,不利于苦杏仁的脱苦。脱苦过程中,酶活力一方面受酸度的影响,另一方面也会受到超声的影响[31-32]。从图4-C可以看出,各脱苦溶液中均含有一定量的酚类物质,即苦杏仁在脱苦过程中受到酸和超声复合作用会造成酚类物质的溶出,且pH为3时苦杏仁中酚类物质流失最多,pH为6时次之。但无论如何,超声耦合酸溶液脱苦所造成的酚类物质的损失都低于传统的脱苦方法[27]。苦杏仁中含有25%—27%的蛋白质,可作为日常饮食中优质蛋白质的来源[26,33-34]。从图4-D可以看出,脱苦液pH为2、3时,脱苦溶液中蛋白质含量较高;而pH为4—7时,蛋白质含量较低,说明超声耦合pH为2和3的酸液脱苦时对杏仁中蛋白质影响最大,脱苦溶液中蛋白质含量较高,苦杏仁中蛋白质损失较严重,对杏仁品质影响也较大,但优于传统脱苦效果[27]。上述结果与陈申如等[32]对鱼肉蛋白质溶解性的研究基本一致。由图4-E脱苦溶液中还原糖含量可以看出,随着柠檬酸溶液pH的增加,脱苦液中还原糖的含量也呈不断增加的趋势,即苦杏仁中还原糖的损失在增加,且pH在5—7时,还原糖流失最严重。可溶性固形物指能溶于水的化合物,包括糖、酸、维生素、矿物质等,由图4-F脱苦溶液中可溶性固形物的含量可看出,pH为2和3时,脱苦溶液中可溶性固形物含量较大,在pH为4—7时,可溶性固形物含量较低。与蛋白质等相关指标较为一致。

图4 超声耦合柠檬酸溶液对脱苦杏仁及脱苦溶剂中部分理化指标的影响
2.4 超声耦合柠檬酸溶液脱苦后杏仁颜色及品质间的相关性分析
由表5可知,超声耦合柠檬酸溶液脱苦后,脱苦杏仁及脱苦液中的18项理化指标间均呈现一定的相关性,部分理化指标间呈极显著相关性(<0.01),如*值与*值、*值,*与*值、附着性,硬度与黏聚性、胶着性、咀嚼性、回复性、苦杏仁中苦杏仁苷含量,附着性与胶着性等。可进一步通过主成分分析研究各项理化指标与脱苦溶剂之间的关系,为科学合理选择脱苦溶剂提供依据。
2.5 主成分分析
本试验考察特征值λ>1并综合考虑方差贡献率确定最优的主成分数。由表6可知,前3个因子构成的信息量为总信息量的86.59%,并且前3个因子的特征值均大于1,所以选用前3个因子代表18项指标的全部信息。第一因子方差贡献率为47.35%,代表性指标(权重较大的指标)有*、*、*、脆性、附着性、胶着性、咀嚼性、酶活、蛋白质和可溶性固形物,体现脱苦杏仁的色值、质构及脱苦溶液的化学指标。第二因子方差贡献率为25.34%,代表性指标有硬度、回复性、水分含量、苦杏仁中苦杏仁苷含量,体现脱苦杏仁的质构指标。第三因子方差贡献率为13.89%,代表性指标有弹性、总酚含量,体现脱苦杏仁的质构指标及脱苦溶液的化学指标。
由图5可知,6种不同pH柠檬酸溶液总体可分为3大类。pH为2和3的柠檬酸溶液可归类为第一类;pH为4和5以及pH为6和7的溶液可分别归为第二和三类。本分析检测的16项指标,可全面评价超声耦合不同pH柠檬酸溶液对脱苦杏仁品质的影响。
2.6 聚类分析
由图6可看出,将18项理化指标进行聚类分析,可将6种不同pH的柠檬酸溶液分为3大类,该结果与主成分分析图5结果基本吻合,都可将感官评价结果较好的pH为4和5的柠檬酸溶液分为一类;将感官评价结果较差的pH为2和3的柠檬酸溶液归为一类;不同的是主成分分析图5中将pH为6和7的柠檬酸溶液分为一类,而图6中pH为6与pH为4和5归到一起,pH为7单独分为一类。通过因子得分图和系统聚类发育树可知,超声耦合不同pH柠檬酸溶液脱苦对苦杏仁品质会产生一定影响。因此,苦杏仁脱苦时有必要对脱苦溶液进行选择和优化。

图5 因子得分图

图6 聚类分析图

表5 理化指标间的相关性分析
*和**分别表示达0.05和0.01显著水平
*and ** refer to the correlation coefficient significant at 0.05 and 0.01 levels, respectively

表6 理化指标的主成分分析结果
3 讨论
苦杏仁脱苦是苦杏仁加工过程的一道必经工序,所用的脱苦溶液不仅会影响脱苦时间,还会对苦杏仁中的营养物质造成一定程度的损失。本试验探究了超声耦合不同酸度柠檬酸溶液对苦杏仁脱苦后18项理化指标的影响。本研究结果与传统工业化热水脱苦需7—8 h、苦杏仁重量降低14.5%相比[27],超声耦合柠檬酸溶液脱苦大大缩短了脱苦时间,且脱苦后杏仁重量仅降低约10.52%,主要是由于超声波和柠檬酸pH的协同作用。一般来说,超声波的机械和空化效应,会产生较大的剪切力和微泡增强表面浸蚀,从而有效打破边界层、增加物质分子间的接触和碰撞,从而加速苦杏仁苷的溶出或降解[35]。除此之外,超声空化还会激活苦杏仁中的β-葡萄糖苷酶[31-32],加速苦杏仁中苦杏仁苷的降解,降低其含量从而缩短脱苦时间;且柠檬酸溶液的pH为5左右时,也有利于苦杏仁苷的溶出或降解[28],从而使苦杏仁在pH为4、5的酸溶液中所需脱苦时间进一步缩短。对于苦杏仁脱苦来说,主要是脱除一部分苦杏仁苷从而减小因其含量高而带来的苦味和潜在毒性[3,6,36];同时,残留一定量的苦杏仁苷也有利于保留苦杏仁的药用价值,且其含量均在安全食用范围内[23]。因此,苦杏仁脱苦并不是苦杏仁苷含量越低越好,今后还可以针对苦杏仁苷进行定向脱苦控制方面的研究。
经不同pH的柠檬酸水溶液脱苦后苦杏仁的表观特征变化不明显,发现脱苦杏仁的亮度较高,且苦杏仁整体稍偏黄。脱苦后苦杏仁中水分含量及β-葡萄糖苷酶活研究发现,较原样相比,脱苦杏仁中水分含量明显增多,说明在脱苦过程中苦杏仁中自由水含量增加,使苦杏仁苷更易溶出,加快了苦杏仁的脱苦速率;同时,也会造成苦杏仁中其他营养物质例如蛋白质、还原糖等的流失。但这些流失明显低于传统脱苦过程中所造成的营养物质损失[27]。将苦杏仁脱苦所需时间结合β-葡萄糖苷酶活在脱苦杏仁中的变化可知,高酸环境抑制了苦杏仁中β-葡萄糖苷酶等物质的活性,使苦杏仁苷在极酸(pH 2)条件下降解速率降低,从而使脱苦所需时间变长,而在pH为4和5时,酶活较高,加快了苦杏仁苷的降解速率。周进等[37]对里氏木霉菌产β-葡萄糖苷酶的研究发现,pH为5时β-葡萄糖苷酶产量和活力分别提高1.8倍和2.5倍;FAN等[31]研究发现超声可以使β-葡萄糖苷酶的活性提高34.67%。ZHANG等[32]研究发现超声脱苦不会引起苦杏仁苷的异构化,表明超声脱苦不会带来因苦杏仁苷异构化而产生的潜在安全风险。总体而言,脱苦过程中酶活力的变化一方面来自酸度的影响,另一方面来自于超声空化激活效应。
苦杏仁去毒脱苦的目的,不仅要使苦杏仁中的苦杏仁苷溶出或部分分解,还要使苦杏仁中的营养物质如蛋白质、糖类、总酚等物质尽可能少的溶出损失,从而最大限度保留苦杏仁的营养价值。本试验结果表明,6种不同pH的柠檬酸脱苦溶液中均检测到了总酚、蛋白质、还原糖、可溶性固形物。不同pH的柠檬酸脱苦溶液中均检测出了较高含量的总酚,且在pH为3时最高。郭宏垚等[38]对花椒中多酚提取结果显示pH为3时效果最好;贾仕杰等[39]对红树莓籽中活性物质提取时也发现pH为3时效果最佳。其原因可能是强酸性环境破坏了多酚与糖类、蛋白质、酯类等之间的化学键,从而使多酚被更多释放出来;也可能是破坏了低聚/多聚酚类物质间的结合力,使单体多酚游离出来;或者强酸性环境使福林酚试剂与样液间的显色反应更剧烈、吸光度增大,最终使pH为3时多酚含量高于其他pH[35]。蛋白质在pH为2和3的柠檬酸水溶液中含量较大,说明这两种脱苦溶液对苦杏仁中蛋白质的损失较大,而蛋白质是苦杏仁中重要的营养物质[26,33],因此,要选择对蛋白质损失较少的脱苦溶液。可溶性固形物是包括溶于水的糖、酸等混合物,在pH为4—7的柠檬酸水溶液中,可溶性固形物含量较低,在pH为2和3时,可溶性固形物含量较高,可能原因是在该条件下苦杏仁中的总酚、蛋白质大量溶出。结合不同pH柠檬酸水溶液所需脱苦时间,可得出用pH为4或5的柠檬酸水溶液耦合超声脱苦,不仅脱苦时间短且苦杏仁中营养物质损失少、口感也较好。
苦杏仁经不同pH柠檬酸水溶液耦合超声脱苦后,其质构特性也会发生相应变化,进而直接影响着脱苦杏仁的口感及商品价值。通过对脱苦杏仁质构的研究发现,脱苦溶液对苦杏仁质构的影响主要体现在苦杏仁的硬度、脆性、胶着性、咀嚼性等方面,这与方媛等[40]对红富士苹果质构的研究结果基本一致。与此同时,通过对脱苦杏仁的色泽、表观形状、硬度、口味、黏性、脆性等6方面综合感官评分表明,用pH为5的柠檬酸溶液耦合超声脱苦所得脱苦杏仁感官评价得分最高。上述研究结果说明,不同pH柠檬酸水溶液耦合超声脱苦后,脱苦杏仁的口感不仅发生了改变,而且这些改变可以从质构数据的变化得以确证。
主成分分析是指将数据降维,把多指标转化为少数几个综合指标,其中每个主成分都能够反映原始变量的大部分信息,且所含信息互不重复[41]。主成分分析用于多指标综合评价的优点在于可消除评价指标间的相关影响,有助于更客观地描述样品的相对地位、保证客观性。聚类分析可将研究对象关系接近的合并为一类,着重区分类别内和类别间元素的组成,明确分类界限,但不会对信息进行删减、不会区分元素重要性,类别间重要性是等同的[42]。本研究借助于PCA和CA两种分析方法均得出了较为一致的结果。当前苦杏仁的工业化脱苦主要是以热水作为脱苦溶液,脱苦时间长、营养成分损失大、环境污染更严重[27],而以含酸溶液并耦合超声脱苦可以将脱苦时间大大缩短,且由于脱苦温度较低因此能耗及营养成分损失更小,本研究从质构及其相关成分的关联性方面探究了原因,优化了较好的条件,可以为苦杏仁的提质增效加工提供借鉴和指导。
4 结论
超声耦合pH为5的柠檬酸水溶液对苦杏仁脱苦速度最快,仅需90 min;而且在该条件下脱苦所得苦杏仁的感官得分最高、口感也较好。同时,苦杏仁中蛋白质、还原糖、总酚等营养物质损失也较少,最大程度保留了苦杏仁原有的营养价值。超声耦合酸液之所以能快速脱苦,一方面来自于超声波的传质作用加速了苦杏仁苷的迁移,另一方面与苦杏仁中β-葡萄糖苷酶的活力有关,在优化的酸度和超声空化共同作用下极大提升了酶活性,最终加速了苦杏仁苷的降解进而脱苦。脱苦杏仁理化指标评价体系中,可用硬度代表黏聚性、胶着性、咀嚼性、回复性作为脱苦杏仁质构口感的测定指标,可用可溶性固形物含量代替蛋白质、还原糖测定脱苦溶液中化学指标。脱苦杏仁理化性质的评价指标可简化为色值、硬度、脆性、附着性、弹性、可溶性固形物含量6项指标,这6项指标可以全面反映脱苦杏仁的理化性质。
[1] MANDALARI G, TOMAINO A, ARCORACI T, MARTORANA M, LO T V, CACCIOLA F, RICH G T, BISIGNANO C, SAIJA A, DUGO P, CROSS K L, PARKER M L, WALDRON K W, WICKHAM M S. Characterization of polyphenols, lipids and dietary fiber from almond skins (L.)., 2010, 23(2): 166-174.
[2] YADA S, LAPSLEY K, HUANG G. A review of composition studies of cultivated almonds: Macronutrients and micronutrients., 2011, 24(4): 469-480.
[3] FEMENIA A, ROSSELLO C, MULET A, CANELLAS J. Chemical composition of bitter and sweet apricot kernels., 1995, 43(2): 356-361.
[4] ZHANG Q A, ZHANG Z Q, YUE X F, FAN X H, LI T, CHEN S F. Response surface optimization of ultrasound-assisted oil extraction from autoclaved almond powder., 2009, 116(2): 513-518.
[5] 李科友, 史清华, 朱海兰, 唐德瑞.苦杏仁主要营养成分研究. 西北农业学报, 2003, 12(2): 119-121.
LI K Y, SHI Q H, ZHU H L, TANG D R. Study on main nutrient compositions of bitter almond., 2003, 12(2): 119-121. (in Chinese)
[6] 张贞亮. 杏仁粕蛋白的提取工艺及品质控制的研究[D]. 保定: 河北农业大学, 2011.
ZHANG Z L. Study on extraction and quality control of almond dregs protein [D]. Baoding: Agricultural University of Hebei, 2011. (in Chinese)
[7] 张馨允, 宋云, 范学辉, 张清安. 干制温度对脱苦杏仁品质的影响. 食品与机械, 2017, 33(4): 180-183.
ZHANG X Y, SONG Y, FAN X H, ZHANG Q A. Effect of drying temperature on quality of debitterized apricot kernels., 2017, 33(4): 180-183. (in Chinese)
[8] 王福花, 张占军. 杏仁研究进展. 安徽农业科学, 2010, 38(29): 16239-16240.
WANG F H, ZHANG Z J. Research advances of almonds., 2010, 38(29): 16239-16240. (in Chinese)
[9] 侯智霞, 翟明普, 蔡秀芝, 苏淑钗, 李响. 我国仁用杏生产现状分析. 北方园艺, 2008(2): 39-41.
HOU Z X, ZHAI M P, CAI X Z, SU S C, LI X. Analysis on current situation ofLam. in China., 2008(2): 39-41. (in Chinese)
[10] BOLARINWA I F, ORFILA C, MORGAN M R. Amygdalin content of seeds, kernels and food products commercially-available in the UK., 2014, 152(2): 133-139.
[11] SONG Y, ZHANG Q A, FAN X H, ZHANG X Y. Effect of debitterizing treatment on the quality of the apricot kernels in the industrial processing., 2017, 42(7): 1-8.
[12] 陈效兰, 雷钢铁. 柠檬酸在食品工业中的应用. 山东食品科技, 2000, 21(3): 6-7.
CHEN X L. LEI G T. Application of citric acid in food industry., 2000, 21(3): 6-7. (in Chinese)
[13] 李军. 苦杏仁脱苦工艺的研究[D]. 北京: 北京林业大学, 2012.
LI J. Studies on the process of removal of bitterness from bitter apricot seed [D]. Beijing: Beijing Forestry University, 2012. (in Chinese)
[14] 张宁, 程新华. 苦杏仁真空脱苦新方法及设备. CN92105361.4.
ZHANG N, CHENG X H. Novel vacuum debitterizing method and equipment for apricot kernels. CN92105361.4. (in Chinese)
[15] 张兵, 田兴旺, 王永平, 赵怀龙.苦杏仁的微波脱苦法. 陇东学院学报(自然科学版), 2003, 13(2): 39-40.
ZHANG B, TIAN X W, WANG Y P, ZHAO H L. Microwave debitterizing of apricot kernels.(), 2003, 13(2): 39-40. (in Chinese)
[16] 张清安, 范学辉, 张扬俊娜, 张志琪.一种超声诱导苦杏仁快速脱苦的方法. ZL 201310376132.X.
ZHANG Q A, FAN X H, ZHANG Y J N, ZHANG Z Q. A rapid debitterizing method of apricot kernels induced by ultrasound. ZL 201310376132.X. (in Chinese)
[17] 范学辉, 张清安, 刘梅. 苦杏仁脱苦方法研究进展. 食品工业科技, 2014, 35(7): 396-399.
FAN X H, ZHANG Q A, LIU M. Progress in detoxification techniques of apricot kernel.2014, 35(7): 396-399. (in Chinese)
[18] SILEM A, GUNTER H O, EINFELDT J, BOUALIA A. The occurrence of mass transport processes during the leaching of amygdalin from bitter apricot kernels: detoxification and flavour improvement., 2006, 41(2): 201-213.
[19] 许绍惠, 边立琪, 韩忠环, 周艳明, 贺东. 山杏仁脱苦及对营养成分影响的研究初报. 沈阳农业大学学报, 1992, 23(2): 114-118.
XU S H, BIAN L Q, HAN Z H, ZHOU Y M, HE D. Study on siberian apricot kernel debitterizing technology and its effect on nutritional composition., 1992, 23(2): 114-118.(in Chinese)
[20] 姜伟, 牛欣宇, 宋腱森, 李建忠, 何玉莲, 赵光辉. 山杏仁油料的理化特性及综合利用. 粮油加工, 2014(4): 37-39, 43.
JIANG W, NIU X Y, SONG J S, LI J Z, HE Y L, ZHAO G H. Physical and chemical properties and comprehensive utilization of wild apricot kernel oil., 2014(4): 37-39, 43. (in Chinese)
[21] 朱蓓薇, 孙浩, 赵曼, 焦鹏. 用正交试验对苦杏仁脱苦去毒技术的优选. 大连轻工业学院学报, 1992, 11(3/4): 12-16.
ZHU B W, SUN H, ZHAO M, JIAO P. The optimum selection of the debitterizing and detoxifying techniques of bitter almond by means of the pertendicular test method.1992, 11(3/4): 12-16. (in Chinese)
[22] 张宁, 张馨允, 范学辉, 张清安. 苦杏仁超声辅助快速脱苦工艺优化. 食品与机械, 2018, 34(12): 189-194.
ZHANG N, ZHANG X Y, FAN X H, ZHANG Q A. Optimization on fast debitterizing technologies of apricot seed by ultrasound with response surface methodology., 2018, 34(12): 189-194. (in Chinese)
[23] 史芳芳, 王娜娜, 范学辉, 张清安. 苦杏仁脱苦过程中苦杏仁苷含量的变化及其与苦味的关系. 食品与机械, 2018, 34(7): 211-214.
SHI F F, WANG N N, FAN X H, ZHANG Q A. Changes of amygdalin content and its correlation with the bitterness in apricot kernels during the debitterizing processing., 2018, 34(7): 211-214. (in Chinese)
[24] 黄克昌, 邹建云, 马尚玄, 付镓榕, 郭刚军. 不同焙烤条件对澳洲坚果带壳果品质的影响. 热带农业科技, 2018, 41(3): 27-31.
HUANG K C, ZOU J Y, MA S X, FU J R, GUO G J. The quality of macadamia nut in shell under different roasting conditions., 2018, 41(3): 27-31. (in Chinese)
[25] 魏益民, 邢亚楠, 张影全, 孔雁, 李明, 张波, 唐娜. 兰州拉面制作过程及产品的感官评价方法. 中国农业科学, 2016, 49(20): 4016-4029.
WEI Y M, XING Y N, ZHANG Y Q, KONG Y, LI M, ZHANG B, TANG N. The sensory evaluation methods of production process and product of Lanzhou hand-extended noodles.2016, 49(20): 4016-4029. (in Chinese)
[26] ZHANG Q A, WEI C X, FAN X H, SHI F F. Chemical compositions and antioxidant capacity of by-products generated during the apricot kernels processing,, 2018, 16(1): 422-428.
[27] 宋云. 苦杏仁脱苦及干制工艺对杏仁品质的影响[D]. 陕西: 陕西师范大学, 2016.
SONG Y. Effects of apricot kernels debitterizing and dry processing technology on quality [D]. Shaanxi: Shaanxi Normal University, 2016. (in Chinese)
[28] 朱蓓薇, 孙浩, 赵曼, 焦鹏. pH值不同的浸泡液对杏仁脱苦去毒的影响. 食品工业科技, 1993, 15(2): 3-6.
ZHU B W, SUN H, ZHAO M, JIAO P. Influence of soaking solution with different pH values on the bitterness removal and detoxication of bitter almond., 1993, 15(2): 3-6. (in Chinese)
[29] 林炳芳, 陶宁萍. 梅果苦杏仁苷酶特性与青梅汁脱苦工艺的研究. 南京农业大学学报, 1996, 19(4): 87-91.
LIN B F, TAO N P. Amygdalase activities of gage fruits and debitterizing technique of gage juice., 1996, 19(4): 87-91. (in Chinese)
[30] TOKPOHOZIN S E, FISCHER S, SACHER B, BECKER T. β-D-Glucosidase as “key enzyme” for sorghum cyanogenic glucoside (dhurrin) removal and beer bioflavouring., 2016, 97: 217-223.
[31] FAN X H, ZHANG X Y, ZHANG Q A, ZHAO W Q, SHI F F. Optimization of ultrasound parameters and its effect on the properties of the activity of beta-glucosidase in apricot kernels., 2019, 52: 468-476.
[32] Zhang N, Zhang Q A, Yao J L, Zhang X Y. Changes of amygdalin and volatile components of apricot kernels during the ultrasonically-accelerated debitterizing., 2019. https://doi.org/10.1016/j. ultsonch. 2019.104614.
[33] RICHARDSON D P, ASTRUP A, COCAUL A, ELLIS P. The nutritional and health benefits of almonds: A healthy food choice., 2009, 6(4): 41-50.
[34] 陈申如, 张其标, 倪辉. 酸法提取鲢鱼鱼肉蛋白质技术的研究. 海洋水产研究, 2004, 25(5): 61-64.
CHEN S R, ZHANG Q B, NI H. Study on protein recovery from silver carp flesh by acid solubilization.2004, 25(5): 61-64. (in Chinese)
[35] 王婷婷. 超声波处理对红葡萄酒贮存期颜色变化的影响机理研究[D]. 西安: 陕西师范大学, 2018.
WANG T T. effect of ultrasonic treatment on the color changes of red wine and its mechanism during storage [D]. Xi’an: Shaanxi Normal University, 2018. (in Chinese)
[36] 汤庆发, 谢颖, 陈飞龙, 郭阳, 宋帅, 罗佳波. 苦杏仁中苦杏仁苷的存在形式及其影响因素. 中国实验方剂学杂志, 2013, 19(8): 107-109.
TANG Q F, XIE Y, CHEN F L, GUO Y, SONG S, LUO J B. Existing form of amygdalin in bitter almond and influence factors., 2013, 19(8): 107-109. (in Chinese)
[37] 周进, 银鹏. pH调控对里氏木霉菌产β-葡萄糖苷酶的影响机制. 清华大学学报(自然科学版), 2012, 52(2): 271-276.
ZHOU J, YIN P. Mechanisms of pH control on β-glucosidase produced in.(), 2012, 52(2): 271-276. (in Chinese)
[38] 郭宏垚, 李冬, 雷雄, 王小静, 刚勇, 李稳宏. 花椒多酚提取工艺响应面优化及动力学分析. 食品科学, 2018, 39(2): 247-253.
GUO H Y, LI D, LEI X, WANG X J, GANG Y, LI W H. Optimization by response surface methodology and kinetics of extraction of polyphenols from Chinese Prickly Ash., 2018, 39(2): 247-253. (in Chinese)
[39] 贾仕杰, 宁玮钰, 曾栋, 王金玲. 红树莓籽中活性物质提取工艺优化. 食品工业科技, 2018, 39(23): 188-192, 198.
JIA S J, NING W Y, ZENG D, WANG J L. Optimization of extraction process of active components from Red Raspberry Seeds., 2018, 39(23): 188-192, 198. (in Chinese)
[40] 方媛, 赵武奇, 张清安, 郭玉蓉. ‘红富士’苹果蠕变特性与果实品质的相关分析. 中国农业科学, 2016, 49(4): 717-726.
FANG Y, ZHAO W Q, ZHANG Q A, GUO Y R. The correlation analysis between quality and creep property of ‘Fuji’ apple., 2016, 49(4): 717-726. (in Chinese)
[41] NAMBISAN B. Strategies for elimination of cyanogens from cassava for reducing toxicity and improving food safety., 2011, 49(3): 690-693.
[42] 公丽艳, 孟宪军, 刘乃侨, 毕金峰. 基于主成分与聚类分析的苹果加工品质评价. 农业工程学报, 2014, 30(13): 276-285.
GONG L Y, MENG X J, LIU N Q, BI J F. Evaluation of apple quality based on principal component and hierarchical cluster analysis., 2014, 30(13): 276-285. (in Chinese)
Effects of Different Citric Acid Solutions on the Quality of Apricot Kernels during Debitterizing Mediated by Ultrasound Irradiation
SHI FangFang, ZHANG QingAn
(College of Food Engineering and Nutritional Science, Shaanxi Normal University, Xi’an 710119)
【】In this paper, the effects of different pH values coupled with ultrasound irradiation on the color, texture and some physicochemical properties of the apricot kernels during debitterizing were investigated. Correlation analysis of all measured variables was conducted to simplify the evaluating indicators of the quality of debitterizing apricot kernels with different solvents. In addition, multivariate data analysis was applied to categorize the debitterizing solvents and provide the theoretical base for the selection of debitterizing solvents in the debitterizing processing of apricot kernels. 【】Determinations of the amygdalin, water content and beta-glucosidase activity of the apricot kernels, and the contents of total phenols, proteins, reducing sugars and soluble solids in the debitterizing solutions were conducted by the high performance liquid chromatography, spectrophotometer and abbe refractometer, etc, respectively. In addition, the texture and organoleptic properties of the debitterized apricot kernels were also investigated by the texture analyzer and sensory evaluation test, respectively. Finally, principal component analysis (PCA) and cluster analysis (CA) were applied to classify the six kinds of debitterizing solvents. 【】Compared with the untreated sample, the color, hardness, fracturability, chewiness, resilience, gumminess and sensory evaluation of the debitterized apricot kernels were significantly different after being debitterized by the six kinds of debitterizing solvents. In the meantime, the moisture content and the activity of beta-glucosidase of the apricot kernels increased significantly. Based on the comprehensive analysis of the physicochemical indicators, the debitterizing time was the shortest (only 90 min), and the loss of the nutrients in the apricot kernels was less than the other treated samples, when the pH of the debitterizing solution was at the value of 5. Correlation analysis showed a certain correlation among the indicators. The results of PCA and CA provided the same classification, and the six kinds of debitterizing solvents could be classified into three categories. Moreover, the effects of the different solutions on the apricot kernels in the same category were not significant. 【】 The citric acid solution with a pH of 5 could be used as the optimal solution to remove the bitterness of apricot kernels, which not only accelerated the bitterness of apricot kernels, but also reduced the loss of nutrients of apricot kernels. All these results could provide the support for the industrial rapid debitterizing of apricot kernels.
apricot kernel; debitterizing solvents; texture; sensory evaluation; principal component analysis; cluster analysis

10.3864/j.issn.0578-1752.2019.17.011
2018-12-29;
2019-07-19
国家自然科学基金青年基金(31101324)、陕西省重点研发计划(2017NY-167,2018ZDXM-NY-086)、西安市科技局高校院所人才服务企业工程项目(2017071CG/RC034(SXSF003))
史芳芳,E-mail:13772427380@163.com。通信作者张清安,E-mail:qinganzhang@snnu.edu.cn
(责任编辑 赵伶俐)
