不同芽孢杆菌对极早熟桃采后链格孢菌的防治效果及其发酵液挥发性物质成分分析
2019-09-11郑香香阎瑞香陈存坤关文强
郑香香,张 娜,阎瑞香,陈存坤,关文强,*
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.国家农产品保鲜工程技术研究中心(天津),天津市农产品采后生理与贮藏保鲜重点实验室,天津 300384;3.天津科技大学包装与印刷工程学院,天津 300222)
桃(AmygdaluspersicaLinn.)属蔷薇科(Rosaceae)桃属植物,其果实风味浓郁,肉质鲜美多汁,且富含蛋白质、维生素、糖类、胡萝卜素及微量元素等多种营养物质[1]。我国桃的种植品种众多,但多数均为中晚熟品种,适于种植的优质早熟桃品种较少[2-3]。“津柳早红”是由天津学香果蔬有限公司和天津农学院互助培育而成的一个极早熟桃品种,其果实着色早,6月上旬即为成熟期,果肉呈乳白色,肉质细腻,纤维少,汁液丰富,风味酸甜适口[2]。桃属于呼吸跃变型果实,采后在常温下易快速成熟软化,且在运输和贮藏过程中极易受微生物侵染而造成腐烂变质,失去商品价值[4]。链格孢菌(Alternariaalternata)是桃采后主要致病菌之一,被其侵染的果实表面出现褐色斑点,斑块上长出墨绿色或黑色霉状物,并生出灰白色菌丝[5],后期果实在贮藏或运输过程中由于温度波动或机械伤等原因会出现大面积腐烂,造成严重的经济损失。
目前桃的采后病害防治措施主要为低温贮藏与化学保鲜剂相结合的方式[6],但长期使用化学保鲜剂会带来的安全性、环保性和抗药性等问题。生物防治作为果蔬采后病害防治的新方法,因其安全、绿色、环保、无抗药性等特点而逐渐成为国内外果蔬保鲜的研究热点[7]。芽孢杆菌(Bacillus)是一类好氧、内生芽孢的革兰氏阳性细菌,在自然界中广泛存在,且营养简单、生长快,其芽孢能忍受极端的外部环境而长期存活,有利于生防菌剂的生产,是一种理想的生防微生物[8-10]。大量研究表明芽孢杆菌能有效抑制果蔬采后病害,对苹果[11]、柑橘[12]、梨[13]、水蜜桃[14]、黄瓜[15]等果蔬的抑菌防治都有研究报道。微生物在生长过程中会产生一系列挥发性物质(Volatile organic compounds,VOCs),而这些物质作为生防因子能有效抑制许多病原菌的生长[16-18]。例如Fernando等[19]最先报道了假单孢属(Pseudomonas)的14种细菌挥发性物质可以抑制真菌菌丝的生长和孢子的萌发;陈奕鹏等[20]研究芽孢杆菌BEB17产生的挥发性有机物可抑制多种病原真菌生长,其中对香蕉枯萎病菌抑制效果最强。但目前关于芽孢杆菌的挥发性物质对桃的主要致病菌链格孢菌的抑制作用,以及芽孢杆菌对极早熟桃采后保鲜效果的研究还鲜见报道。
本研究以“津柳早红”极早熟桃为研究对象,初步探究三种芽孢杆菌HB-2、B1和X对桃采后链格孢病菌的抑制作用以及对极早熟桃采后保鲜效果的影响,并对其发酵液中挥发性物质的抑菌活性和主要成分进行分析,以期为早熟桃采后的病害防治和保鲜提供理论参考。
1 材料与方法
1.1 材料与仪器
桃果实“津柳早红” 采摘于天津市西青区大柳滩桃园,采收八成熟(极早熟)健康果实于当天运回实验室预冷并贮藏于0 ℃冷库中;链格孢菌(Alternariaalternata) 由本实验室从自然发病的桃上分离所得,并进行纯化培养及DNA鉴定;芽孢杆菌HB-2(Bacillusamyloliquefaciens) 天津市植物保护研究所提供;芽孢杆菌B1(Bacillusamyloliquefaciens)和X(Bacillussubtilis) 本实验室保存菌种;可溶性淀粉、氢氧化钠 化学纯,天津市科密欧化学试剂有限公司;草酸 化学纯,天津市光复科技发展有限公司;碘、抗坏血酸 化学纯,天津市赢达稀贵化学试剂厂;马铃薯葡萄糖培养基(PDA)、Luria-Bertani培养基 北京陆桥技术股份有限公司。
SW-CJ-1F单人双面净化工作台 苏州净化设备有限公司;LS-50HJ立式压力蒸汽灭菌锅 江阴滨江医疗设备有限公司;HZQ-F160A高低温恒温振荡培养箱 上海-恒科学仪器有限公司;HWS-250BX恒温恒湿箱 天津市泰斯特仪器有限公司;METTLER TOLEDO EL2044电子天平 梅特勒-托利多仪器(上海)有限公司;H1850R台式高速冷冻离心机 长沙湘仪离心机仪器有限公司;PAL-1型手持糖量计 日本ATAGO(爱拓)公司;TA-XT.plus质构仪 英国Stable Micro Systems公司;TRACE DSQ气质联用仪 美国Thermo Finnigan公司;50/30 μm DVB/CAR/PDMS灰色萃取头 美国Supelce公司。
1.2 实验方法
1.2.1 芽孢杆菌发酵液的制备 将三种芽孢杆菌菌种接种于LB培养基中,于28 ℃ 200 r/min条件下恒温振荡培养48 h,得到发酵液。将新鲜活化48 h的芽孢杆菌菌株HB-2、B1、X发酵液用无菌生理盐水调至菌体浓度为1×107cfu/mL待用。
1.2.2 不同芽孢杆菌发酵液对链格孢菌的活体抑制作用 将健康、无病害、大小一致的桃果实用清水冲洗干净,并用75%的乙醇进行表面消毒,晾干。用无菌针在果实赤道两边果面分别刺3 mm×3 mm的伤口,然后分别滴加20 μL活化48 h的三种芽孢杆菌发酵液HB-2、B1和X(1×107cfu/mL),对照组CK滴加无菌水,待其完全渗透果实伤口处后,用打孔器(d=6 mm)将PDA培养基上培养7 d的链格孢菌打成直径6 mm的菌饼,并将链格孢菌菌饼反接在伤口处[4]。每个处理组5个果实,试验重复3次。将处理后的果实置20 ℃条件下贮藏7 d,并定期观察测量病原菌病斑扩展直径,计算其病斑扩展抑制率。病斑扩展抑制率(%)=(对照病斑扩展直径-处理病斑扩展直径)×100/对照病斑扩展直径。
1.2.3 不同芽孢杆菌发酵液对极早熟桃采后的保鲜效果
1.2.3.1 样品处理 挑选采摘后的大小均匀、无病虫害、无机械损伤的桃果实,分别用不同的芽孢杆菌处理液浸泡3 min,晾干后放入塑料筐,并用PE袋(d=0.02 mm)套在塑料筐外面扎口,保持一定的湿度,置于0 ℃冷库内贮藏70 d。试验共设4个处理:处理1:芽孢杆菌HB-2发酵液浸泡;处理2:芽孢杆菌B1发酵液浸泡;处理3:芽孢杆菌X发酵液浸泡;对照CK:无菌水浸泡。每个处理3个重复,每个重复25个果实,每隔14 d对各处理每个重复的果实进行品质指标测定。
1.2.3.2 品质指标的测定及方法 腐烂率的测定:按照果实腐烂面积大于25%时即为腐烂的标准,由公式计算腐烂率:腐烂率(%)=(腐烂果实个数/果实总个数)×100;维生素C含量的测定:采用碘量法[21]进行测定;可溶性固形物含量的测定:将桃果肉匀浆用四层纱布挤压取汁,然后用PAL-1型手持糖度计进行测定,每一个样品重复测定三次,取平均值;可滴定酸含量的测定:采用张娜等[4]方法稍作修改测定;硬度的测定[4]:采用质构仪进行测定,采用P/2探头对桃果实缝合线两侧果面带皮穿刺,探头直径为2 mm,探头下压距离为10 mm,测试速度为2 mm/s。
1.2.4 不同芽孢杆菌处理液对链格孢菌抑菌活性的测定 将病原菌菌饼反接在PDA平板中间,采用十字划线法[22]在距离菌饼2.5 cm处放置直径6 mm的无菌滤纸片,每只平板等距离贴4片,并在滤纸片上分别滴加15 μL处理液发酵液:芽孢杆菌培养原液;滤液:芽孢杆菌发酵液在10000 r/min下,4 ℃离心10 min,用0.20 μm滤膜将上清液过滤所得液体;灭活菌液:将芽孢杆菌发酵菌液装入塑料炮弹管,在沸水浴中加热煮沸15 min,冷却后即得到灭活菌液;无菌水:作为对照。试验重复3次,将平板在28 ℃条件下倒置培养5 d,定期观察病原菌菌落的变化,测量病原菌菌落直径,计算其病斑扩展抑制率。
1.2.5 不同芽孢杆菌挥发性气体的抑菌活性测定 采用平板倒扣法[23]测定。在PDA平板中央接种培养5~7 d的供试病原菌菌饼(d=6 mm),取1.2.1中活化培养的芽孢杆菌发酵液100 μL涂布在LB平板上,并将其倒扣在病原菌培养平板上,用封口膜密封,置28 ℃恒温培养箱培养5 d,以不接芽孢杆菌的空白LB平板作对照。采用十字划线法测量病原菌病斑扩展直径,计算其病斑扩展抑制率。
1.2.6 不同芽孢杆菌挥发性物质的GC-MS鉴定 取1.2.1中培养的芽孢杆菌发酵液200 μL,转接于顶空瓶中的LB固体培养基上,28 ℃培养48 h。将萃取头插入顶空瓶中40 ℃顶空吸附挥发性物质40 min后,立即插入GC-MS进样口,在240 ℃下解吸附5 min后,进行GC-MS分析。
色谱条件:采用DB-5毛细管色谱柱柱(30 m×0.25 mm×0.25 μm),载气:He,程序升温:40 ℃保持2 min,以10 ℃/min升温到120 ℃,以6 ℃/min升温至180 ℃,以10 ℃/min升温至230 ℃,保持5 min。进样口温度240 ℃,采用不分流,载气He,流量1.0 mL/min,萃取头在进样口脱附5 min。
质谱条件:电子轰击(EI)离子源,检测器电压350 V,离子源温度200 ℃,传输线温度250 ℃,电子能量70 eV,扫描质量范围35~650 m/z[24]。
1.3 数据处理
2 结果与分析
2.1 不同芽孢杆菌发酵液对链格孢菌的活体抑制作用
由表1可知,将病原菌菌饼接种于果实表面伤口处,20 ℃贮藏7 d后,对照组CK发病率100%,采用三种芽孢杆菌发酵液处理后均能有效抑制桃采后病原菌链格孢菌病斑的扩展,且HB-2、B1、X对桃果实病原菌病斑扩展的抑制率分别为52.53%、40.32%和47.99%。由显著性差异分析可知,三种芽孢杆菌发酵液对链格孢菌病斑的抑制作用显著且效果为HB-2>X>B1(p<0.05)。

表1 不同芽孢杆菌发酵液对链格孢菌的活体抑制作用Table 1 Inhibition of different Bacillus fermentation broths against Alternaria in vivo
2.2 不同芽孢杆菌发酵液对极早熟桃采后的保鲜效果
通过活体预防试验可知,三种芽孢杆菌发酵液都对链格孢菌有明显抑制作用。但水果在贮藏过程中受多种因素影响,其生理生化变化复杂,为进一步探究不同芽孢杆菌对极早熟桃采后腐烂率和品质的影响,采用不同芽孢杆菌发酵液对桃果实进行浸泡处理。如表2所示,0 ℃贮藏70 d后,三种芽孢杆菌处理的桃果实腐烂率均显著低于对照组CK(p<0.05)。对照组的果实大部分发生霉变腐烂,而芽孢杆菌处理过的果实其腐烂程度明显降低,其中HB-2贮藏效果最好,X和B1次之。对照组腐烂率为78.70%,而HB-2处理的果实腐烂率仅为22.70%,腐烂率降低了56.00%。
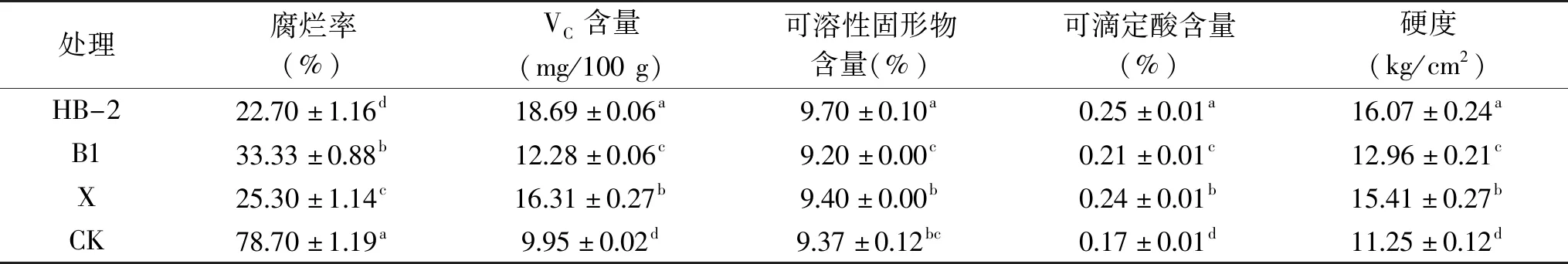
表2 不同芽孢杆菌发酵液对极早熟桃采后的保鲜效果Table 2 Fresh-keeping effect of different Bacillus fermentation broth on post-harvest peach
随着贮藏时间的延长,果实中的VC含量、可溶性固形物含量和可滴定酸含量均会发生下降。在贮藏结束后,芽孢杆菌处理的桃果实其VC含量和可滴定酸含量均显著高于对照组(p<0.05)。与对照组相比,芽孢杆菌B1和X处理的桃果实其可溶性固形物含量无明显差异,HB-2处理的果实其可溶性固形物含量则显著高于对照组(p<0.05),说明三种芽孢杆菌均能有效延缓桃的VC和可滴定酸含量的下降,且HB-2能较好地维持可溶性固形物的含量。硬度也是衡量果实品质的重要指标之一。由表2可知,对照组CK的果实硬度仅为11.25 kg/cm2,而三种芽孢杆菌处理的桃果实其硬度均显著高于对照组(p<0.05),说明三种芽孢杆菌能有效维持果实的硬度。
2.3 不同芽孢杆菌处理液对链格孢菌的体外抑菌活性
由活体预防试验和浸泡试验结果可知,三种芽孢杆菌对桃采后致病菌链格孢菌均有明显抑制作用且能够延缓果实的贮藏期品质的降低,为进一步探究其抑菌作用机理,通过平板对峙试验测定芽孢杆菌不同处理液对病原菌的抑制活性。试验中三种芽孢杆菌滴加无菌水的滤纸片对病原菌无抑制作用,菌丝迅速生长,而由图1可知,芽孢杆菌的不同处理液对病原菌的抑制作用不同,HB-2发酵液和滤液对病原菌菌落直径与对照比分别降低61.22%和59.18%,B1发酵液和滤液菌落直径与对照比分别降低55.70%和54.43%,X发酵液和滤液菌落直径与对照比分别降低54.93%和53.52%,与对照滴加无菌水的处理(抑制率为0)相比,三种芽孢杆菌的发酵液和滤液均能显著抑制病原菌的菌落扩展(p<0.05),灭活菌液则无明显抑制效果。
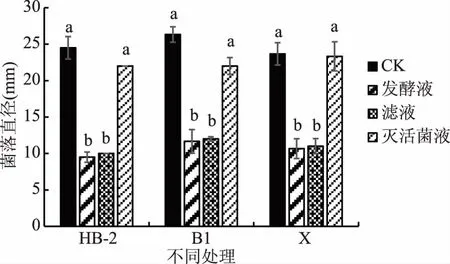
图1 不同芽孢杆菌对链格孢菌的抑菌活性Fig.1 Antibacterial activity of different Bacillus strains against Alternaria注:不同标记字母表示同一菌种处理中不同处理液间差异显著(p<0.05)。
2.4 不同芽孢杆菌挥发性气体的抑菌活性
由2.1和2.2可知,芽孢杆菌HB-2、B1和X发酵液均能对链格孢菌有明显抑制作用,本试验采用平板倒扣法对芽孢杆菌发酵液挥发性气体的抑菌活性进行探究。试验中,对照组CK的病原菌在培养5 d后菌丝就迅速长满培养皿,而处理组HB-2、B1和X的挥发性气体均能有效抑制病原菌的生长(见图2)。由表3可知,对照组CK的菌落扩展直径为33.33 mm,芽孢杆菌HB-2、B1和X对病原菌菌落扩展的抑制率分别为80.00%、66.92%和72.11%,这说明三种芽孢杆菌发酵液的挥发性气体均显著抑制了病原菌的生长(p<0.05)。同时大量研究也表明,芽孢杆菌发酵过程中产生的挥发性成分对病原菌具有抑制作用[16-18],如Gao等[25]研究表明枯草芽孢杆菌CF-3发酵液产生的挥发性物质能显著抑制链格孢菌、灰葡萄孢霉菌等多种病原菌的菌丝生长,平均抑制率达59.97%,与本试验结果一致。

表3 不同芽孢杆菌发酵液挥发性气体的抑菌活性Table 3 Antibacterial activity of volatile gases of different Bacillus

图2 不同芽孢杆菌挥发性气体的抑菌活性Fig.2 Antibacterial activity of different Bacillus volatile gases
2.5 不同芽孢杆菌挥发性物质的GC-MS鉴定
通过SPME-GC-MS对不同芽孢杆菌发酵过程中的挥发性物质进行分析,依据标准谱库及相对保留值进行定性,由表4可知,不同芽孢杆菌发酵液产生的挥发性物质种类和含量都具有差异性,芽孢杆菌HB-2、B1和X分别鉴定出28种、31种和30种挥发性物质,主要可分为醇类、酯类、酮类、酸类、酚类、醛类、烃类和其他类化合物。三种芽孢杆菌HB-2、B1和X共有的发挥性物质有2-乙基-1-己醇、2-壬醇、2-癸醇、2,2-二甲基丙酸乙烯酯、2,4-二叔丁基苯酚、1,3-二叔丁基苯、正十四烷、正十六烷、正十二烷、甲氧基苯基肟共10种,且共有挥发性物质峰面积之和分别为21.69%、14.78%和15.01%,其中2-乙基-1-己醇、2-壬醇、2,4-二叔丁基苯酚、正十四烷、正十六烷、甲氧基苯基肟也已被报道存在于其他芽孢杆菌的有效抑菌挥发物质中[19,24]。另外,3-羟基丁酮是芽孢杆菌B1和X发酵液中所有鉴别出的化合物中含量最多的一种,其峰面积分别为25.56%和25.01%,是其主要挥发性物质,且Arrebola等[32]研究表明解淀粉芽孢杆菌PPCB004也能够产生抑制青霉菌的3-羟基丁酮气体。因此,3-羟基丁酮可能是B1和X的主要抑菌物质,但其具体抑菌机理仍需进一步研究。
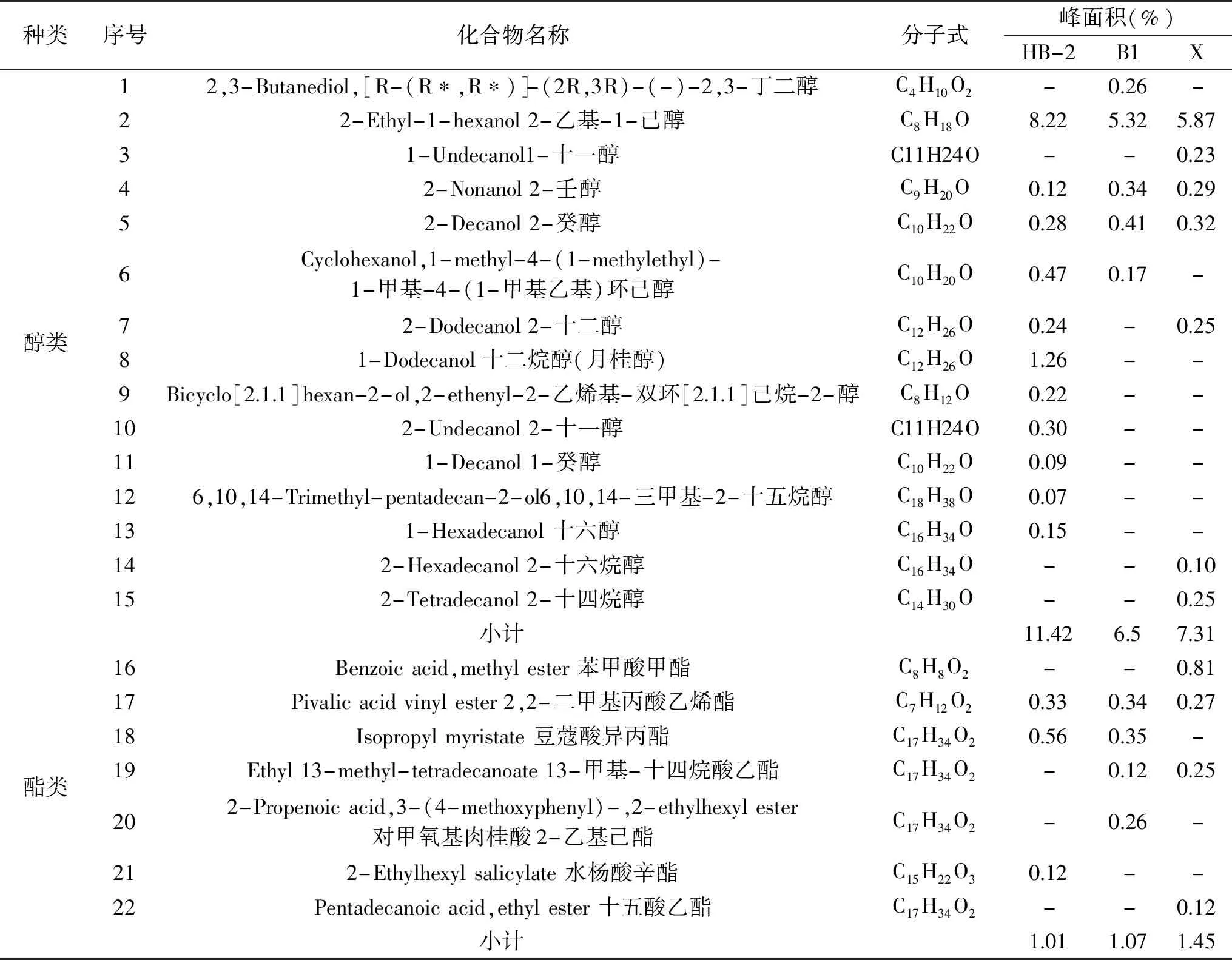
表4 不同芽孢杆菌挥发性物质SPME-GC-MS分析结果Table 4 Results of SPME-GC-MS analysis of volatile substances of different Bacillus
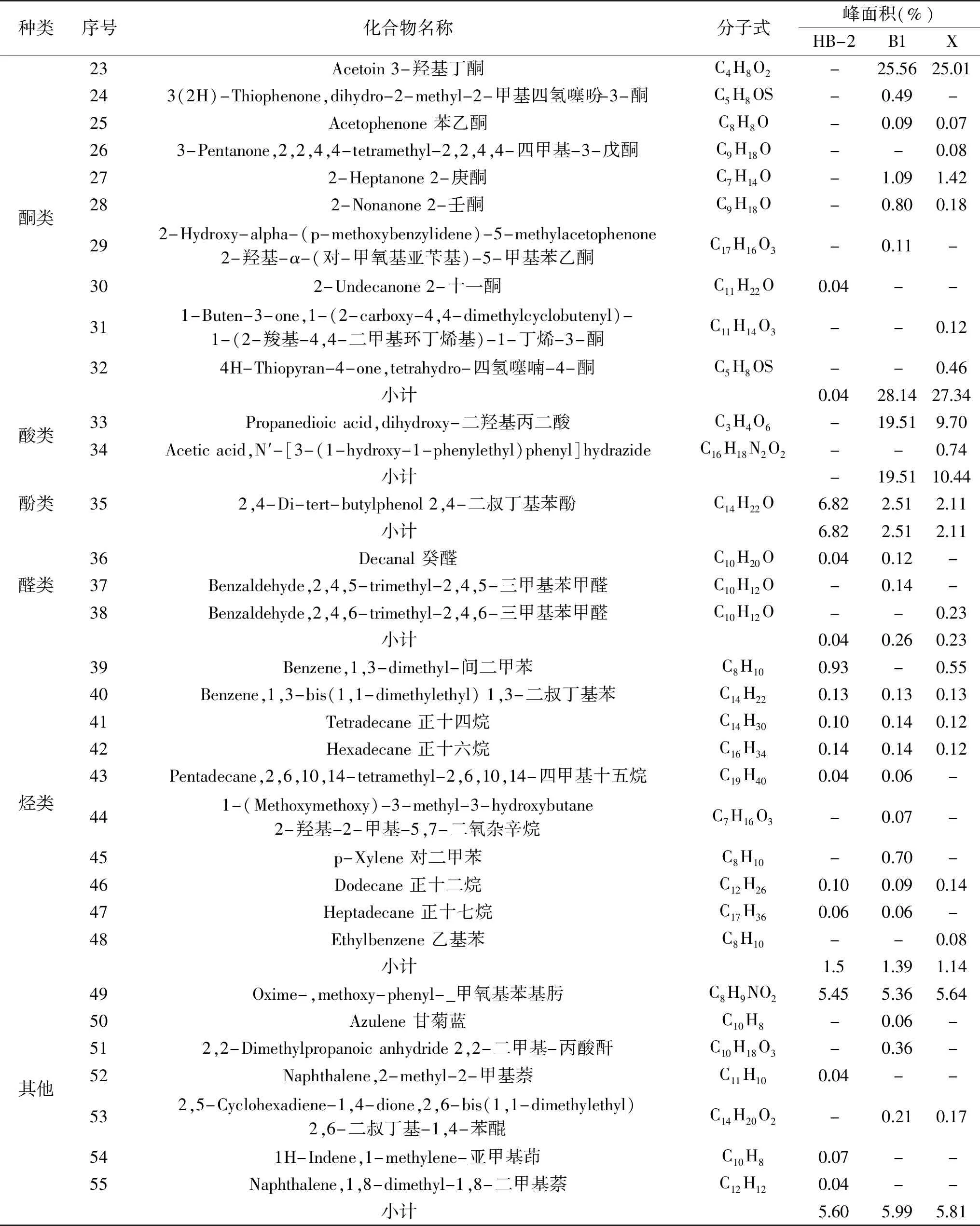
续表
3 讨论
本研究活体预防试验中,三种芽孢杆菌发酵液处理的果实其病原菌菌斑直径都明显小于对照组,说明芽孢杆菌对链格孢菌的侵染有明显防治作用。芽孢杆菌的抑菌机制有很多,主要为产生拮抗物质、营养与空间竞争、诱导寄主产生抗性、与病原菌直接作用等方面[26],而本试验中芽孢杆菌在极早熟桃上对链格孢菌的抑制作用可能是由于芽孢杆菌能在果实上提前定殖和生长,与病原菌形成竞争优势,从而有效地抑制链格孢菌的生长。但不同芽孢杆菌在不同果实上的生长特点,对不同病原菌的抑制作用以及两者间微环境的不同[10],其抑菌机理都会有很大差异,仍需深入研究验证。另外,三种芽孢杆菌对极早熟桃采后品质也有明显的保鲜效果。维生素C可以延缓果实衰老,是衡量果实品质的一个重要指标;可溶性固形物含量是水果中各营养物质的综合表现,它的变化直接反映了果实的营养价值和贮藏品质[27];贮藏期间的桃果实中可滴定酸可维持自身的生命活动,其变化可以反映出果实品质的优劣[14];硬度亦是衡量果实成熟度和品质的重要指标,在桃的贮藏过程中果实中淀粉转化成可溶性糖,使果实硬度下降,在贮藏期保持一定的硬度可使果实在货架期能正常后熟软化[6]。本实验中三种芽孢杆菌均能显著降低了极早熟桃采后贮藏腐烂率,延缓果实VC含量、可滴定酸含量和硬度的下降(p<0.05),从而保持贮藏期果实品质。这与文献[4-5,14]的研究结果一致。
在离体试验中,芽孢杆菌HB-2、B1和X的发酵液和滤液均能明显抑制链格孢菌的菌丝生长,而灭活菌液没有明显抑制作用,这说明加热失去活性的菌体和次级代谢产物对病原菌是没有抑制活性的,而发酵液中的活菌和其分泌的次级代谢产物,以及滤液中的次级代谢产物可能都有明显抑菌作用,但三种芽孢杆菌分泌物质的抑菌机理仍需进一步验证。
许多微生物在生长代谢过程中都会产生多种挥发性抑菌物质,主要包括醇类、酯类、酮类、醛类、酸类、烃类等化合物,其中芽孢杆菌属具有广谱抑菌性,也能产生多种挥发性抑菌物质[17-18,20]。李宝庆等[28]研究表明枯草芽孢杆菌菌株BAB-1能产生少含有17种挥发性抑物质,主要为醇类、酮类、酸类、胺类、烷烃类等,同时明确了其中以甲酸为代表的5种挥发性物质具有抑菌活性;Yuan等[29]研究了解淀粉芽孢杆菌NJN-6菌株产生的11种挥发性物质可以完全抑制香蕉枯萎病菌菌丝的生长和孢子的萌发;郝象瑢等[16]研究了解淀粉芽孢杆菌LJ02菌株在代谢过程中产生的4-乙基苯酚、2-丙基环己酮两种挥发性气体均对黑腐皮壳菌有抑制效果。
本研究通过平板倒扣法得出芽孢杆菌HB-2、B1和X发酵液产生的挥发性气体均能明显抑制链格孢菌的生长,采用GC-MS对三种芽孢杆菌发酵液的挥发性物质成分进行进一步初步分析,鉴定出芽孢杆菌HB-2、B1和X分别能产生挥发性物质28种、31种和30种。与已报道的相关挥发性物质的鉴定结果相比,有2-乙基-1-己醇、壬醛、十二烷醇、正十四烷、2,3-丁二醇、2-壬酮、3-羟基丁酮、2-十一醇、豆蔻酸异丙酯、2,4-二叔丁基苯酚、苯甲醛、甲氧基苯基肟、甘菊蓝、2-壬醇等多种相同物质[19,24,30-32],而已报道的2-癸酮、苯并噻唑、二苯并呋喃、甲酸、二甲基二硫、甲基环丙烯等物质在三种芽孢杆菌中未发现[19,24,28-33]。三种芽孢杆菌挥发性物质的抑菌活性不同可能是因为三者的挥发性抑菌物质种类及其含量的存在差异,关于三种芽孢杆菌所产生的挥发性物质的结构特性、抑菌活性及抑菌机理尚不清楚,仍需进一步研究证实。
4 结论
本试验中供试的三种芽孢杆菌HB-2、B1和X在活体预防试验和平板对峙试验中对桃采后主要致病菌链格孢菌均有明显抑制作用,同时三种芽孢杆菌均能显著抑制早熟桃采后腐烂,维持果实品质;三种芽孢杆菌发酵液产生的挥发性气体亦能明显抑制链格孢菌的生长,通过SPME-GC-MS法对其挥发性物质成分进行定性分析,分别鉴定得到28种、31种和30种化合物,主要包括醇类、酯类、酮类、酸类、酚类、烃类和其他类化合物,其中2-乙基-1-己醇、壬醛、十二烷醇、正十四烷、2,3-丁二醇、2-壬酮、3-羟基丁酮等多种化合物已被报道存在于其他芽孢杆菌的挥发物质中。芽孢杆菌HB-2、B1和X对极早熟桃采后病害的生物防治具有良好应用潜力,为早熟桃的采后生物防治提供了理论依据。
