糊化处理对藜麦淀粉形态、结构及热特性的影响
2019-09-11孔茂竹余佳熹陈德长吕远平
孔 露,孔茂竹,余佳熹,陈德长,黄 锐,吕远平,*
(1.四川大学轻纺与食品学院,四川成都 610065;2.四川省旌晶食品有限公司,四川德阳 618000)
藜麦(ChenopodiumquinoaWilld)原产于南美洲,属苋科(Amaranthaceae)藜亚科(Chenopodiaceae)藜属(ChenopodiumL.)[1]。因含有丰富的营养成分,比例均衡的氨基酸种类、膳食纤维、矿物质和维生素,被称为“全能食物”[2-3]。藜麦中淀粉含量约为50%~60%[4],从藜麦中提取的淀粉颗粒可被用作乳液稳定颗粒、淀粉膜等,可应用于食品、化妆品、药物配方等领域,应用前景广泛[5-6]。但由于淀粉具有不溶于冷水,糊化温度较高等特性[7],因此对淀粉进行热处理后可以改善淀粉的加工特性。
糊化处理是指在一定温度下,淀粉颗粒吸水膨胀、体积增大、淀粉颗粒破裂,成为黏稠状胶体溶液的过程[8]。经糊化处理后的淀粉可应用于速冻食品、凝胶、可食用涂层中[9]。目前对淀粉热处理的研究主要集中于湿热处理,即低水分含量(10%~30%)和温度范围在高于玻璃化转变温度但低于糊化温度的热处理,淀粉分子的结构未破环[10-11],糊化处理对淀粉颗粒的影响不同于湿热处理,但目前关于糊化处理对淀粉形态、结构影响的研究还较少。目前针对藜麦淀粉的研究方向主要是淀粉的提取[11-12]以及改性研究[13-14],藜麦淀粉的糊化研究还未见报道。本文的创新点在于采用碱性蛋白酶提取藜麦淀粉,探究其在高温、高水分含量的糊化处理条件下其淀粉形态、结构及热特性的变化,填补藜麦淀粉在糊化处理条件下物化性质变化的研究空白。
因此,本文用碱性蛋白酶提取青海高原白藜麦(WC)、红藜麦(RC)和黑藜麦(BC),制得三种藜麦淀粉(WCS、RCS、BCS),将淀粉进行高温高水分的糊化处理,即得糊化白藜麦淀粉(GT-WCS)、糊化红藜麦淀粉(GT-RCS)和糊化黑藜麦淀粉(GT-BCS),比较糊化前后淀粉颗粒形态、大小、结构及热特性的变化,为藜麦淀粉进一步地开发利用提供理论基础。
1 材料与方法
1.1 材料与仪器
白藜麦、红藜麦、黑藜麦 青海绿洲种业有限公司;玉米直链淀粉、玉米支链淀粉标准品 上海源叶生物科技有限公司;碱性蛋白酶(100000 U/g) 浙江绿之源食品生物科技有限公司;高峰α-淀粉酶(100 U/mg) 安徽酷尔生物工程有限公司;无水乙醚、无水乙醇、氢氧化钠、冰乙酸、碘化钾、碘、溴化钾、可溶性淀粉、硫酸铜、亚甲蓝、酒石酸钾钠、亚铁氰化钾 均为分析纯,成都科龙化工试剂厂。
HWS-26型电热恒温水浴锅 上海齐倾科学仪器有限公司;FW型中草药粉碎机 天津市泰斯特仪器有限公司;UV-1800BPC型紫外分光光度计 上海美谱达仪器有限公司;SZF-06型粗脂肪测定仪 上海新家仪器有限公司;GZX-GF101-Z-BS型电热恒温鼓风干燥箱 上海跃进医疗器械有限公司;SQP型分析天平 北京赛多利斯科学仪器有限公司;TD-420型台式低速离心机 四川蜀科仪器有限公司;TGA-8000型差示扫描量热仪 美国Perkin-Elmer公司;EMPYREAN型X射线衍射仪 荷兰Panalytical公司;JSM-7500F型扫描电镜 日本JEOL公司;Nicolect-6700型傅里叶变换红外光谱仪 美国Nicolet公司;LA-300型激光粒度分析仪 日本HORIBA公司。
1.2 试验方法
1.2.1 淀粉含量测定 参考国标GB/T 5009.9-2016的酶水解法测定总淀粉含量;参考国标GB/T 15683-2008测定直链淀粉含量。
1.2.2 藜麦淀粉制备 三种藜麦原料(白藜麦、红藜麦、黑藜麦)用中草药粉碎机粉碎,过80目筛。取过筛藜麦粉,参考国标GB/T 5009.6-2016索氏抽提法除去脂肪,再用85%的乙醇除去可溶性糖。取脱脂脱糖后的藜麦粉,加入0.6%的碱性蛋白酶,按照料液比1∶12 g/mL加入pH9.0 0.01 mmol/L NaOH溶液(0.01 mmol/L)。将藜麦浆液放置于40 ℃的恒温水浴锅中酶解120 min,将酶解后的藜麦浆液进行离心(4000 r/min)10 min,离心温度为20 ℃,弃去上清液,用蒸馏水洗涤沉淀,于20 ℃下离心(4000 r/min)10 min,重复3次。将沉淀物于40 ℃烘箱中干燥,干燥至前后两次质量差不超过2 mg,干燥后过200目筛即得藜麦淀粉。
1.2.3 糊化藜麦淀粉的制备 将提取的藜麦淀粉于沸水浴中加热30 min,取出冷却后以4000 r/min的速度于20 ℃下离心10 min,弃去上清液,用蒸馏水洗涤沉淀,于20 ℃下离心(4000 r/min)10 min,重复3次。将沉淀物于40 ℃烘箱中干燥,干燥至前后两次质量差不超过2 mg,干燥后过200目筛备用,即得糊化藜麦淀粉。
1.2.4 颗粒形态观察 用双面胶粘取少量藜麦淀粉与糊化藜麦淀粉,以藜麦淀粉与糊化藜麦淀粉刚好铺满双面胶表面为准,将双面胶固定在样品台上,样品室放气,将准备好的样品放入样品室,抽真空,当真空度低于5×10-4kPa时,设定好加速电压15 kV、工作距离不能小于8 mm,将样品进行喷金处理,将扫描电子显微镜调到合适的倍数观察淀粉颗粒的形态。
1.2.5 颗粒粒径分析 藜麦淀粉的粒度分析采用干法测试,用空气充当分散介质。具体设置参数为:样品浓度34%,介质折射率1,样品折射率1.51。记录D(10)、D(50)、D(90)、D(97)、体积平均粒径D(4,3)、面积平均粒径D(3,2)、比表面积(表面积/体积)的值。粒度分析是将样品等同于近球形来测定的[15],其中D(10)、D(50)、D(90)、D(97)分别表示小于此粒径的颗粒体积含量占全部颗粒的10%、50%、90%、97%。体积平均粒径D(4,3)是粒径对体积的加权平均,面积平均粒径D(3,2)是粒径对表面积的加权平均,比表面积是单位体积颗粒的表面积。
1.2.6 晶体特性测定 用X射线衍射仪分别测定藜麦淀粉与糊化藜麦淀粉的晶体特性并计算结晶度。测试条件为:发散狭缝固定0.76 mm,阳极材料Cu,K-AlPa1波长1.540598 Å,K-AlPa2波长1.544426 Å,管压40 kV,管流35 mA,扫描范围2θ为5~40°,扫描步长为0.026°。
1.2.7 分子结构分析 将藜麦淀粉及糊化后的淀粉过200目筛,与溴化钾一同在红外灯下研磨,用傅里叶红外光谱仪测定淀粉分子与糊化后淀粉分子的结构。主要性能指标为:扫描范围400~4000 cm-1,最高分辨率0.09 cm-1,扫描次数32次,分辨率4 cm-1,信噪比:优于5000∶1。
1.2.8 糊化热特性测定 分别取藜麦原粉与藜麦淀粉2.0 mg,以料液比1∶3 g/mL向坩埚中加入超纯水,混合均匀,于冰箱中平衡放置过夜,取出待用。设置DSC升温程序:升温速率5 ℃/min,升温范围为20~100 ℃,氮气气体流量为20 mL/min。以空白坩埚为对照,记录糊化起始温度(To)、终止温度(Tc)、峰值温度(Tp)、糊化焓(ΔH),计算峰高指数(PHI)=ΔH/(Tp-To)以及糊化范围R=2×(Tp-To)[16]。
1.3 数据处理
采用Origin 8.5软件处理试验数据。光谱处理采用OMNIC软件进行数据处理,所有光谱都已扣除溴化钾的背景光谱,并进行自动基线校准、曲线平滑和归一化等处理。Jade6.5软件处理X射线衍射数据。
2 结果与分析
2.1 直链、支链淀粉含量
直链淀粉和支链淀粉的比例会影响淀粉的糊化、凝胶化、黏稠度、溶解度、膨胀能力、消化性和抗性等性质[17]。藜麦原粉及藜麦淀粉中直链、支链淀粉含量见表1。由表1可知,不同品种藜麦其淀粉含量、比例均有所不同,总体上藜麦原粉和淀粉中支链淀粉含量比直链淀粉高,藜麦原粉中白藜麦原粉支链淀粉含量最高,为34.11%,红藜麦原粉支链淀粉含量最低,为29.00%。藜麦淀粉中白藜麦淀粉支链淀粉含量最高,为58.80%,红藜麦淀粉中支链淀粉含量最低,为47.72%。直链与支链淀粉的含量影响淀粉糊化吸热,且支链淀粉含量越高,解开支链淀粉双螺旋结构所需温度也越高。
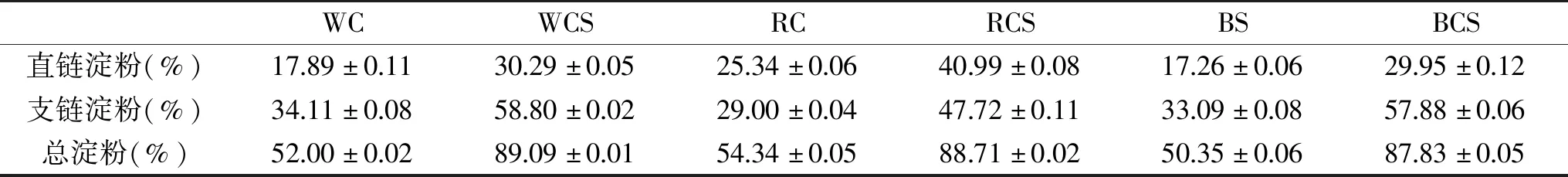
表1 藜麦直链、支链淀粉含量Table 1 Amylose and amylopectin content of Chenopodium quinoa
2.2 淀粉糊化前后形态分析
用扫描电镜观察不同藜麦淀粉及其糊化淀粉颗粒的表面形态特征,结果见图1。从图1中可以看出三种藜麦淀粉的颗粒大小均为1~2 μm,淀粉颗粒呈近球形,与文献[18-19]报导一致。颗粒表面光滑无损坏,可见碱性蛋白酶酶解过程未对淀粉颗粒造成不良影响。糊化过后的藜麦淀粉颗粒均变大,且淀粉颗粒由近球形转变为不规则形,这可能是由于淀粉无定形区的α-1,6糖苷键在热能和吸水溶胀的相互作用下结构变得松散,小分子淀粉发生链与链的交联,形成更大的结构[20]。同时三种淀粉颗粒表面出现破损和凹坑,有附着物和破碎微粒,这些附着物可能是淀粉碎片、脂类或淀粉蛋白复合物。与湿热处理相比[21],糊化处理后的淀粉分子结构破坏程度更高。由扫描电镜图可知,藜麦淀粉的颗粒较小(1~2 μm),远小于市面所售的小麦淀粉(9~10 μm)、玉米淀粉(9~11 μm)、土豆淀粉(10~20 μm)等常见的淀粉[22]。小颗粒淀粉具有良好的冻融稳定性、流动性、填充性和反应活性,因此藜麦淀粉在脂肪替代物、生物可降解材料、化妆品粉扑等领域有广泛的应用前景[23]。

图1 藜麦淀粉糊化前后颗粒形态分析Fig.1 Analysis of particle morphology before and after gelatinization of Chenopodium quinoa starch注:WCS、RCS、BCS电镜放大倍数为5000倍,GT-WCS、GT-RCS、GT-BCS电镜放大倍数为500倍。
2.3 淀粉颗粒粒度分析
不同藜麦淀粉糊化前后的粒径分布见表2,藜麦淀粉粒径主要分布在1~100 μm区间,糊化淀粉粒径主要分布于10~200 μm区间。从表2中可以看出淀粉粒径与体积平均粒径、面积平均粒径呈正相关,与比表面积呈负相关。其中D(10)数值更接近于单个淀粉颗粒粒径,D(50)、D(90)、D(97)数值较大,可能是由于淀粉颗粒紧密集中,导致粒径变大。
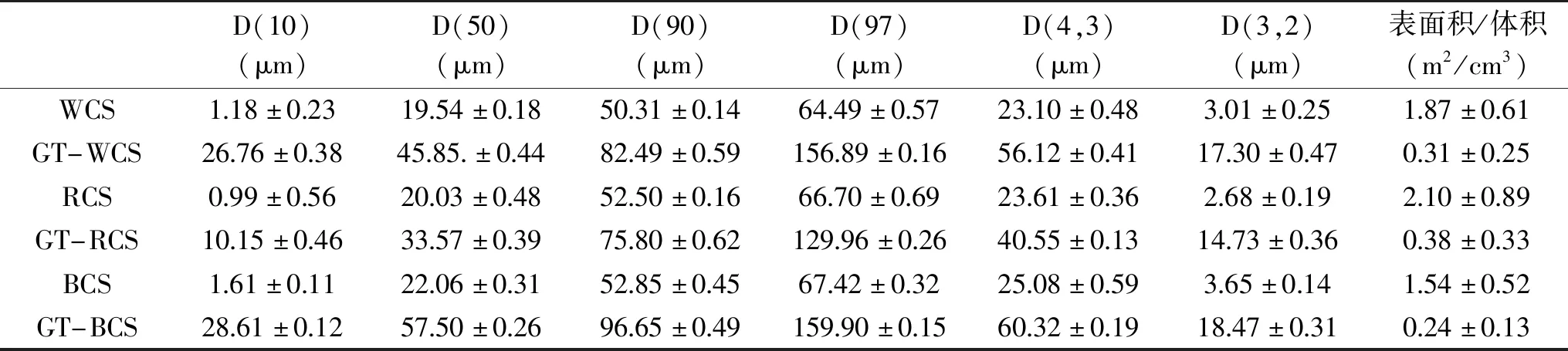
表2 藜麦淀粉糊化前后粒度分析Table 2 Grain size analysis before and after gelatinization of Chenopodium quinoa starch
表2中黑藜麦淀粉的粒径、体积平均粒径、面积平均粒径均大于白、红藜麦淀粉。糊化后的藜麦淀粉粒度显著增大,糊化黑藜麦淀粉粒径也大于其他两种糊化淀粉。
2.4 淀粉糊化前后晶体结构分析
藜麦淀粉和糊化淀粉的XRD图像及晶体特征见图2及表3。由于淀粉颗粒中包含着微晶区域和无定型区域两种结构,故天然淀粉可由XRD射线衍射图得出微晶区域的晶体类型[24-25]。淀粉晶体类型分为A、B、C型三大类,A型晶体的淀粉主要分布于谷物中,如小麦、稻米等作物;B型晶体的淀粉主要分布于根茎中,如:马铃薯等作物;C型晶体的淀粉主要分布于一些豆类作物中。其中A型晶体的衍射峰出现在15°、17°、18°、23°附近,由图2可知,藜麦淀粉属于典型的A型晶体结构。表3中不同种类的淀粉其结晶度有所不同,结晶峰的强度也不同。其中白藜麦淀粉结晶度最高,为38.46%,红藜麦淀粉结晶度最低,为33.14%。黑藜麦淀粉的结晶峰强度最大,表明黑藜麦淀粉双螺旋结构强度最大。经糊化处理后,三种淀粉的A型晶体结构消失,只剩单峰,糊化红藜麦淀粉与糊化黑藜麦淀粉单峰强度相差不大,糊化白藜麦淀粉峰强度最低,这可能是由于白藜麦淀粉中支链淀粉含量最高,支链淀粉所形成的双螺旋结构结晶区最大,受到的破坏也最大。结晶度主要受温度、浓度、淀粉链长度的影响,糊化后晶体结构消失可能是由于温度过高,结晶区域由定型态转为不定型态,同时晶体也会受到过多水分的影响而发生部分微晶溶解,使得微晶体中部分晶体变为无定型状态,从而导致晶体结构消失或结晶度下降[26]。

表3 藜麦淀粉晶体特征Table 3 Crystal characteristics of Chenopodium quinoa starch

图2 藜麦淀粉糊化前后XRD衍射图Fig.2 XRD diffraction pattern before and after gelatinization of Chenopodium quinoa starch
2.5 淀粉糊化前后结构分析
图3为藜麦淀粉糊化前后的傅里叶红外光谱图,表4为藜麦淀粉结构分析特征峰表。从图3中可以看出糊化处理对藜麦淀粉分子结构没有损坏,键与键的连接没有断裂。透过率反映样品对红外光的吸收程度,透过越高,说明该波数处样品的吸收越低。图3表现为三种糊化淀粉透过率增加,其中糊化红藜麦淀粉和糊化黑藜麦淀粉透过率高于糊化白藜麦淀粉,可能是由于糊化处理后,结晶区被高温和吸水溶胀作用破坏或无定形区结构增加导致样品对红外光的吸收降低。红外图谱(图2)与X射线衍射图谱(图3)比较可知,糊化处理破坏了连接淀粉双螺旋结构的氢键,导致藜麦淀粉结晶区被破坏,A型晶体结构消失,但无法破坏淀粉之间的键与键的连接,说明可以通过红外光谱与XRD衍射联用来分析淀粉结晶区与非结晶区域变化关系。
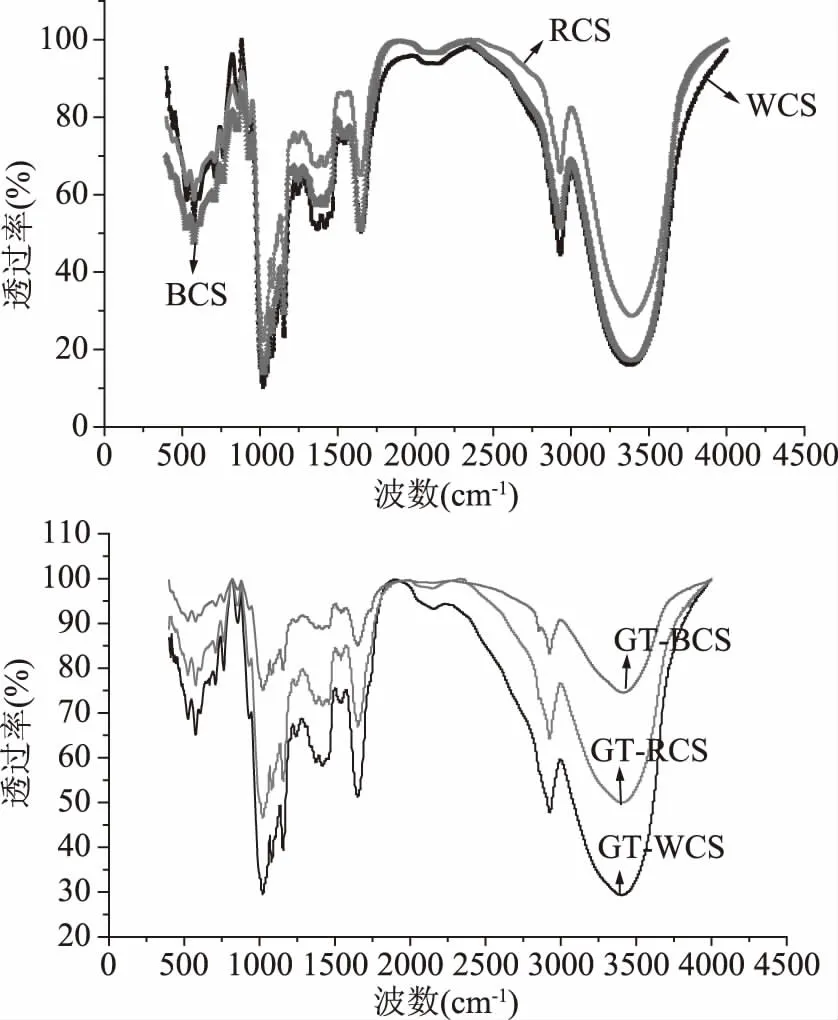
图3 藜麦淀粉糊化前后傅里叶红外光谱图Fig.3 Fourier infrared spectroscopy before and after gelatinization of Chenopodium quinoa starch
表4为藜麦淀粉、糊化藜麦淀粉在红外下的吸收峰值以及相应的分子键振动方式,与标准峰值相比,三种藜麦淀粉、糊化藜麦淀粉的峰值大小均有细微差别但总体上与标准峰值保持一致。淀粉样品在 3399.85 cm-1处的峰反映水的OH键在红外光谱下的吸收情况,859.85 cm-1处有指示淀粉的D-吡喃葡萄糖的α型振动吸收峰,三种藜麦淀粉的吸收峰波长分别为861.29、859.56、856.28 cm-1,糊化藜麦淀粉此处的吸收峰波长为862.82、858.36、859.62 cm-1,糊化前后吸收峰的波长变化在859.85 cm-1处周围浮动。由于淀粉中含有多羟基醛,故1641.41 cm-1反映淀粉的醛基伸缩振动,1080.61和928.40 cm-1附近的峰能反映伯羟吡喃糖环C-O-H伸缩振动和α-1,4糖苷键(C-O-C)的骨架振动。糊化前后藜麦淀粉吸收波长变化不大,但透过率有所增加,可能由于糊化处理对淀粉的双螺旋结构有重新定位的作用或对一些连接相邻双螺旋的氢键存在破坏作用,导致对红外光吸收降低。
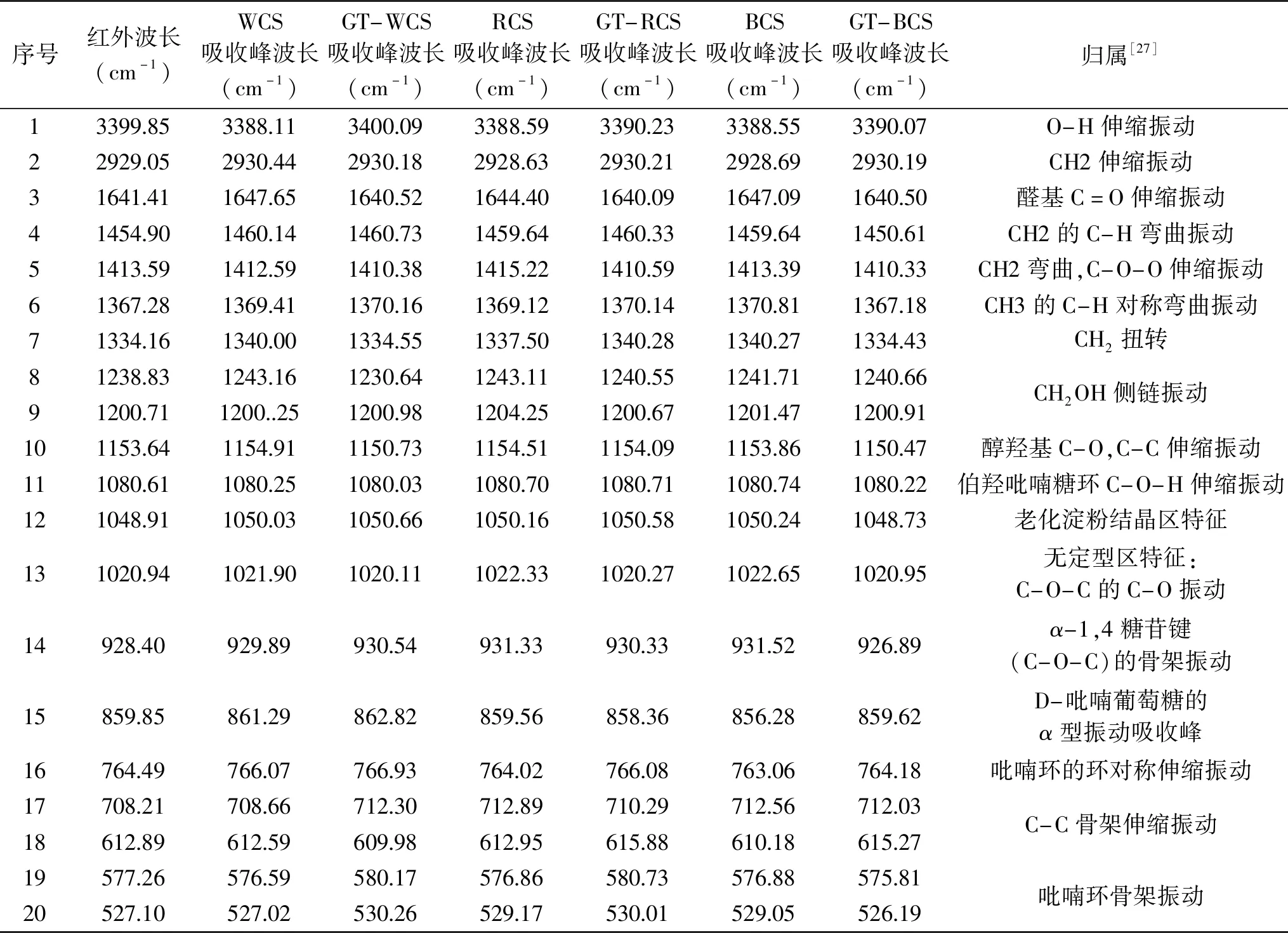
表4 藜麦淀粉结构分析Table 4 Structure analysis of Chenopodium quinoa starch
2.6 淀粉分子热特性
藜麦原粉与藜麦淀粉的热特性见表5,以可溶性淀粉为参照物,可知藜麦原粉和藜麦淀粉的糊化晗均低于可溶性淀粉,这可能是由于原粉和淀粉中含有的非淀粉成分,如:蛋白质、脂质、盐等,影响淀粉糊化吸热[28]。藜麦淀粉的糊化起始温度、终止温度、峰值温度都比原粉高,糊化晗比文献报道的略低[29-30]。淀粉糊化的过程实际上是淀粉结晶区域的溶解,其中包括直链淀粉的浸出、结晶区域支链淀粉双螺旋结构的断裂和分解[31]。有研究发现在玉米淀粉中由于直链淀粉含量不同而导致淀粉的结构特征改变,引起热力学性质的变化,糊化温度随着支链淀粉的增加而呈现上升的趋势[32]。说明糊化温度与淀粉直链/支链淀粉含量有关且支链淀粉含量越高,解淀粉分子双螺旋结构需要的温度就越高。表1中白藜麦淀粉和黑藜麦支链淀粉含量均高于红藜麦淀粉,故白藜麦与黑藜麦淀粉糊化起始温度高,红藜麦淀粉糊化起始温度最低。表5中白、红藜麦淀粉的糊化焓均高于原粉,黑藜麦淀粉的糊化焓比原粉略低,三种藜麦淀粉的峰高指数均高于原粉,可能是由于原粉中的杂质影响淀粉糊化吸热。三种原粉的糊化范围相差不大(标准偏差为1.19%),但淀粉的糊化范围相差较大(标准偏差为4.92%)。
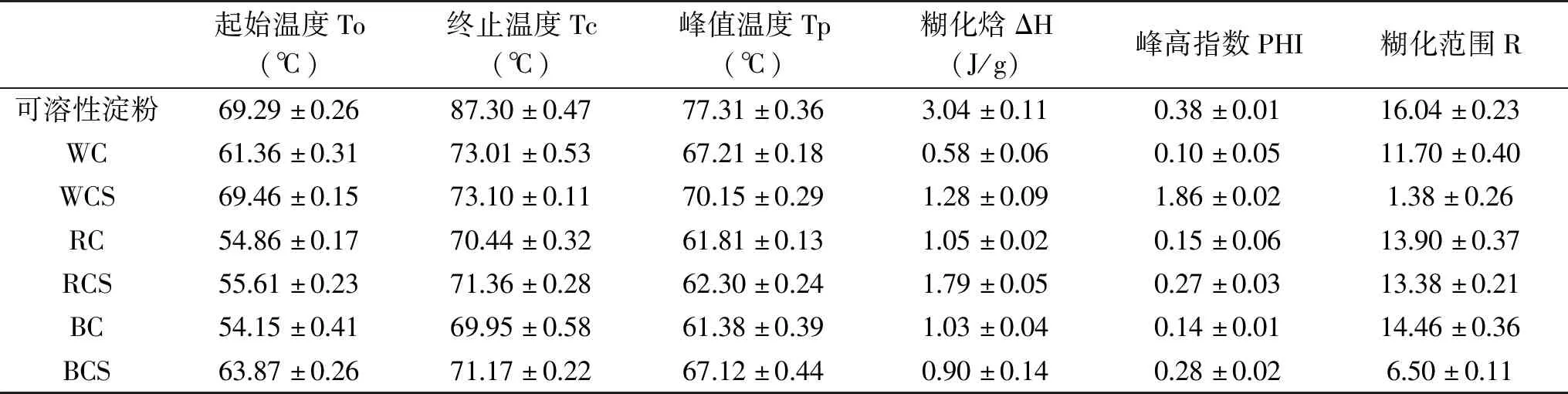
表5 藜麦原粉和藜麦淀粉热特性Table 5 Thermal properties of Chenopodium quinoa and Chenopodium quinoa starch
3 结论
采用碱性蛋白酶提取藜麦淀粉后发现藜麦淀粉中支链淀粉含量比直链淀粉高,其中白藜麦淀粉中支链淀粉含量最高,为58.80%。扫描电镜图显示酶提取的淀粉颗粒表面光滑无损伤,证明碱性蛋白酶不会对藜麦淀粉颗粒造成损害。经过糊化处理后,三种淀粉颗粒的表观形态均出现孔洞与凹坑,淀粉晶体结构消失,支链淀粉双螺旋结构分解,结晶区由定型态向不定型态转变。通过分析XRD衍射图谱得出白、红、黑藜麦淀粉的晶体结构为A型,结晶度分别为38.46%、33.14%、35.21%,白藜麦淀粉糊化后结晶峰强度最低,结晶区受到更大程度的破坏。傅里叶红外光谱显示糊化后藜麦淀粉分子结构无变化,分子键未断裂。支链淀粉含量高的白藜麦淀粉与黑藜麦淀粉糊化起始温度明显高于红藜麦淀粉。综上所述,糊化处理后的淀粉颗粒在形态、大小、晶体结构上均有不同程度的变化。本文为糊化淀粉的加工特性变化提供理论依据,可以通过控制糊化过程的工艺参数获得不同用途的藜麦淀粉产品。
