免疫球蛋白和T淋巴细胞亚群评价重度颅脑损伤预后
2019-09-10王小言夏鹰金虎陈伟明陈晓东聂柳
王小言 夏鹰 金虎 陈伟明 陈晓东 聂柳




[摘要]目的 探讨免疫球蛋白IgG、IgM、IgA和T淋巴细胞亚群CD4+、CD8+、CD4+/CD8+在评价重度颅脑损伤(SHI)病人预后中的应用及价值。方法 选取SHI手术治疗病人56例(重型组)、中型颅脑损伤病人32例(中型组)、轻型颅脑损伤病人40例(轻型组),另选取同期健康体检者40例为对照组。比较4组受试者入院即刻外周血T淋巴细胞亚群CD4+、CD8+和CD4+/CD8+水平,免疫球蛋白IgA、IgG和IgM水平,以及T淋巴细胞转化率。比较3组颅脑损伤病人伤后1 d脑水肿体积以及伤后3个月格拉斯哥预后(GOS)评分和BI评分。伤后3个月对SHI病人进行预后分组,GOS评分4、5分为A组,1~3分为B组,比较2组病人入院即刻的免疫指标水平。分析SHI病人各免疫指标水平与伤后3个月GOS评分、BI评分、脑水肿体积的相关关系。结果 重型组CD4+、CD4+/CD8+、淋巴细胞转化率、IgG、IgA和IgM均顯著低于中型组、轻型组和对照组,差异有显著性(F=126.99~338.32,P<0.05),重型组CD8+显著高于中型组、轻型组和对照组(F=83.46,P<0.05)。重型组伤后1 d脑水肿体积显著高于中型组、轻型组,伤后3个月GOS评分及BI评分显著低于中型组、轻型组,差异有显著性(F=108.20~290.55,P<0.05)。伤后3个月,A组CD4+、CD4+/CD8+、IgG、IgM、IgA均显著高于B组,而CD8+显著低于B组(t=4.564~11.646,P<0.05)。SHI病人CD4+、CD4+/CD8+、IgG、IgM、IgA均与GOS评分和BI评分显著正相关(r=0.506~0.801,P<0.05),与脑水肿体积显著负相关(r=-0.731~-0.485,P<0.05)。血清CD8+水平与GOS评分、BI评分负相关(r=-0.735、-0.703,P<0.05),与脑水肿体积正相关(r=0.797,P<0.05)。结论 免疫球蛋白IgG、IgM、IgA和T淋巴细胞亚群CD4+、CD8+、CD4+/CD8+能够准确反映颅脑损伤的病情程度,并对SHI预后有较好的预测效果。
[关键词]免疫球蛋白类;T淋巴细胞亚群;颅脑损伤;预后
[中图分类号]R651.15
[文献标志码]A
[文章编号] 2096-5532(2019)05-0595-05
doi:10.11712/jms201905022
[开放科学(资源服务)标识码(OSID)]
重型颅脑损伤(SHI)病人病情复杂、进展变化快,常可出现意识功能障碍,长时间昏迷状态可致不良预后[1]。已有研究表明,颅脑损伤病人常伴有免疫指标水平异常[2]。然而目前国内外对SHI病人免疫功能变化及其与病人预后的关系研究报道甚少。明确SHI病人免疫指标变化对其预后的预测作用可为病人预后的改善提供临床依据。本文研究检测了56例SHI病人T淋巴细胞亚群以及免疫球蛋白水平,并与不同程度颅脑损伤病人进行对比,探讨SHI病人各项免疫指标与预后的关系。现将结果报告如下。
1 资料和方法
1.1 一般资料
2014年1月—2017年1月间,选取我院收治的需手术治疗、格拉斯哥昏迷量表(GCS)评分≤8分的SHI病人56例(重型组)、中型颅脑损伤病人(8分<GCS≤12分)32例(中型组)、轻型颅脑损伤病人(12分<GCS≤14分)40例(轻型组),分组标准参照Satapathy的研究设计[3]。入选标准:①病人于伤后3 h内入院,且均于入院后1.5 h内入组参加研究[4];②病人均符合《颅脑创伤临床救治指南》中相关诊断标准[5],有明显颅脑外伤;③有手术指征者先予手术治疗,手术方式、手术适应证及术后治疗均按照《颅脑创伤临床救治指南》执行[5],术后必要时给予气管切开及使用呼吸机。排除术前休克、输血及近期使用激素及免疫制剂治疗病人。另选取同期来院体检的健康者40例为对照组。4组受试者基线资料、3组颅脑损伤病人损伤类型比较差异无显著性(P>0.05)。见表1。
1.2 T淋巴细胞亚群以及免疫球蛋白水平检测
病人入院后即刻采集外周静脉血,分离血清,置-20 ℃冷冻保存,成批检测。采用显微镜下计数200个淋巴细胞的方法测定外周血T淋巴细胞转化率(检测试剂购自广东中山生物工程有限公司);直接荧光免疫法测定T淋巴细胞亚群CD4+、CD8+细胞水平以及CD4+/CD8+细胞比值,所用单抗均为IgG型单抗,以F1TC、PE直接标记,在EPICS XL型流式细胞仪(Beckman Coulter公司,美国)上进行测定;采用免疫比浊法测定IgA、IgG和IgM水平(日本东芝TBA-40FR Biochemical Analyz-ER)。
1.3 影像学及免疫学指标检测
所有病人均于伤后1 d行颅脑CT检查,由2名高年资主治医师或者以上的医师共同读片,计算脑水肿体积。脑水肿体积=(颅脑CT 所示脑水肿最大层面的长×宽×层/2)-(该层面血肿的长×宽×层/2)[6]。伤后3个月行格拉斯哥预后(GOS)评分和Barthel 指数(BI)评分[7-8],根据GOS评分评价病人预后: 5分为良好,病人神志清,言语及肢体功能恢复正常; 4分为中残,病人神志清,生活能自理; 3分为重残,病人神志清,需他人照顾; 2分为植物生存,病人长期昏迷,呈去皮质或去大脑强直状态; 1分即病人死亡。根据GOS评分结果,将病人分为2组,GOS评分4、5分为A 组,1~3分为B 组,比较2组入院即刻的T淋巴细胞亚群CD4+、CD8+和CD4+/CD8+水平,以及免疫球蛋白IgA、IgG和IgM水平;分析SHI病人的CD4+、CD8+、CD4+/CD8+、IgA、IgG和IgM水平与伤后3个月GOS评分和BI评分的相关关系。
1.4 统计学方法
采用SPSS 20.0软件进行统计学分析,计量资料结果以[AKx-D]±s形式表示,多组数据间比较采用方差分析,两两比较采用SNK-q检验;两组计量资料比较采用t检验;计数资料比较采用卡方检验;相关关系分析采用Pearson检验。P<0.05表示差异有统计学意义。
2 结果
2.1 各组T淋巴细胞亚群以及免疫球蛋白比較
重型组CD4+、CD4+/CD8+、淋巴细胞转化率、IgG、IgA和IgM均显著低于中型组、轻型组和对照组(F=126.99~338.32,q=5.015~42.515,P<0.05);中型组除IgA水平与轻型组差异无显著性,其余各指标显著低于轻型组和对照组(q=7.443~21.502,P<0.05);轻型组除IgA、IgM外,其他指标均低于对照组(q=5.329~11.477,P<0.05)。重型组CD8+则显著高于中型组、轻型组和对照组(F=83.46,q=6.301~18.622,P<0.05),中型组CD8+显著高于轻型组和对照组(q=10.109、10.368,P<0.05),但轻型组与对照组比较(P>0.05)。见表2。
2.2 不同程度分组SHI病人脑水肿体积及GOS、BI评分比较
重型组伤后1 d脑水肿体积显著高于中型组、轻型组, 中型组则高于轻型组,差异有统计学意义(F=290.55,q=14.204~33.905,P<0.05)。重型组伤后3个月GOS评分及BI评分显著低于中型组、轻型组, 中型组则低于轻型组,差异有统计学意义(F=108.20、161.93,q=6.473~24.805,P<0.05)。见表3。
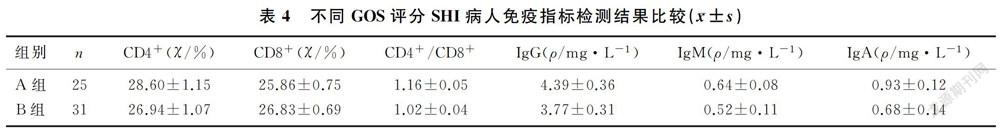
2.3 不同GOS评分SHI病人免疫指标比较
损伤后3个月,A组CD4+、CD4+/CD8+、IgG、IgM、IgA均显著高于B组,而CD8+则显著低于B组,差异均有统计学意义(t=4.564~11.646,P<0.05)。见表4。
2.4 SHI病人各免疫指标与GOS评分、BI评分和脑水肿体积相关关系
SHI病人CD4+、CD4+/CD8+、IgG、IgM、IgA均与GOS评分、BI评分呈显著正相关(r=0.506~0.801,P<0.05),与脑水肿体积呈显著负相关(r=-0.735~-0.485,P<0.05);血清CD8+水平则与GOS、BI评分呈负相关(r=-0.735、-0.703,P<0.05),与水肿体积呈显著正相关(r=0.797,P<0.05)。见表5。
3 讨论
SHI病死率为30%~50%[9],以往对SHI病情预测均依靠GOS评分,但由于SHI病人大多数情况下需要气管插管,且院外急救时肌松剂、镇静剂的应用会对GOS评分产生干扰;同时,GOS评分采用的参数为等级数据而非计量数据,故单纯使用GOS评分并不能很好地反映病情及评估预后[10]。有研究认为,SHI大部分并发中枢神经系统局部反应,亦可并发全身系统性反应,因此外周血中一些生化、免疫指标水平可以反映SHI的情况[11]。近年来有研究认为,由于颅脑损伤病人免疫系统的紊乱,大量异常分泌的皮质醇可导致血清抑制因子水平升高,从而出现免疫指标异常表达[12];颅脑外伤引起的免疫抑制及继发损害、并发感染等不良事件可能会严重影响病人的预后和生存情况[13],故应用免疫指标对SHI病情进行评估可对后续治疗及预后预测产生积极意义。
淋巴细胞亚群是机体免疫系统内功能最重要的一大细胞群,其中主要包括CD4+、CD8+、CD4+/CD8+[14-16];人体内最常见的免疫球蛋白是IgG、IgM和IgA[17-18];淋巴细胞转化率主要反映总的细胞免疫功能[19-21]。以上指标均为人体常见免疫功能监测指标。本研究检测了SHI病人上述各项指标水平,并与中型、轻型颅脑损伤及健康对照人群进行对比,结果显示,重型组SHI病人的CD4+、CD4+/CD8+水平低于中型组、轻型组和对照组,CD8+高于其他3组。分析原因主要为:①颅脑创伤后巨噬细胞和中性粒细胞异常活化,创伤越重则应激反应和相对应的炎性反应也越重,血清中前列腺素E2水平会显著增高[22],并结合血清中的免疫抑制因子和脑抗原,在对免疫系统产生向下调控的同时还可以激活T淋巴细胞并促其向CD8+转化,并且激活CD8+,导致免疫抑制;②创伤后病人血清中除出现多种具有免疫抑制作用的血清因子外,血清中具有免疫增强作用的物质,如纤维结合蛋白大量减少,这些物质共同作用于机体导致免疫抑制。本文结果还显示,重型组淋巴细胞转化率显著低于其他3组。提示颅脑创伤时病人由于应激反应,导致交感神经兴奋,大量分泌儿茶酚胺、乙酰胆碱及各种兴奋性氨基酸等内源性神经激素,抑制淋巴细胞转化[23];且病情越重,应激反应越剧烈,免疫抑制越强。另外,本文研究结果还显示,颅脑损伤病人重型组IgG、IgM、IgA水平低于中型组、轻型组和对照组,中型组IgA水平与轻型组比较差异无显著性,轻型组IgM水平与对照组比较差异无统计学意义。这主要是因为,应激创伤使SHI病人调控全身免疫功能的下丘脑因为直接或间接因素产生变性、缺血、低氧、梗死、水肿,引起下丘脑-垂体-甲状腺轴功能异常,使机体内分泌和代谢功能发生紊乱,从而通过对激素水平、神经递质、内啡肽、交感神经等的影响而调节免疫功能[24];而颅脑损伤时产生的应激反应、升高的激素水平及机体创伤恢复状态所致营养不良等因素,均可降低中枢神经系统内免疫球蛋白的含量,并抑制其合成[25];加上T细胞功能抑制、抗体消耗过度、蛋白丢失,导致机体创伤后免疫球蛋白水平较低。同时,由本文研究结果可看出,SHI病人免疫球蛋白IgG的浓度波动较IgA和IgM更大;而对于中型颅脑损伤病人,其损伤较SHI轻,其含量较少的IgA波动幅度较小,IgA水平与轻型组相近,而含量较多的免疫球蛋白IgM水平变化幅度较大,其水平较轻型组更低;而轻型病人血-脑脊液屏障破坏较小,部分病人创伤较轻,激素变化水平小而渗入血液的组织抗原也不多,故免疫球蛋白整体波动较小。这也与国内外部分研究的结果相一致[26]。
有研究对SHI病人预后进行观察显示,SHI除可以导致T淋巴细胞亚群数量紊乱外,还能使淋巴细胞的功能也发生障碍,使吞噬细胞的活化受抑制,影响机体抗感染的能力,导致感染增加,而T细胞亚群异常也可能导致骨髓造血细胞的增殖和分化障碍[27]。本文研究结果显示,预后较差甚至死亡的SHI病人(A组)血清CD4+、CD4+/CD8+较预后良好病人(B组)降低而CD8+升高,并且SHI病人無论是CD4+还是CD4+/CD8+,均与GOS评分、BI评分显著正相关,与脑水肿体积显著负相关;而血清CD8+水平则与GOS评分、BI评分负相关,与水肿体积显著正相关。从免疫球蛋白的变化来看,创伤应激会刺激机体交感神经兴奋,从而促进儿茶酚胺、乙酰胆碱及各种兴奋性氨基酸等内源性神经激素释放,其在抑制机体免疫系统功能、降低机体免疫球蛋白水平、增加机体创伤后感染风险的同时[28-29],还会通过高水平钙离子、氧化应激反应等途径对神经元细胞产生毒性作用,并破坏神经元蛋白结构[30],故本文预后较差甚至死亡的SHI病人(B组)IgG、IgM、IgA较预后良好病人明显降低,且SHI病人的IgG、IgM、IgA与GOS评分、BI评分显著正相关,而与脑水肿体积显著负相关。
综上所述,IgG、IgM、IgA和CD4+、CD8+、CD4+/CD8+能够准确反映机体颅脑损伤的病情程度,对SHI预后有较好的预测效果。如何尽可能提高SHI病人免疫功能,防治严重的全身性感染,同时控制免疫应答强度,减轻因创伤应激导致的全身性炎症反应,减弱免疫系统对脑组织的攻击,从而协调免疫系统功能改善与全身炎症反应减轻及保护脑组织之间关系将会是下一步研究的焦点。
[参考文献]
[1]CHECKLIN M, ETTY L M, ISELI T, et al. Saliva management options for difficult-to-wean people with tracheostomy following severe acquired brain injury(ABI): a review of the literature[J]. Brain Injury, 2015,29(1):1-10.
[2]CORPS K N, ROTH T L, MCGAVERN D B. Inflammation and neuroprotection in traumatic brain injury[J]. JAMA Neurology, 2015,72(3):355-362.
[3]SATAPATHY M C, DASH D, MISHRA S S, et al. Spectrum and outcome of traumatic brain injury in children<15 years: a tertiary level experience in India[J]. International Journal of Critical Illness and Injury Science, 2016,6(1):16-20.
[4]STEWARD O, SHARP K G, YEE K M, et al. Characterization of ectopic colonies that form in widespread areas of the nervous system with neural stem cell transplants into the site of a severe spinal cord injury[J]. Journal of Neuroscience, 2014,34(42):14013-14021.
[5]江基尧. 现代颅脑损伤学[M]. 4版. 上海:第二军医大学出版社, 2015:10-13.
[6]李季林,盛罗平,陈仁辉,等. 颅脑损伤后血清中MMP-9、S-100B蛋白的表达与颅脑损伤严重程度及脑水肿相关性的研究[J]. 创伤外科杂志, 2017,19(3):185-188.
[7]李佩云,李春芳,孙力. 高压氧疗法对颅脑损伤患者BI指数,GCS,SAS,SDS的影响[J]. 海南医学院学报, 2017,23(16):2289-2295.
[8]李永锋,刘博. 重型颅脑损伤患者围术期脑脊液免疫球蛋白和T淋巴细胞亚群水平变化的临床意义[J]. 中国医学前沿杂志(电子版), 2015,7(11):128-132.
[9]邹天雷,赵永茂. 早期免疫营养对重型颅脑损伤患者营养状况及免疫功能的影响[J]. 广西医学, 2014,36(3):322-325.
[10]HOOGMARTENS O, HESELMANS A, VAN DE VELDE S A, et al. Evidence-based prehospital management of severe traumatic brain injury: a comparative analysis of current clinical practice guidelines[J]. Prehospital Emergency Care, 2014,18(2):265-273.
[11]ZHANG Zuyong, ZHANG Lixin, DONG Xiaoqiao, et al. Comparison of the performances of copeptin and multiple biomarkers in long-term prognosis of severe traumatic brain injury[J]. Peptides, 2014,60(10):13-17.
[12]RISDALL J E, CARTER A J, KIRKMAN E, et al. Endothelial activation and chemoattractant expression are early processes in isolated blast brain injury[J]. British Journal of Anaesthesia, 2013,111(2):314P-315P.
[13]李智奇,吴惺,胡锦,等. 颅脑损伤患者发生颅内感染的经验分析与总结[J]. 中华神经外科杂志, 2014,30(11):1115-1119.
[14]汪丹,陈小来. 不同级别颅脑胶质瘤患者外科治疗后的细胞免疫状况研究[J]. 医学临床研究, 2016,33(8):1489-1491.
[15]任丽,黄铭娜,冯季灵,等. 脑梗死患者的细胞免疫与体液免疫的变化规律研究[J]. 中华细胞与干细胞杂志(电子版), 2018,8(6):343-347.
[16]崔国胜,刘四新,夏清岫,等. 标准大骨瓣开颅术对重型颅脑损伤患者围术期炎性应激及代谢状态的影响[J]. 医学综述, 2016,22(9):1867-1870.
[17]黄健,唐晓霞. 缺氧缺血性脑病新生儿免疫功能的变化及其影响因素[J]. 海南医学, 2018,29(6):792-793.
[18]吴春颖,曹文军,吕建华,等. 颅脑损伤患者术后血清中细胞因子与体液免疫变化的临床意义[J]. 重庆医学, 2016,45(5):577-579.
[19]许俊,索源,曹立俊,等. 亚低温治疗对心肺复苏成功患者免疫功能、肺功能的影響[J]. 浙江临床医学, 2018,20(5):849-850.
[20]徐玥玮,陈光亮. 灵芪颗粒对小鼠免疫功能的影响[J]. 安徽中医药大学学报, 2017,36(1):59-62.
[21]张泽文,王端旭,林文杰,等. 复方皂矾丸对化学治疗所致粒细胞减少症临床疗效及部分机制研究[J]. 世界中医药, 2017,12(6):1324-1327,1331.
[22]张俊,陈晋,朱建军,等. 中性粒细胞与淋巴细胞比值对重型颅脑损伤预后的预测价值[J]. 浙江医学, 2016,38(8):534-537.
[23]漆建,苟章洋,唐晓平,等. 亚低温治疗对重型颅脑损伤患者免疫功能及预后的影响[J]. 中华神经外科疾病研究杂志, 2016,15(6):538-540.
[24]封林森,马建华,季海明,等. 颅脑损伤患者免疫功能变化的临床研究[J]. 现代中西医结合杂志, 2015,24(19):2105-2106.
[25]李翠燕,郭雪琴,潘彩霞. 免疫营养干预对老年重型颅脑损伤患者营养状况及免疫功能的影响[J]. 中国老年学杂志, 2016,36(8):1932-1934.
[26]朱国. 颅脑外伤后的免疫变化及调理[J]. 国际神经病学神经外科学杂志, 2011,38(4):403-406.
[27]梁惠,陈镜如,郭雯玲,等. 异基因骨髓移植联合胸腺上皮细胞移植动物模型的效应分析[J]. 广东医学, 2018,39(24):3610-3614.
[28]王献明,赵军苍,张莹莹. 标准大骨瓣减压术治疗重型颅脑损伤对患者围术期炎性因子、免疫球蛋白、T淋巴细胞亚群和脑代谢的影响[J]. 河北医药, 2017,39(11):1715-1720.
[29]闫凯旋,曹铖,杨磊,等. 糖尿病专用型肠内营养混悬液对重型脑损伤病人营养指标以及免疫功能的影响[J]. 肠外与肠内营养, 2018,25(2):76-80.
[30]王顺帆,尹常春,刘平. 术中亚低温治疗急性颅脑损伤后CD4+、CD8+及比值变化[J]. 创伤外科杂志, 2017,19(11);844-846.
(本文编辑 黄建乡)
