膀胱癌组织中细胞周期检测点激酶2的表达及其意义
2019-09-10井岗山张哲
井岗山 张哲



[摘要]目的 探讨细胞周期检测点激酶2(CHK2)在膀胱癌组织中表达及临床意义。方法 分别采用实时荧光定量PCR技术和免疫组织化学法,检测73例膀胱癌及癌旁组织中CHK2基因和蛋白的表达情况。结果 膀胱癌组织中CHK2 mRNA相对表达量低于癌旁组织,膀胱癌组织中CHK2蛋白阳性表达率低于癌旁组织,差异有统计学意义(t=24.146,χ2=49.936,P<0.05);膀胱癌组织中CHK2 mRNA相对表达量和CHK2蛋白阳性表达均与pT分期、淋巴结转移和P53蛋白表达有关(t=2.347~9.217,χ2=4.171~33.400,P<0.05);CHK2蛋白阴性表达组病人平均生存时间47.25个月,CHK2蛋白阳性表达组病人平均生存时间67.24个月,Log-Rank检验差异有统计学意义(χ2=4.269,P<0.05)。結论 CHK2在膀胱癌组织中呈低表达,且与病人预后有关。
[关键词]膀胱肿瘤;细胞周期检测点激酶2;病理学,临床
[中图分类号]R737.14;R365
[文献标志码]A
[文章编号] 2096-5532(2019)05-0510-04
doi:10.11712/jms201905002
[开放科学(资源服务)标识码(OSID)]
膀胱癌作为泌尿系统常见的恶性肿瘤,其发病率呈逐年升高的趋势,由于膀胱癌多呈浸润性生长,术后具有较高的复发率[1],严重威胁人类的健康。研究表明,细胞周期异常在肿瘤发生、进展和转移中发挥重要作用[2]。细胞周期检测点激酶2(CHK2)是调控细胞周期的主要激酶之一,与细胞周期稳定、DNA修复、基因组平衡等密切相关[3-5]。CHK2参与了多种恶性肿瘤发生及进展过程[6]。实验研究结果显示,RPA介导的膀胱癌TSGH-8301细胞生长抑制与CHK2激活相关[7]。但CHK2与膀胱癌临床病理特征及病人预后间的关系鲜有报道。本研究对膀胱癌组织中CHK2基因及蛋白表达进行检测,探讨其与临床病理特征之间的相关性及对预后的影响。现将结果报告如下。
1 资料与方法
1.1 一般资料
2010年3月-2012年3月,我院收治的膀胱癌病人73例,术前均未行放化疗,术后经病理活检证实为原发性尿路上皮性癌。73例病人,男性62例,女性11例;年龄28~81岁,平均年龄(61.7±11.4)岁。均于术中留取膀胱癌组织及癌旁组织(距肿瘤边缘>2 cm),组织标本分两份,其中1份用40 g/L甲醛溶液固定,石蜡包埋;另1份快速置于液氮中,保存于-70 ℃冰箱以备检。本研究通过医院伦理委员会批准,所有病人均知情同意。
1.2 方法
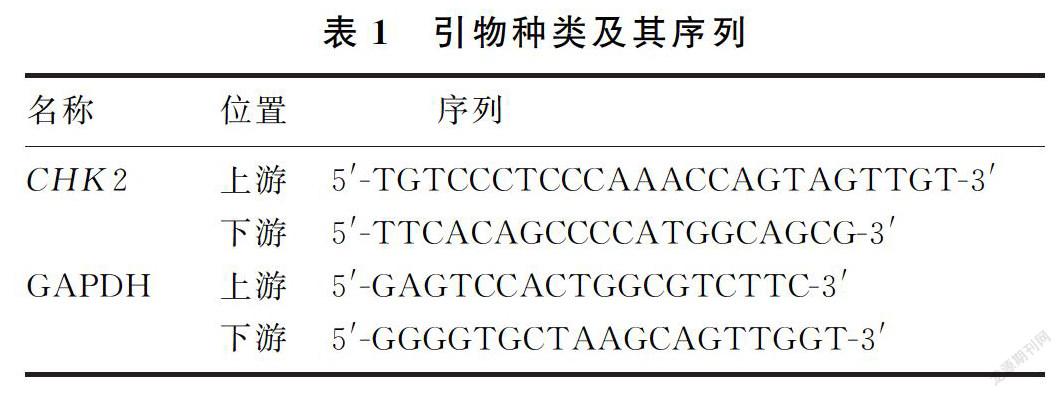
1.2.1 实时荧光定量PCR技术检测膀胱癌及癌旁组织中CHK2基因表达 分别取膀胱癌及癌旁组织,研磨,用Trizol总RNA提取试剂盒(购自美国Gibco公司)提取组织细胞中总RNA。利用紫外线分光光度计检测总RNA纯度和浓度,以A260/A2801.80~2.20作为合格。用逆转录试剂盒(购自大连宝生物公司)逆转录,用PCR试剂盒(购自日本TaKaRa公司)进行扩增。引物种类及其序列见表1。PCR反应条件:94 ℃、1 min,55 ℃、1 min,72 ℃、1 min,72 ℃、6 min,连续进行36次循环。每个样品均设3个平行反应复孔。用2-△△Ct法计算膀胱癌及癌旁组织中CHK2基因相对表达量。
1.2.2 免疫组化染色检测膀胱癌及癌旁组织中CHK2蛋白表达 取石蜡包埋组织标本,切片,常规脱蜡、水化,进行抗原修复,用体积分数为0.03的过氧化氢溶液封闭,山羊血清封闭25 min。加入一抗兔抗人CHK2多克隆抗体(购自武汉博士德公司,稀释比例1∶200),4 ℃下过夜孵育。加入二抗,室温下孵育60 min,加入DAB,苏木精复染,脱水、封片,观察。用双盲法分别由两位具有副高级以上职称医师观察,按照文献的方法[8]判定结果。①染色范围:0分,无染色;1分,阳性染色细胞比例<25%;2分,阳性染色细胞比例26%~50%;3分,阳性染色细胞比例51%~75%;4分,阳性染色细胞比例>75%。②染色强度:0分,无着色;1分,染色浅黄色;2分,染色黄色或棕色;3分,染色棕褐色。③染色指数:取①+②之和,0级,≤2分;1级,3~4分;2级,5~6分;3级,7分。根据染色指数对结果进行判定:阴性,0级或1级;阳性,2级或3级。
1.2.3 病例随访 所有病人均进行随访,随访形式包括门诊和电话,随访截止日期2017年3月31日,随访过程中未出现失访病例。
1.3 统计学分析
应用SPSS 21.0统计分析软件完成数据整理和分析。计量资料采用[AKx-D]±s表示,组间比较采用t检验;计数资料采用率表示,组间比较采用χ2检验;生存分析采用Kaplan-Meier法,生存曲线比较采用Log-Rank检验。以P<0.05为差异有显著意义。
2 结果
2.1 膀胱癌及癌旁组织CHK2基因和蛋白表达的比较
膀胱癌组织中CHK2 mRNA相对表达量明显低于癌旁组织,差异有统计学意义(t=24.146,P<0.05)。膀胱癌组织中CHK2蛋白的阳性表达率低于癌旁组织,差异具有统计学意义(χ2=49.93,P<0.05)。见表2和图1。
2.2 膀胱癌组织CHK2基因和蛋白表达与临床病理特征之间的关系
膀胱癌组织中CHK2 mRNA的相对表达量和CHK2蛋白阳性表达均与年龄、性别、肿瘤大小、肿瘤数量和分级无关(t=0.239~1.182,χ2=0.066~1.003,P>0.05),而与pT分期、淋巴结转移和P53蛋白的表达有关(t=2.347~9.217,χ2=4.171~33.400,P<0.05)。见表3。
2.3 膀胱癌組织中CHK2蛋白表达对病人预后的影响
本文73例膀胱癌病人中,截至2017年3月31日,最短生存时间5个月,最长84个月。CHK2蛋白阴性表达组病人的平均生存时间为47.25个月,而阳性表达组病人的平均生存时间为67.24个月,Log-Rank检验显示差异有统计学意义(χ2=4.269,P<0.05)。见图2。
3 讨论
膀胱癌作为一种男性高发恶性肿瘤,发病过程较为复杂,涉及多因素、多步骤[9-11],其中,细胞周期调控异常在肿瘤发生、进展中发挥关键性作用[12-14]。CHK2是一种细胞周期检查点激酶,在DNA损伤诱导的细胞周期阻滞、细胞凋亡、染色体组装及稳定中发挥重要作用[15-17]。有研究表明,CHK2表达异常会影响细胞周期及细胞修复而导致癌变风险增加[18-20]。CHK2在肿瘤发生中的作用尚存在争议,CHK2在乳癌[21]、肺癌[22]、结直肠癌[23]等恶性肿瘤中表达缺失,可能发挥抑癌基因的作用;但CHK2在胃癌、食管癌、肝癌等恶性肿瘤中表达上调[24-26],可能发挥癌基因的作用。本研究显示,CHK2在膀胱癌组织中呈低表达,提示CHK2可能在膀胱癌发生中发挥抑制作用。
本研究结果显示,CHK2 mRNA相对表达量和CHK2蛋白阳性表达在pT分期T2~T4期、发生淋巴结转移、P53蛋白阳性的膀胱癌组织中呈低表达,进一步说明CHK2低表达可促进膀胱癌进展,提示CHK2可能充当抑制肿瘤发生的角色而参与膀胱癌发生、进展过程。有研究指出,抑癌基因p53是DNA损伤反应中CHK2关键性作用靶点,CHK2在保证p53稳定及积累中发挥重要作用[27]。p53是一种抑癌基因,但经免疫组化检测到的均为突变型p53,因此与文献[27]不同,突变型p53对CHK2有负反馈调节作用[28]。本研究显示P53蛋白阳性表达的膀胱癌组织中CHK2呈低表达,也从另一个方面说明CHK2高表达对维持P53蛋白稳定发挥重要作用。本研究结果显示,CHK2蛋白阴性表达组病人平均生存时间短于阳性表达组,表明CHK2蛋白表达与膀胱癌病人预后有关,CHK2高表达可能预示着病人预后较好。
综上所述,CHK2在膀胱癌组织中呈低表达,可能由于其发挥抑制肿瘤发生的作用而参与膀胱癌发生、进展过程,且与病人预后相关,有望为膀胱癌诊疗提供新的靶位和思路。
[参考文献]
[1]MASSON-LECOMTE A, RAVA M, REAL F X, et al. Inflammatory biomarkers and bladder cancer prognosis: a systematic review[J]. European Urology, 2014,66(6):1078-1091.
[2]ABREU VELEZ A M, HOWARD M S. Tumor-suppressorgenes, cell cycle regulatory checkpoints, and the skin[J]. North American Journal of Medical Sciences, 2015,7(5):176-188.
[3]ZANNINI L, DELIA D, BUSCEMI G. CHK2 kinase in the DNA damage response and beyond[J]. Journal of Molecular Cell Biology, 2014,6(6):442-457.
[4]罗媚,肖玲,马安迪,等. CHK2在肿瘤中作用的研究进展[J]. 现代生物医学进展, 2018,18(6):1193-1196.
[5]谭亚丽,夏红,曾颖,等. 沉默Chk2基因对DADS阻滞人胃癌BGC823细胞G2/M期的影响[J]. 中南医学科学杂志, 2018,46(6):603-607.
[6]牛朝霞,陈洁,王黎,等. 细胞周期检测点激酶1/2在相关肿瘤诊断治疗中的研究进展[J]. 河南大学学报(医学版), 2018,37(1):73-76.
[7]OU T T, WU C H, HSU J D, et al. Paeonia lactiflora Pall inhibits bladder cancer growth involving phosphorylation of Chk2 in vitro and in vivo[J]. J Ethnopharmacol, 2011,135(1):162-172.
[9]AMIR S, MABJEESH N J. microRNA expression profiles as decision-making biomarkers in the management of bladder cancer[J]. Histol Histopathol, 2017,32(2):107-119.
[10]谭益帆,刘修恒,王磊,等. BRD4抑制剂JQ1对膀胱癌细胞增殖与凋亡的作用及其机制研究[J]. 现代泌尿外科杂志, 2018,23(4):293-298.
[11]HAMEED D A, YASSA H A, AGBAN M N, et al. Genetic aberrations of the K-ras proto-oncogene in bladder cancer in relation to pesticide exposure[J]. Environ Sci Pollut Res Int, 2018,25(22):21535-21542.
[12]XU Xilong, XIONG Xiufang, SUN Yi. The role of ribosomal proteins in the regulation of cell proliferation, tumorigenesis, and genomic integrity[J]. Science China (Life Sciences), 2016,59(7):656-672.
[13]WU P, LIU S, SU J, et al. Apoptosis triggered by isoquercitrin in bladder cancer cells by activating the AMPK-activated protein kinase pathway[J]. Food Funct, 2017,8(10):3707-3722.
[14]秦晓平,詹雄宇,陈奇彪,等. 小檗碱增强丝裂霉素C诱导的膀胱癌T24细胞周期阻滞及凋亡[J]. 中国病理生理杂志, 2018,34(6):1025-1030.
[15]ZAHMATKESH M H, HOSSEINIMEHR S J, MAHDIUNI H. Role of CHK2 inhibitors in the cellular responses to ionizing radiation[J]. Mini Reviews in Medicinal Chemistry, 2014,14(10):812-818.
[16]梁晓奔,林柏键,郎军添. ATM-CHK2信号通路调控头颈鳞状细胞癌研究进展[J]. 国际耳鼻咽喉头颈外科杂志, 2018,42(3):136-139.
[17]HAYAKAWA K, HIRATA H, SAMSONOV M, et al. Planar compression of extracellular substrates induces S phase arrest via ATM-independent CHK2 activation[J]. Biochem Biophys Res Commun, 2018,506(4):983-989.
[18]MATT S, HOFMANN T G. The DNA damage-induced cell death response: a roadmap to kill cancer cells[J]. Cellular and Molecular Life Sciences: CMLS, 2016,73(15):2829-2850.
[19]常方圓,杜晓玲,戴弘季,等. 恶性外周神经鞘膜瘤中TBX2基因突变及相关蛋白表达的临床意义[J]. 中国肿瘤临床, 2017,44(1):29-35.
[20]RONCO C, MARTIN A R, DEMANGE L, et al. ATM, ATR, CHK1, CHK2 and WEE1 inhibitors in cancer and can-
cer stem cells[J]. Medchemcomm, 2016,8(2):295-319.
[21]黄波,谈顺. ATM、Chk2、p53和Rad51的表达与乳腺癌的相关性研究进展[J]. 海南医学, 2015,26(21):3187-3190.
[22]YUAN Zhu, GUO Wenhao, YANG Jun, et al. PNAS-4, an early DNA damage response gene, induces S phase arrest and apoptosis by activating checkpoint kinases in lung cancer cells[J]. The Journal of Biological Chemistry, 2015,290(24):14927-14944.
[23]ERTYCH N, STOLZ A, STENZINGER A, et al. Increased microtubule assembly rates influence chromosomal instability in colorectal cancer cells[J]. Nature Cell Biology, 2014,16(8):779-791.
[24]CARDOSO P C D S, ROCHA C A M D, LEAL M F, et al. Effect of diterpenoid kaurenoic acid on genotoxicity and cell cycle progression in gastric cancer cell lines[J]. Biomed Pharmacother, 2017,89(3):772-780.
[25]LI Baozhong, CHEN Zhaoli, SHI Susheng, et al. Overexpression of Cdc25C predicts response to radiotherapy and survival in esophageal squamous cell carcinoma patients treated with radiotherapy followed by surgery[J]. Chinese Journal of Can-cer, 2013,32(7):403-409.
[26]NIKOLAISHVILLI-FEINBERG N, COHEN S M, MIDKIFF B, et al. Development of DNA damage response signaling biomarkers using automated, quantitative image analysis[J]. The Journal of Histochemistry and Cytochemistry, 2014,62(3):185-196.
[27]CHOO D W, GOH S H, CHO Y W, et al. CHK2 is involved in the p53-independent radiosensitizing effects of valproic acid[J]. Oncology Letters, 2017,13(4):2591-2598.
[28]LUO Q, GUO H, KUANG P, et al. Sodium fluoride arrests renal G2/M phase cell-cycle progression by activating ATM-Chk2-P53/Cdc25C signaling pathway in mice[J]. Cell Physiol Biochem, 2018,51(5):2421-2433.
(本文编辑 牛兆山 于国艺)
