IL-4及IL-13基因多态性与EV71型手足口病关系
2019-09-10杨莉邱世彦孙绍霞韩玉增张丕强李玉芬
杨莉 邱世彦 孙绍霞 韩玉增 张丕强 李玉芬
[摘要]目的 探讨白细胞介素(IL)-4-590 C/T位点、IL-13-1112 C/T位点基因多态性与肠道病毒71(EV71)型手足口病的关系。方法 收集174例EV71型手足口病作为EV71感染组,根据病情程度分为普通组、重症组。健康儿童作为正常对照组。采用多重SNP分型技术检测各组IL-4-590 C/T位点、IL-13-1112 C/T位点的单核苷酸多态性。结果 感染组IL-4-590 C/T位点TT基因型分布频率及T等位基因分布频率均高于对照组,差异有显著意义(χ2=71.48、88.40,P<0.05),感染组IL-13-1112 C/T位点CC基因型分布频率及C等位基因分布频率均高于对照组,差异有显著意义(χ2=98.58、89.75,P<0.05)。重癥组IL-13-1112 C/T位点CC基因型分布频率高于普通组,差异有显著意义(χ2=9.70,P<0.05)。结论 携带IL-4-590 位点T等位基因及IL-13-1112位点C等位基因可能与 EV71 感染易感性有关,IL-13-1112 C位点可能与重症感染有关。
[关键词]手足口病;肠道病毒A型,人;白细胞介素4;白细胞介素13;多态性,单核苷酸
[中图分类号]R512.5;R394.25
[文献标志码]A
[文章编号] 2096-5532(2019)05-0531-05
doi:10.11712/jms201905007
[开放科学(资源服务)标识码(OSID)]
肠道病毒71(EV71)是一种单链RNA病毒,可导致婴幼儿手足口病(HFMD)及其神经系统并发症,发病率和死亡率均较高。但是,EV71感染的发病机制还不清楚。人对EV71普遍易感,但不同病人感染后会出现不同的症状,这可能与遗传因素参与调控细胞因子的表达或对细胞因子的反应性而调控机体的免疫状态有关。但目前HFMD的易感因素、发病机制及免疫特点等尚不明了,尤其是EV71致重症感染的机制、遗传易感因素目前报道较少。有证据表明,炎症细胞因子可能在EV71感染中起重要的作用。近年研究发现,促炎性细胞因子白细胞介素(IL)-4-590 C/T位点[1-2]、IL-13-1112 C/T位点[3-4]单核苷酸多态性(SNP)与某些感染性疾病的发生发展及病理进程相关。目前,国内外尚未发现二者在EV71型HFMD病儿等方面的研究。本研究通过对EV71型HFMD病儿IL-4-590 C/T位点、IL-13-1112 C/T位点基因多态性研究,探讨其在EV71致病过程中可能的作用机制。
1 资料与方法
1.1 研究对象
2017年1月—2018年1月,收集我院儿科诊断为EV71型HFMD病例(感染组)174例,其中男116例,女58例,年龄4个月~6岁,平均(1.92±1.38)岁。诊断标准均符合中华人民共和国卫生部制定的《手足口病诊疗指南(2018年版)》[5]。根据指南将感染组分为普通组和重症组:普通组104例,男68例,女36例,年龄4个月~6岁,平均(1.87±1.36)岁;重症组70例,男48例,女22例,年龄8个月~6岁,平均(1.97±1.41)岁。纳入标准:①持续高热,体温大于39 ℃,常规退热治疗效果不佳;②出现精神萎靡、头痛、眼球震颤或上翻、呕吐、易惊、肢体抖动、吸吮无力、站立或坐立不稳等神经系统表现;③呼吸增快、减慢或节律不整,安静状态下呼吸频率超过30 min-1;④心率增快(>160 min-1)、出冷汗、四肢末梢发凉、皮肤发花、血压升高、毛细血管再充盈时间延长(>2 s);⑤外周血白细胞计数≥15×109/L,除外其他感染因素;⑥出现应激性高糖血症,血糖>8.3 mmol/L;⑦出现循环功能障碍时,血乳酸升高(≥2.0 mmol/L)[5]。排外标准:①患有其他肺部疾病者;②其他原因引起的中枢神经系统感染者;③检查不依从者。对照组为同期在本院儿童保健门诊体检且近期无感染症状的正常儿童66例,其中男34例,女32例,年龄7个月~4岁,平均(1.95±1.28)岁。本研究获得医院伦理委员会批准及受试者家属知情同意。
1.2 实验方法
收集3组受试者静脉血2 mL(入院24 h内),采用EDTA抗凝,-80 ℃储存。提取外周血DNA,采用NanoDrop 2000进行基因组质控,基因组浓度为50~100 mg/L,OD(260/280)值为1.8~2.0,每个反应需要DNA的量为50 ng。采用多重SNP分型技术检测EV71型HFMD感染病儿及正常对照儿童IL-4-590 C/T位点、IL-13-1112 C/T位点的SNP。针对检测的单基因设计引物,所用软件为:Primer Z。所用引物序列如下。IL4-590F:GCCA-AGGGCTTCCTTATGGG;IL4-590R:GGCCACA-GGTGTCCGAATTT;IL13-1112F:CACACCCTTGTGAGGAGGTT;IL13-1112R:CCCACTGTGAGAGGGATTGT。稀释引物,然后根据引物条件进行PCR扩增,使用的仪器为ABI PCR扩增仪。
1.3 统计学分析
应用SPSS 16.0统计软件包进行数据分析,计量资料正态分布的以[AKx-D]±s表示,组间比较使用独立样本均数的t检验;偏态分布的以中位数(四分位数间距)(M(P25,P75))表示,组间比较使用独立样本非参数检验的Mann-Whitney U法;计数资料以率(%)表示,组间比较采用卡方检验。应用Hardy-Weinberg遗传平衡定律检测样本是否达到遗传平衡。以P<0.05为差异有统计学意义。
2 结果
2.1 Hardy-Weinberg平衡定律检测
基于遗传平衡定律,对EV71感染组和正常对照组IL-4-590 C/T、IL-13-1112 C/T位点各基因频率分别进行检验,所得P值均>0.05,本研究符合遗传平衡定律。
2.2 各组IL-4-590 C/T位点基因多态性分布比较
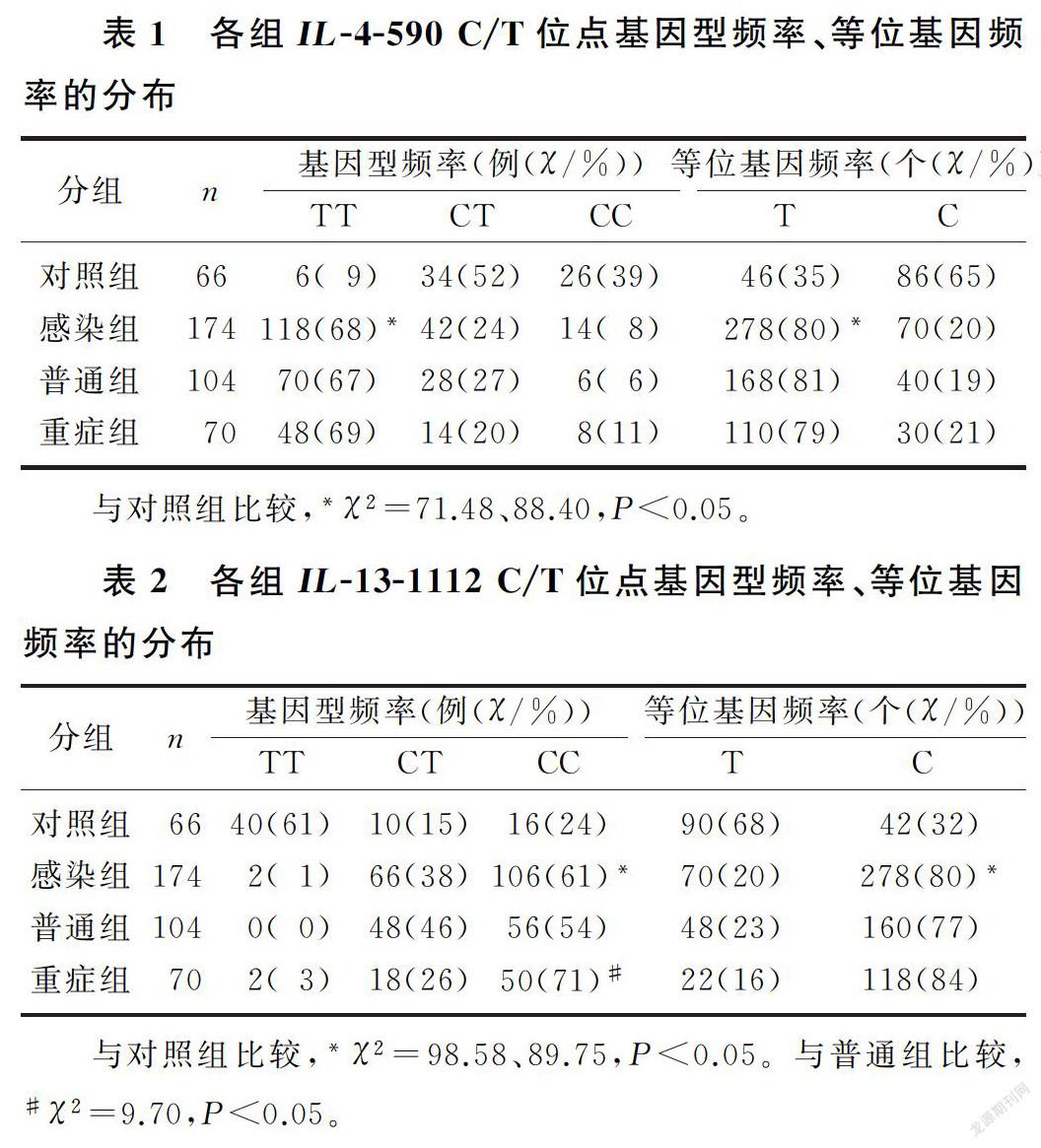
感染组IL-4-590 C/T位点TT基因型分布频率、T等位基因分布频率均高于对照组,差异有显著意义(χ2=71.48、88.40,P<0.05)。该位点T、C等位基因分布频率在EV71型HFMD普通组与重症组间差异无显著统计学意义(χ2=2.56、0.14,P>0.05),见表1。
2.3 各组IL-13-1112 C/T位点基因多态性分布
感染组IL-13-1112 C/T位点CC基因型分布频率及C等位基因分布频率均高于对照组,差异有显著意义(χ2=98.58、89.75,P<0.05)。重症组病人IL-13-1112 C/T位点CC基因型分布频率高于普通组病人,差异有显著意义(χ2=9.70,P<0.05),C等位基因分布频率在EV71型HFMD普通组与重症组的分布差异无显著统计学意义(χ2=2.82,P>0.05)。见表2。
3 讨论
HFMD是以手掌、脚掌及口腔黏膜上发生水疱为特征的一种病毒性皮肤病,其病原体以EV71最为常见。由于EV71具有嗜神经性,感染病人易出现神经系统损害,并进一步进展为危重病人而导致死亡。然而,关于EV71型HFMD的发病机制目前尚不明了。近年来多种细胞因子与HFMD发病机制的关系成为研究的热点。细胞因子网络的失衡可能参与了EV71型HFMD的发病机制[6]。目前认为与EV71型HFMD有肯定意义的细胞因子有IL-1、IL-4、IL-6、IL-8、IL-10、IL-12、IL-13、IL-18、成纤维细胞刺激脂肽-1(FSL-1)、肿瘤坏死因子-α(TNF-α)等[7-16]。已有研究结果表明,在小鼠EV71病毒感染模型IL-5、IL-13、IL-6等水平显著上升[17],在感染的早期阶段,这些因素可能预示着严重的后果。HUANG等[18]发现,IL-35的调节与Treg/Th17平衡有关,在EV71相关HFMD的发病机制中可能起着至关重要的作用。SHANG等[19]研究显示,轻症HFMD病人IL-4、IL-12和IL-18水平升高,在重症HFMD病人中,脑炎合并肺水肿者IL-12水平高于单纯脑炎病人。这些研究结果表明,全身性炎症反应可能在HFMD的发病机制中起重要作用。
人对EV71普遍易感,但不同病人感染后会出现不同的症状,这可能与遗传因素参与调控细胞因子的表达有关。在众多遗传因素中,宿主基因的SNP是个体间遗传差异的本质因素之一。EV71 易感相关基因多态性研究及其与疾病病程发展相互间的联合分析,是今后针对 EV71感染精准医疗的研究重点。 ZHAO等[20]研究表明,重症EV71感染病人血IL-10水平及IL-10-592 C等位基因频率显著高于中度病例、轻度病例和健康儿童,并认为IL-10-592 C等位基因与中国人EV71感染的严重程度相关。LI等[21]发现,IL-17F rs1889570基因多态性与中国汉族儿童严重EV71感染的易感性顯著相关。本研究对与EV71型HFMD的发病过程有密切关系且目前报道较少的炎性细胞因子IL-13及IL-4进行了探讨。IL-4定位于染色体 5q31,其蛋白作为 Th2 细胞分泌的主要细胞因子介导机体体液免疫反应。EV71 感染病人体内IL-4 含量增高,且随着疾病的进展持续增加[22]。IL-4序列分析显示该基因存在多态性位点,特别是 IL-4 基因启动子区,如IL-4-590 C/T 基因多态性位点。该位点与 IL-4 产生、活性及功能关系密切。研究发现,EV71感染HFMD病人IL-4-590对晚发性阿尔茨海默病有保护作用[2],并与鳞状细胞肺癌、牙周炎、儿童特应性皮炎、类风湿性关节炎、副球孢子菌病、疟疾易感等有关[23-26]。IL-13是一种Th2起源的抗炎性细胞因子,其生物学作用包括诱导巨噬细胞树突样变、抑制单核细胞释放炎性细胞因子。研究发现,EV71感染HFMD病人IL-13水平显著高于非EV71感染HFMD病人和健康人[27-29]。而IL-13-1112基因多态性与多种疾病的关系已有较多报道,其对皮肤T细胞淋巴瘤有保护作用[4],与牙周炎、慢性阻塞性肺疾病及炎症性肠病(IBD)和结直肠癌易感性有关[3,30-31]。关于IL-4-590和IL-13-1112基因多态性的联合研究结果显示,杂合基因型(IL-4-590CT和IL-13-1112CT)可作为2型糖尿病发病的危险因素,而纯合野生型(-590CC和-1112CC)可作为2型糖尿病的保护因素[32]。但二者在EV71型HFMD中鲜有报道。
本研究分析了在HFMD病情发展中起作用的IL-4及IL-13基因多态性与EV71感染及严重程度的关系,发现EV71 感染组IL-4-590 C/T位点TT、CT分布频率明显高于对照组,T等位基因分布频率明显高于正常对照组,提示人群中该位点变异等位基因T为主要的携带基因且携带者更容易罹患EV71型HFMD,其可能与 EV71 感染易感性有关。EV71 感染组IL-13-1112 C/T位点基因CT及CC基因型分布频率明显高于对照组,重症组IL-13-1112 C/T位点CC基因型分布频率高于普通组,差异有显著性,提示人群中该位点变异等位基因C为主要携带基因且携带者更容易罹患重型EV71型HFMD。IL-4-590和IL-13-1112基因多态性的联合研究为进一步明确 HFMD发病机制提供了线索,也为临床筛选重症病儿提供了新的依据。
综上所述,IL-4-590 位点T等位基因及IL-13-1112位点C等位基因频率明显高于正常对照组,提示其可能与 EV71 感染易感性有关,而IL-13-1112位点C等位基因的携带可能对重症EV71感染易感。本研究为临床EV71感染的早期诊断及治疗开辟新的途径。临床上遇到HFMD病儿,可早期筛查IL-13-1112 C位点,结合临床症状,早期筛查出重症病儿,以期达到早期治疗,改善预后。但同时本研究也存在一定的局限性,如目前对IL-4-590 C/T位点、IL-13-1112 C/T位点基因多态性在EV71型HFMD病儿中的发病机制,及它们之间是否相互影响的认识还不够全面,需扩大样本量进行深入验证,从而为揭示宿主基因多态性在疾病发生、发展中的重要作用提供依据,指导临床治疗。
[參考文献]
[1]ZHANG Mingzhi, LU Yong, ZHANG Xiaobo, et al. Interleukin-4 polymorphism is associated with severity of respiratory syncytial virus infection[J]. Journal of Paediatrics and Child Health, 2016,52(1):25-29.
[2]SOOSANABADI M, BAYAT H, KAMALI K, et al. Asso-ciation study of IL-4-590 C/T and DDX39B-22 G/C polymorphisms with the risk of late-onset Alzheimer’s disease in ira-nian population[J]. Current Aging Science, 2015,8(3):276-281.
[3]CHEN Lei, SHEN Yongchun, LIU Lian, et al. Interleukin-13-1112 C/T promoter polymorphism confers risk for COPD: a Meta-analysis[J]. PLoS One, 2013,8(7):e68222.
[4]NEDOSZYTKO B, OLSZEWSKA B, ROSZKIEWICZ J, et al. The role of polymorphism of interleukin-2,-10,-13 and TNF-α genes in cutaneous T-cell lymphoma pathogenesis[J]. Postepy Dermatologii Alergologii, 2016,33(6):429-434.
[5]《手足口病诊疗指南(2018版)》编写专家委员会. 手足口病诊疗指南(2018年版)[J]. 中华传染病杂志, 2018,36(5):257-263.
[6]ZHANG Shuyan, XU Meiyan, XU Hongmei, et al. Immunologic characterization of cytokine responses to enterovirus 71 and coxsackievirus a16 infection in children[J]. Medicine, 2015,94(27):e1137.
[7]FU Yuxuan, ZHANG Li, ZHANG Fang, et al. Exosome-mediated miR-146a transfer suppresses type Ⅰ interferon response and facilitates EV71 infection[J]. PLoS Pathogens, 2017,13(9):e1006611.
[8]WANG Wenbiao, XIAO Feng, WAN Pin, et al. EV71 3D protein binds with NLRP3 and enhances the assembly of inflammasome complex[J]. PLoS Pathogens, 2017,13(1):e1006123.
[9]CHANG Zhangmei, WANG Yan, BIAN Liang, et al. Enterovirus 71 antagonizes the antiviral activity of host STAT3 and IL-6R with partial dependence on virus-induced miR-124[J]. Journal of General Virology, 2017,98(12):3008-3025.
[10]LI Zheng, WANG Hongbin, CHEN Yihui, et al.Interleukin-18 protects mice from Enterovirus 71 infection[J]. Cytokine, 2017,96:132-137.
[11]LIN Y L, CHENG P Y, CHIN C L, et al. Fibroblast-stimulating lipopeptide-1 as a potential mucosal adjuvant enhances mucosal and systemic immune responses to enterovirus 71 vaccine[J]. Vaccine, 2018,36(29):4331-4338.
[12]JIN Yuefei, ZHANG Chao, WANG Hui, et al. Mast cells contribute to Enterovirus 71 infection-induced pulmonary edema in neonatal mice[J]. Laboratory Investigation, 2018,98(8):1039-1051.
[13]CAO Li, ZHANG Xinyan,YUAN Sumei, et al. Autophagy induced by enterovirus 71 regulates the production of IL-6 through the p38MAPK and ERK signaling pathways[J]. Microbial pathogenesis, 2019,131:120-127.
[14]ZHANG Yuhong, SUO Xiaoying, ZHANG Yufang. Association of IL-13, S100B, and TLR-7 gene polymorphisms with enterovirus 71 infection in hand, foot, and mouth disease in China[J]. Genetic testing and molecular biomarkers, 2019,23(3):188-196.
[15]SHAO Ping, WU Xiaoxin, LI Hongbo, et al. Clinical significance of inflammatory cytokine and chemokine expression in hand, foot and mouth disease[J]. Molecular Medicine Reports, 2017,15(5):2859-2866.
[16]LEE J Y, SON M, KANG J H, et al. Serum interleukin-6 le-vels as an indicator of aseptic meningitis among children with enterovirus 71-induced hand, foot and mouth disease[J]. Postgraduate Medicine, 2018,130(2):258-263.
[17]YU Pin, BAO Linlin, XU Lili, et al. Neurotropism in vitro and mouse models of severe and mild infection with clinical strains of enterovirus 71[J]. Viruses, 2017,9(11):e351.
[18]HUANG Qian, WANG Yanhua, SI Changyun, et al. Interleukin-35 modulates the imbalance between regulatory T cells and T helper 17 cells in enterovirus 71-induced hand,foot,and mouth disease[J]. J Interferon Cytokine Res, 2017,37(12):522-530.
[19]SHANG Wenzhong, QIAN Suying, FANG Lijuan, et al. Association study of inflammatory cytokine and chemokine expression in hand foot and mouth disease[J]. Oncotarget, 2017,8(45):79425-79432.
[20]ZHAO Na, CHEN Huilan, CHEN Zhenzhen, et al. IL-10-592 polymorphism is associated with IL-10 expression and severity of enterovirus 71 infection in Chinese children[J]. Journal of Clinical Virology, 2017,95:42-46.
[21]LI Fei, LIU Peipei, GUO Ya, et al. Association of Interleukin-17F gene polymorphisms with susceptibility to severe enterovirus 71 infection in Chinese children[J]. Archives of viro-logy, 2018,163(7):1933-1939.
[22]LI Fei, LIU Xiangping, LI Jian, et al. Correlation of an interleukin-4 gene polymorphism with susceptibility to severe enterovirus 71 infection in Chinese children[J]. Archives of Virology, 2015,160(4):1035-1042.
[23]GU Jianzhong, SHEN Yingying, ZHANG Yongjun. Association between interleukin-4 polymorphisms and environment and nonsmall cell lung cancer in Chinese population[J]. Journal of Cancer Research and Therapeutics, 2014,10(Suppl): C135-C139.
[24]YAN Yan, WENG Hong, SHEN Zhenghai, et al. Association between interleukin-4 gene-590 c/t,-33 c/t, and 70-base-pair polymorphisms and periodontitis susceptibility: a meta-analy-sis[J]. Journal of Periodontology, 2014,85(11):e354-e362.
[25]HUSSEIN Y M, SHALABY S M, NASSAR A A, et al. Association between genes encoding components of the IL-4/IL-4 receptor pathway and dermatitis in children[J]. Gene, 2014,545(2):276-281.
[26]LI Xiang, CHAI Wei, NI Ming, et al. The effects of gene po-lymorphisms in interleukin-4 and interleukin-6 on the susceptibility of rheumatoid arthritis in a Chinese population[J]. BioMed Research International, 2014(350):265435.
[27]VAFA M, ISRAELSSON E, BAKARY M, et al. Impact of the IL-4-590 C/T transition on the levels of plasmodium falciparum specific IgE, IgG, IgG subclasses and total IgE in two sympatric ethnic groups living in Mali[J]. Scandinavian Journal of Immunology, 2008,68(2):254-255.
[28]CHEN Zhifeng, LI Ruiqin, XIE Zhichao, et al. IL-6,IL-10 and IL-13 are associated with pathogenesis in children with Enterovirus 71 infection[J]. International Journal of Cli-nical and Experimental Medicine, 2014,7(9):2718-2723.
[29]TSOU Y L, LIN Y W, SHAO H Y, et al. Recombinant adeno-vaccine expressing enterovirus 71-like particles against hand, foot, and mouth disease[J]. PLoS Neglected Tropical Diseases, 2015,9(4):e0003692.
[30]ZHANG Wenbo, XU Pu, CHEN Zhuogeng, et al. IL-13-1112 polymorphism and periodontitis susceptibility: a meta-analysis[J]. BMC Oral Health, 2018,18(1):21-29.
[31]WALCZAK A, PRZYBYLOWSKA K, DZIKI L, et al. The IL-8 and IL-13 gene polymorphisms in inflammatory bowel disease and colorectal cancer[J]. DNA and Cell Biology, 2012,31(8):1431-1438.
[32]ALSAID A, EL-MISSIRY M, HATATA E S, et al. Association of IL-4-590 C>T and IL-13-1112 C>T gene polymorphisms with the susceptibility to type 2 diabetes mellitus[J]. Disease Markers, 2013,35(4):243-247.
(本文編辑 于国艺)
