LOX基因多态性与亚洲人群恶性肿瘤易感性Meta分析
2019-09-10余觅何杰李小燕孙建王春茂
余觅 何杰 李小燕 孙建 王春茂



[摘要]目的 探討赖氨酰氧化酶(LOX)基因G473A多态性与亚洲人群恶性肿瘤易感性的关系。方法 通过计算机检索PubMed、CNKI、万方全文数据库等数据库,查找建库至2017年3月关于LOX基因与恶性肿瘤易感性关系的研究文献。筛选文献并提取数据进行分析。结果 LOX基因G473A多态性与亚洲人群恶性肿瘤易感性之间的相关性在各基因模型中均有统计学意义。假阳性报告率检验结果显示各基因模型的检验值均低于预先设定的临界值0.2,有统计学意义。结论 该Meta分析表明,LOX基因G473A多态性与亚洲人群恶性肿瘤发病风险之间可能存在相关性。
[关键词]蛋白赖氨酸6-氧化酶;肿瘤;多态性,单核苷酸;Meta分析
[中图分类号]R345.44;R394.25
[文献标志码]A
[文章编号] 2096-5532(2019)05-0523-05
doi:10.11712/jms201905005
[开放科学(资源服务)标识码(OSID)]
恶性肿瘤是全球亟待解决的公共卫生问题之一,并给病人家庭和社会造成沉重的经济和心理负担[1-2]。已有大量研究表明,赖氨酰氧化酶(LOX)异常表达与肿瘤细胞的发生发展、分化、黏附等密切相关[3-6]。其中LOX基因G473A位点是目前研究的热点之一[7]。YOON等[8]研究发现,LOX基因G473A位点的多态性与胃癌、乳癌的分化和进展明显相关。但由于单个研究的样本量偏小,所得结论尚有争议。为了确定LOX基因G473A是否与恶性肿瘤相关,本文采用Meta分析的方法首次对LOX基因G473A位点多态性与亚洲人群恶性肿瘤易感性的关联进行研究。
1 资料与方法
1.1 文献检索
采用计算机检索,检索范围为PubMed、万方全文数据库、CNKI、CBM、web of science、中国科技期刊数据库等数据库,检索时限为建库至2017年3月,检索内容为LOX基因G473A多态性与恶性肿瘤易感性的相关文献。英文检索词:lysyl oxidase、LOX、polymorphism、cancer;中文检索词: LOX基因、多态性、肿瘤。文献语言限定为中文、英文。
1.2 纳入与排除标准
1.2.1 纳入标准 ①研究设计为病例-对照研究;②研究内容包含LOX基因G473A位点与肿瘤发病风险的关系;③含有可供提取的基因型分布频率及数据。
1.2.2 排除标准 ①重复报道的文献;②中、英文以外的文献;③综述、会议摘要等;④研究内容不包含LOX基因G473A位点。
1.3 文献质量评价及资料提取
在资料提取的内容和文献质量评价标准上达成共识后,由两位评价者各自独立地对纳入的每篇文献进行质量评价和资料提取,并进行交叉核对,如遇不一致则立即讨论协商解决。纳入文献的质量参考强化遗传关联性研究报道质量声明(STREGA)原则[9]进行评价。每篇文献提取的内容包括:发表时间、第一作者、癌症类型、国家、种族、基因型检测方法以及G473A位点各基因型分布情况等。
1.4 统计学分析
1.4.1 异质性检验和森林图绘制 使用Revman 5.3软件。选择优势比(OR)值作为评价危险因素的指标。选择I2对所纳入的研究进行异质性定量分析。当异质性检验的P值(Phet)>0.05,I2<50%时选用固定效应模型进行分析;反之,则采用随机效应模型进行分析。
1.4.2 发表偏倚的评估和敏感性分析 使用Revman 5.3和STATA 11.0软件。通过剔除各单个研究后总体效应的变化判断结果的稳定性和可靠性。通过漏斗图、Egger’s检验评估发表偏倚。
1.4.3 假阳性概率检验(FPRP) ①预设FPRP的临界值为0.2;②确定HA(备择假设)先验概率;③建议将OR值设为1.5;④用Power and Sample软件计算FPRP值。如果FPRP<0.2,说明结果的假阳性率低于预期值,可以认为LOX基因多态性与恶性肿瘤易感性之间的关联是有意义的。
2 结果
2.1 文献检索
根据检索词检索到中英文文献共72篇,剔除重复和不相关文献51篇,剩余21篇经全文仔细阅读后最终纳入10篇。其中英文文献8篇,中文文献2篇。纳入研究主要是来自中国的研究,有1篇来自韩国。共纳入肿瘤病人3 275例,健康对照3 964例。文献筛选流程如图1所示。纳入Meta分析各研究的基本特征和基因频率分布情况见表1。
2.2 Meta分析
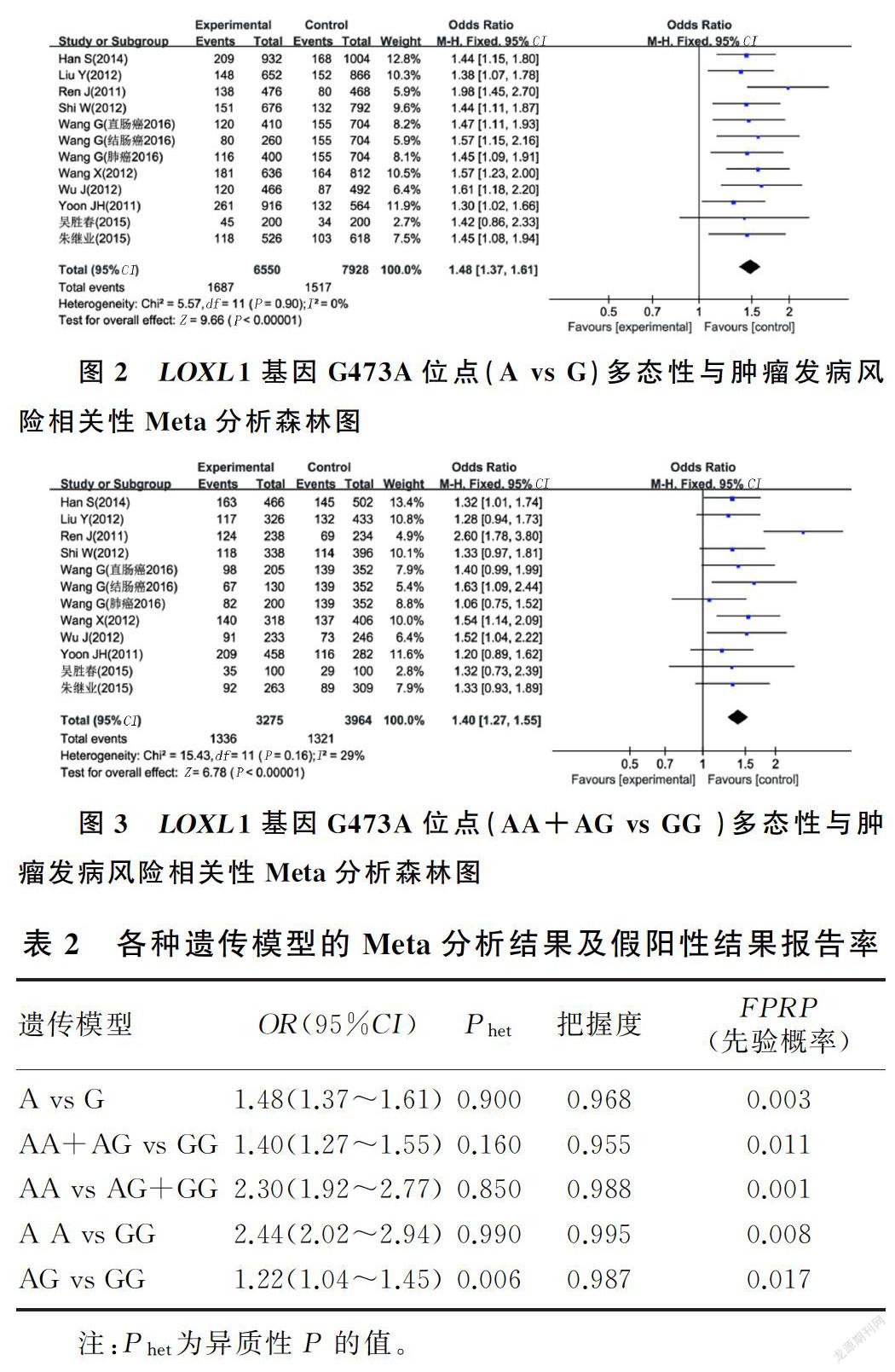
2.2.1 等位基因模型 采用固定效应模型进行Meta分析,结果显示,与等位基因G相比较,等位基因A可能增加亚洲人群恶性肿瘤的发病风险(A vs G, Phet=0.900,I2=0,OR=1.48, 95%CI=1.37~1.61,P<0.001)。见图2和表2。
2.2.2 显性基因模型 采用固定效应模型分析,结果显示,与GG基因型相比,基因型AG+AA可能增加亚洲人群恶性肿瘤的发病风险(AA+AG vs
GG,Phet=0.160,I2=29%,OR=1.40, 95%CI=1.27~1.55,P<0.001)。见图3和表2。
2.2.3 隐性基因模型 采用固定效应模型分析,发现基因型AA可能增加亚洲人群恶性肿瘤的发病率(AA vs AG+GG,Phet=0.850,I2=0,OR=2.30, 95%CI=1.92~2.77,P<0.001)。见表2。
2.2.4 纯合子模型 采用固定效应模型分析,发现基因型AA的亚洲人群相对于基因型GG的亚洲人群与恶性肿瘤的发病风险具有一定的统计学相关性(AA vs GG,Phet=0.990,I2=0,OR=2.44, 95%CI=2.02~2.94,P<0.001)。见表2。
2.2.5 雜合子模型 采用随机效应模型分析,发现基因型AG的亚洲人群相对于基因型GG的亚洲人群恶性肿瘤的发病风险有一定的统计学相关性(AG vs GG,Phet=0.006,I2=58%,OR=1.22,95%CI=1.04~1.45,P<0.05)。见表2。
2.3 发表偏倚和影响性分析
本研究采取漏斗图法、Egger’s 检验进行发表偏倚的分析,结果显示研究分布对称,且集中在漏斗顶部。见图4。行Egger’s检验提示本研究不存在发表偏倚(t=0.42,P>0.05)。影响性分析结果也表明,纳入的各项研究均对分析结果无明显影响。见图5。
2.4 FPRP
本研究将Meta分析得出的阳性结果行进一步的FPRP。设定FPRP临界值为0.2,先验概率设置为中等(≈0.01),关联强度指标OR=1.5,结果表明LOX的5个基因型(AA+AG vs GG, AA vs AG+GG,AA vs GG, AG vs GG, A vs G)FPRP值均低于预先设定的临界值0.2。见表2。可以判断LOX多态性与恶性肿瘤易感性可能存在真实关联,值得进一步深入的研究。
3 讨论
LOX是一种由多功能基质成纤维细胞所分泌的铜依赖性酶,它可以通过氧化多肽中赖氨酸残基引起胶原蛋白、弹性蛋白及组蛋白发生共价交联,进而形成难溶解的纤维或者纤维聚合物,以稳定细胞外基质和细胞核[19-22]。因此,LOX在维持组织形态及修复过程中起到重要作用。在许多肿瘤细胞系中,LOX的mRNA表达水平较低[23],表明LOX可能是一种肿瘤抑制因子,发挥调节癌基因的表达、稳定核结构蛋白的作用,从而维持染色体及细胞核的稳定性[24-27]。
本文Meta分析首次探讨了LOX基因G473A多态性与恶性肿瘤易感性之间的关联性,共纳入10篇文献,各项研究的对照组均符合Hardy-Weinberg平衡定律,并按照前述质量评价标准对纳入研究进行评价,纳入研究质量均较高。本文各个研究间存在一定的异质性,进行Meta回归分析检验异质性,提示异质性原因可能有以下几个方面。①肿瘤的易感性受多个基因影响,且各基因的作用大小各不相同,没有综合考虑各基因间相互协同作用。②样本的异质性:各个地域人种血统的差异;研究所选取的肿瘤的诊断标准不同;样本中病人疾病的严重程度不同或者疾病的种类不同;各个研究的病例组和对照组病人生存环境不同。③纳入研究样本纯化遗传背景后数量有所不足,应该进一步纯化,扩大样本量,以提高检验效能。
本研究显示,在总体人群合并分析中,LOX基因G473A多态性与恶性肿瘤之间的相关性在各个基因模型均具有统计学意义,且FPRP值均低于预先设定的临界值。上述结果表明,在亚洲人群中LOX基因G473A多态性与恶性肿瘤发病风险可能有一定相关性,尤其在显性遗传模式中,GG基因型人群恶性肿瘤的发病率明显低于AG+AA基因型人群,说明LOX基因的突变型等位基因A可能增加罹患恶性肿瘤的风险。推测原因:G473A多态性位于LOX基因前多肽序列,它是LOX基因的一个重要且高发的单核苷酸多态性位点,等位基因G突变为A导致158位的精氨酸置换为谷氨酰胺,这一突变可能影响了LOX前多肽的抗癌机制,从而引起肿瘤的发病风险增加[28-31]。此外,本研究纳入的文献均只涉及亚洲人群,表明LOX基因的频率可能在亚洲人群中分布较高。
本研究仍然存在着一些不足。首先,纳入文献较少,未搜索到关于高加索人、拉美人、非洲人LOX基因与恶性肿瘤关系的相关文献,可能会降低LOX基因G473A多态性与恶性肿瘤易感性关系的证据级别。其次,本研究的结果存在一定的异质性,将不同类型的肿瘤进行合并分析是导致异质性的原因之一。但因对疾病种类不同进行亚组分析时,每个亚组只有1~2个研究,其结果不具有临床意义,故未根据肿瘤的类型不同进行亚组分析,故结论有待进一步研究。
综上所述,现有的研究表明LOX基因G473A多态性可能与恶性肿瘤发病风险具有一定的相关性,尤其是在亚洲人群。鉴于LOX基因作用机制的复杂性,以及纳入的研究数量较少,该结论有待于更进一步论证,期待继续开展多中心、大样本、高质量的病例对照研究;并同时深入探讨基因-基因及基因和环境交互作用对恶性肿瘤发病风险的影响,为基础研究和临床的治疗提供更加可靠完善的证据。
[参考文献]
[1]SMITH R A, ANDREWS K, BROOKS D, et al. Cancer screening in the United States, 2016: a review of current American cancer society guidelines and current issues in cancer screening[J]. CA-A Cancer Journal for Clinicians, 2016,66(2):96-114.
[2]SIEGEL R, MA J M, ZOU Z H, et al. Cancer statistics, 2014[J]. CA-A Cancer Journal for Clinicians, 2014,64(1):9-29.
[3]CHANG W C, MUO C H, LIANG J A, et al. Gynecological malignancy risk in colorectal cancer survivors: a population-based cohort study[J]. European Journal of Oncology Nur-sing, 2015,19(5):473-478.
[4]LEE Y S, PARK Y, KWON M, et al. Expression of lysyl oxidase predictive of distant metastasis of laryngeal cancer[J].
Otolaryngology-head and Neck Surgery, 2017,156(3):489-497.
[5]NISHIOKA T, EUSTACE A, WEST C. Lysyl oxidase: from basic science to future cancer treatment[J]. Cell Structure and Function, 2012,37(1):75-80.
[6]PERRYMAN L, ERLER J T. Lysyl oxidase in cancer research[J]. Future Oncology (London, England), 2014,10(9):1709-1717.
[7]COX T R, GARTLAND A, ERLER J T. Lysyl oxidase, a targetable secreted molecule involved in cancer metastasis[J]. Cancer Research, 2016,76(2):188-192.
[8]YOON J H, PARK J K, KANG Y H, et al. Lysyl oxidase G473A polymorphism is closely associated with susceptibility to gastric cancer in a South Korean population[J]. APMIS: Acta Pathologica, Microbiologica, et Immunologica Scandinavica, 2011,119(11):762-768.
[9]LITTLE J, HIGGINS J P, IOANNIDIS J P, et al. Strengthening the reporting of genetic association studies (STREGA): an extension of the STROBE statement[J]. European Journal of Epidemiology, 2009,24(1):37-55.
[10]HAN S, FENG S Z, YUAN G, et al. Lysyl oxidase genetic variants and the prognosis of glioma[J]. APMIS: acta Pathologica, Microbiologica, et Immunologica Scandinavica, 2014,122(3):200-205.
[11]LIU Yang, LV Bitao, HE Zhimin, et al. Lysyl oxidase polymorphisms and susceptibility to osteosarcoma[J]. PLoS One, 2012,7(7): e41610.
[12]REN Jinghua, WU Xiaoling, HE Wenshan, et al. Lysyl oxidase 473 G>A polymorphism and breast cancer susceptibility in Chinese Han population[J]. DNA and Cell Biology, 2011,30(2):111-116.
[13]SHI Weiwei, YANG Bo, LI Xiaoyan, et al. The effect of lysyl oxidase polymorphism on susceptibility and prognosis of nonsmall cell lung cancer[J]. Tumour Biology, 2012,33(6):2379-2383.
[14]WANG Guoli, SHEN Yanqing, CHENG Guang, et al. Lysyl oxidase gene G473A polymorphism and cigarette smoking in association with a high risk of lung and colorectal cancers in a North Chinese population[J]. International Journal of Environmental Research and Public Health, 2016,13(7): E635.
[15]WANG X, CONG J L, QU L Y, et al. Association between lysyl oxidase G473A polymorphism and ovarian cancer in the Han Chinese population[J]. The Journal of International Me-dical Research, 2012,40(3):917-923.
[16]WU J, CAI C, TONG D, et al. Lysyl oxidase G473A polymorphism is associated with increased risk of ovarian cancer[J]. Genetic Testing and Molecular Biomarkers, 2012,16(8):915-919.
[17]吴胜春. LOXL2在胃癌中表达的临床意义及相关机制的研究[D]. 石家庄:河北医科大学, 2015.
[18]朱继业. 赖氨酰氧化酶在肝癌中的表达及其临床意义[D]. 南宁:广西医科大学, 2015.
[19]MOHAMMED M K, SHAO C, LUU H H, et al. Opening the LOX to bone metastasis: the role of secreted lysyl oxidase in skeletal recurrence of breast cancers[J]. Genes Dis, 2015,2 (4):288-290.
[20]ZHENG W, WANG X, CHEN Q, et al. Low extracellular lysyl oxidase expression is associated with poor prognosis in patients with prostate cancer[J]. Oncol Lett, 2016,12 (5):3161-3166.
[21]NILSSON M, HAGGLOF C, HAMMARSTEN P, et al. High lysyl oxidase (LOX) in the non-malignant prostate epithelium predicts a poor outcome in prostate cancer patient managed by watchful waiting[J]. PLoS One, 2015,10 (10): e0140985.
[22]ARMSTRONG M, VAN HOOREBEKE C, HORN T, et al. Human 15-LOX-1 active site mutations alter inhibitor binding and decrease potency[J]. Bioorg Med Chem, 2016,24 (21):5380-5387.
[23]BOUFRAQECH M, ZHANG L, NILUBOL N, et al. Lysyl oxidase (LOX) transcriptionally regulates SNAI2 expression and TIMP4 secretion in human cancers[J]. Clin Cancer Res, 2016,22 (17):4491-4504.
[24]LIU Jianlun, WEI Wei, TANG Wei, et al. Silencing of lysyl oxidase gene expression by RNA interference suppresses metastasis of breast cancer[J]. Asian Pacific Journal of Cancer Prevention: APJCP, 2012,13(7):3507-3511.
[25]GAO X, ZHAO G, LI C, et al. LOX-1 and TLR4 affect each other and regulate the generation of ROS in A. fumigatus keratitis[J]. Int Immunopharmacol, 2016,40:392-399.
[26]HE K, YUE L H, ZHAO G Q, et al. The role of LOX-1 on innate immunity against Aspergillus keratitis in mice[J]. Int J Ophthalmol, 2016,9 (9):1245-1250.
[27]CHEN Zhi, LI Yiyang, XU Hongmei, et al. Elevated ischaemia-associated lysyl oxidase activity in delayed graft failure 6-12 months after renal transplantation[J]. Experimental Phy-siology, 2017,102(2):282-287.
[28]ZHANG J, ZHANG L, HONG J, et al. Association of common variants in LOX with keratoconus: a meta-analysis[J]. PLoS One, 2015,10 (12): e0145815.
[29]KUMAR R, SINGH A K, KUMAR M, et al. Serum 5-LOX: a progressive protein marker for breast cancer and new approach for therapeutic target[J]. Carcinogenesis, 2016,37 (9):912-917.
[30]RANJBAR M M, ASSADOLAHI V, YAZDANI M, et al. Virtual dual inhibition of COX-2/5-LOX enzymes based on binding properties of alpha-amyrins, the anti-inflammatory compound as a promising anti-cancer drug[J]. Excli J, 2016,15:238-245.
[31]TIAN J J, LEI C X, JI H, et al. Dietary arachidonic acid has a time-dependent differential impact on adipogenesis modulated via COX and LOX pathways in grass carp ctenopharyngodon idellus[J]. Lipids, 2016,51 (12):1325-1338.
(本文編辑 牛兆山 于国艺)
