恩诺沙星对马氏珠母贝肠道微生物群落的影响
2019-09-10洪嘉炜陈明强邓正华李有宁马振华顾志峰王雨
洪嘉炜 陈明强 邓正华 李有宁 马振华 顾志峰 王雨



摘要:【目的】明確恩诺沙星对马氏珠母贝(Pinctada fucata martensii)肠道微生物群落的影响,了解其变化规律,为制定马氏珠母贝细菌感染的最佳治疗方案提供参考依据。【方法】采用16S rDNA测序定量评价不同恩诺沙星处理浓度(0、5和10 mg/L)下马氏珠母贝肠道微生物群落结构的变化情况,并运用生物信息学手段在门和属水平上比较分析各处理间马氏珠母贝肠道微生物群落结构的相似性和差异性。【结果】从9个马氏珠母贝肠道内容物样品(PA1、PA2、PA3、PB1、PB2、PB3、PC1、PC2和PC3)中共获得755159个有效序列,分别归属于9个门48个属。在门水平上,对照处理(PA,0 mg/L)马氏珠母贝肠道的优势菌门为变形菌门(Proteobacteria)、软壁菌门(Tenericutes)和厚壁菌门(Firmicutes),相对丰度分别为40.65%、33.87%和15.75%;两个恩诺沙星处理(PB,5 mg/L;PC,10 mg/L)的优势菌均为变形菌门,相对丰度分别为91.61%和85.00%。在属水平上,PA处理马氏珠母贝肠道的优势菌属为支原体属(Mycoplasma)、微小杆菌属(Exiguobacterium)、柠檬酸细菌属(Citrobacter)和埃希氏菌—志贺氏菌属(Escherichia-Shigella),相对丰度分别为26.33%、12.22%、10.62%和9.66%;PB处理的优势菌属为弧菌属(Vibrio),相对丰度为52.10%;PC处理的优势菌属为弧菌属和发光杆菌属(Photobacterium),相对丰度分别为40.24%和23.43%。操作分类单元(OTU)聚类分析结果表明,3个处理(PA、PB和PC)的共有OUTs为138个,占OTUs总数的54.76%;PB和PC处理的共有OUTs达176个,即这两个处理间具有更高的相似性。【结论】恩诺沙星处理浓度达5 mg/L时即对马氏珠母贝肠道微生物群落产生影响,并使其暴露于弧菌等致病菌的威胁下,因此在马氏珠母贝养殖生产中须谨慎使用恩诺沙星。
关键词: 马氏珠母贝;恩诺沙星;肠道微生物;α多样性;相对丰度;高通量测序
中图分类号: S968.316 文献标志码: A 文章编号:2095-1191(2019)05-1104-07
Abstract:【Objective】The aim of the study was to investigate the possible impact of enrofloxacin on Pinctada fucata martensii, find out the changing rule and provide a reference for the optimal treatment of bacterial infection in P. fucata martensii. 【Method】The microbial shifts in the intestine of P. fucata martensii in response to enrofloxacin treatments at di-fferent dosages(0, 5, and 10 mg/L) were quantitatively evaluated using 16S rDNA gene sequencing, and the similarities and differences of intestinal microbial community structure among different treatments were compared and analyzed by bioinformatics at the phylum and genus levels. 【Result】A total of 755159 effective sequences were obtained from 9 intestinal contents samples of P. fucata martensii(PA1, PA2, PA3, PB1, PB2, PB3, PC1, PC2 and PC3),belonging to 48 genera and 9 phyla. At the phylum level, the dominant genera of the control (PA, 0 mg/L) was Proteobacteria, Tenericutes and Firmicutes, whose relative abundances were 40.65%,33.87% and 15.75%, respectively. Nevertheless, the dominant phylum in two enrofloxacin treatment groups(PB, 5 mg/L; PC, 10 mg/L) were Proteobacteria, the relative abundance of which have reached 91.61% and 85.00% respectively. At the genus level, the dominant phylum of PA treatment were Mycoplasma, Exiguobacterium, Citrobacter, Escherichia-Shigella, the relative abundance of which were 26.33%, 12.22%,10.62% and 9.66%,respectively. Vibrio held the dominant position of PB, and its relative abundance was 52.10%. Vibrio and Photobacterium made up the most share of microbial community of PC, which collectively accounted for 40.24% and 23.43% respectively. OTU cluster analysis showed that there were 138 OTUs in three treatments(PA, PB and PC), accounting for 54.76% of the total OTUs. 176 OUTs were shared by PB and PC, which meaned that there was a higher similarity between the two treatments. 【Conclusion】Overall, enrofloxacin alters the microbial community diversity of P. fucata martensii as the dosage reaches 5 mg/L, and exposes them to the threat of pathogenic bacteria such as Vibrio. Therefore, the use of enrofloxacin should be carefully considered in the culture of P. fucata martensii.
Key words: Pinctada fucata martensii; enrofloxacin; intestinal microorganisms; α diversity; relative abundance; high-throughput sequencing
0 引言
【研究意义】动物肠道寄宿有大量微生物,在腸道中维持着一种动态和稳定平衡,并在宿主的消化、营养吸收和免疫等方面发挥重要作用(Burgents et al.,2004;Pérez et al.,2010;米海峰等,2015;Yamashiro,2017)。当肠道菌群结构遭受破坏时,微生物相互间的动态平衡被打破,而增加宿主患病的风险,致使宿主健康受到极大威胁(Ring et al.,2003;Round and Mazmanian,2009),即维持肠道菌群结构稳定十分重要。马氏珠母贝(Pinctada fucata martensii)是我国南方地区主要养殖的珍珠贝类之一,具有重要的经济价值(王大鹏等,2011;杨创业等,2015;李俊辉等,2017),但作为无脊椎动物其缺乏特殊的免疫系统以抵抗各种病原体的侵染和减缓环境压力的影响(吴宁等,2017),因此,明确马氏珠母贝的肠道微生物结构及其功能显得尤为重要。【前人研究进展】近年来,由于养殖海区水体环境的不断恶化,各种病害频繁暴发导致珍珠贝类养殖生产遭受巨大损失,其中由细菌引起的疾病已受到广泛关注。恩诺沙星(Enrofloxacin)作为一种高效的广谱抗菌剂,对许多细菌性疾病具有显著抑制作用,现已广泛应用于动物细菌性疾病的防治(马驿等,2007;郭荔等,2017),如水产常见的出血性败血症、烂鳃病和肠炎病等(刘开永和汪开毓,2004;刘礼辉等,2015;陆专灵等,2016),但其产生的副作用亦不容忽视。恩诺沙星与其他抗生素在水产养殖上所产生的副作用一样,主要包括产生耐药菌株、药物残留、抑制免疫系统及破坏微生态平衡(胡梦红,2006)。其中,微生态平衡的破坏不仅对周围水体环境有害,还会对水产动物肠道的微生态环境产生影响,尤其当不合理施用抗生素时,将严重破坏肠道微生态平衡而危害宿主健康(陆武等,2009)。目前,关于抗生素对动物肠道微生物群落影响的研究主要集中于人类和陆生哺乳动物(老鼠、猪和鸡等),一致认为抗生素的施用可抑制肠道菌群正常定植,引起菌群紊乱,使肠道微生物的多样性降低,导致细菌产生耐药性而影响宿主的生理代谢及免疫等相关功能(李同洲等,1999;王俐等,2003;王爱丽等,2009;刘颖等,2017;纪明宇等,2017)。【本研究切入点】至今,关于水产动物(特别是贝类)暴露于抗生素(尤其是恩诺沙星)后其肠道微生物群落变化的研究鲜见报道。【拟解决的关键问题】采用第三代测序技术(单分子测序技术)分析恩诺沙星对马氏珠母贝肠道微生物多样性的影响,以期了解其变化规律,进而为制定针对马氏珠母贝细菌感染的最佳治疗方案提供参考依据。
1 材料与方法
1. 1 试验动物
供试马氏珠母贝(壳长59.55±0.64 mm,壳高60.40±0.27 mm,壳宽22.18±0.36 mm,体重33.63±0.71 g)购自海南省陵水新村市场,运至中国水产科学研究院南海水产研究所热带水产研究开发中心后,参照Chen等(2016)的方法暂养2周,选择大小相近、健康无伤的个体进行试验。
1. 2 试验设计及样品采集
试验共设3个处理,分别为0、5和10 mg/L恩诺沙星。在3个体积为400 L的玻璃钢桶中分别调制出3个恩诺沙星浓度的海水,水体中恩诺沙星浓度根据Fang等(2012)的方法进行确定,然后将30只健康的马氏珠母贝分组吊养在不同玻璃钢桶中(每桶10只)。浸泡周期24 h,试验期间不投喂饵料。浸泡结束后,从每处理中随机取3只马氏珠母贝,分别记作0 mg/L(标号PA1、PA2和PA3)、5 mg/L(标号PB1、PB2和PB3)和10 mg/L(标号PC1、PC2和PC3)。对马氏珠母贝进行解剖并取出其内脏团,以无菌生理盐水冲洗干净后用灭菌剪刀和镊子取其肠道,经无菌水冲洗干净,以75%乙醇浸泡3 min,再用无菌水反复冲洗3次,然后将肠道内容物放入1.5 mL无菌离心管中,-80 ℃保存备用。
1. 3 DNA提取及扩增
参照陈明强等(2019)的方法提取马氏珠母贝肠道微生物总DNA,采用Qubit® 3.0荧光光度计和1.0%琼脂糖凝胶电泳检测DNA的含量和质量。以Illumina MiSeq平台设计的特异引物扩增马氏珠母贝肠道微生物16S rDNA序列V3~V4可变区,其中,上游引物为:5'-CCTACGGRRBGCASCAGKVRVG AAT-3',下游引物为:5'-GGACTACNVGGGTWTCT AATCC-3'。PCR反应体系25.0 μL:2.5 μL TransStart缓冲液,2.0 μL dNTPs,上游、下游引物各1.0 μL,20 ng模板DNA,以去离子水补足至25.0 μL。扩增程序:94 ℃预变性3 min;94 ℃ 5 s,57 ℃ 90 s,72 ℃ 10 s,进行24个循环;72 ℃延伸5 min。每个样品3个重复,扩增产物混合后以1.5%琼脂糖凝胶电泳检测其质量,并按Quick Gel提取试剂盒(QIAGEN公司)说明对PCR产物进行分离与纯化,再构建基因文库。
1. 4 高通量测序及生物信息学分析
采用Qubit® 3.0分光光度计检测基因文库,并定量至10 nM,然后上样至Illumina MiSeq设备进行高通量测序(Illumina,San Diego,CA,USA),采用PE 250/300测序策略进行测序。测序后,对所得原始序列进行质控过滤,采用Flash对通过质控的序列进行连接(Magoč and Salzberg,2011),并用Qiime对连接上的序列进行过滤,过滤原则:舍弃序列长度>200 bp、含模糊或错配碱基且平均质量分数≥20的序列,再用Uchime Algorithm去除嵌合体后得到有效数据(Caporaso et al.,2010)。以相似性为97%为标准,运用Uparse对所得的有效序列进行操作分类单元(Operational taxonomic unit,OTU)聚类,所得结果输入Silva 16S rRNA数据库,利用RDP Classifier贝叶斯算法进行物种注释(Wang et al.,2007),得到不同组别马氏珠母贝肠道微生物组成情况。根据OUT聚类分析结果,绘制样品的稀释曲线及含系统发育树的聚类热图,直观显示各处理间的相似性和差异性。同时,分析各处理间的共有或特有OUT,绘制韦恩图。最后,采用Qiime计算马氏珠母贝肠道微生物群落的α多样性指数,包括ACE、Chao1、Shannon、Simpson和覆盖率(Goods_coverage)等指数。
1. 5 统计分析
采用SPSS 19.0对试验数据进行单因素方差分析(One-way ANOVA),分析不同恩诺沙星处理组间的差异显著性。
2 结果与分析
2. 1 肠道微生物α多样性
9个马氏珠母贝肠道内容物样品经高通量测序后,分别得到109453(PA1)、129088(PA2)、141645(PA3)、51689(PB1)、50522(PB2)、110106(PB3)、129984(PC1)、53587(PC2)和66401(PC3)條原始序列,经连接、过滤及去除嵌合体后,分别得到97606、115752、131113、43011、45565、98874、116546、45906和60786条有效序列。有效序列在相似性为97%的水平上进行OTU聚类,共得到252个OTUs,3个处理分别聚类得到196、198和198个OTUs。从9个样品的稀释曲线(图1)可看出,随测序深度的增加,OTU数量随之增加,稀释曲线趋于平缓,OTU数量达峰值,测序结果可靠。同时,3个处理组的Goods_coverage均为100.0%,说明各样品的全部微生物均被检测到。
由表1可看出,PB处理马氏珠母贝肠道微生物的ACE指数(162.69)、Chao1指数(166.48)、Shannon指数(4.94)和Simpson指数(0.93)最高,但与PA和PC处理的差异不显著(P>0.05),表明不同恩诺沙星浓度处理下马氏珠母贝肠道微生物的丰度和多样性无明显差异。
2. 2 肠道微生物群落结构
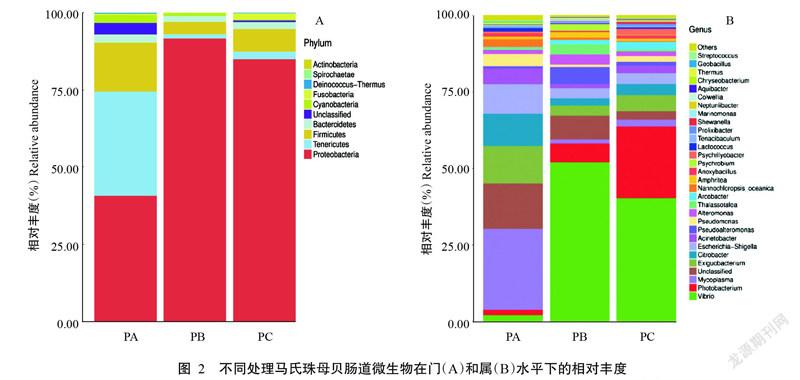
OTU代表序列经RDP Classifier分类工具物种注释后,共检测到9个菌门48个菌属。在门水平上,肠道微生物的相对丰度如图2-A所示。数据经标准化处理后,9个被检测到的菌门分别为:变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、梭杆菌门(Fusobacteria)、放线菌门(Actinobacteria)、蓝藻门(Cyanobacteria)、拟杆菌门(Bacteroidetes)、软壁菌门(Tenericutes)、螺旋菌门(Spirochaetae)和异常球菌—栖热菌门(Deinococcus-Thermus)。其中,PA处理马氏珠母贝肠道的优势菌门为变形菌门、软壁菌门和厚壁菌门,相对丰度分别为40.65%、33.87%和15.75%;PB和PC处理马氏珠母贝肠道的优势菌门相同,均为变形菌门,相对丰度分别达91.61%和85.00%。
在属水平上,马氏珠母贝肠道微生物的相对丰度如图2-B所示。其中,PA处理马氏珠母贝肠道的优势菌属为支原体属(Mycoplasma)、微小杆菌属(Exiguobacterium)、柠檬酸杆菌属(Citrobacter)和埃希氏菌—志贺氏菌属(Escherichia-Shigella),相对丰度分别为26.33%、12.22%、10.62%和9.66%;PB处理马氏珠母贝肠道的优势菌属为弧菌属(Vibrio),相对丰度为52.10%;PC处理马氏珠母贝肠道的优势菌属为弧菌属和发光杆菌属(Photobacterium),相对丰度分别为40.24%和23.43%。
2. 3 各处理间微生物群落的相似性
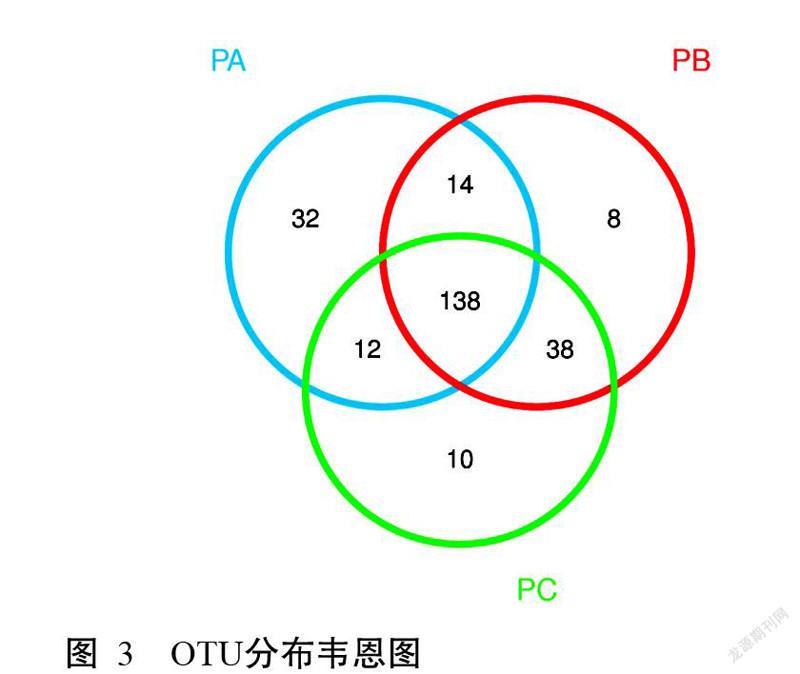
根据OTU聚类分析结果,分析不同处理马氏珠母贝肠道微生物的共有和特有OTU,结果(图3)显示,3个处理的共有OTUs为138个,占OTUs总数的54.76%。PA处理马氏珠母贝肠道微生物特有的OTUs数最多,为32个,而PB和PC处理分别为8和10个。此外,PB和PC处理马氏珠母贝肠道微生物的共有OTUs达176个,表明这两个处理间具有更高的相似性。
按照各处理马氏珠母贝肠道微生物在属水平下前30个相对丰度最高的物种分布绘制其聚类热图,通过热图颜色差异可直观显示各物种的相似性和差异性。结果(图4)显示,低浓度恩诺沙星处理(PB)和高浓度恩诺沙星处理(PC)聚为一支,二者与对照处理(PA)的距离相对较远,即聚类热图显示的结果与依据韦恩图得出的结果一致。
3 讨论
肠道微生态系统对动物机体来说十分重要,其与宿主共同形成一个生理上的统一体,两者互相依存、互相影响,在正常情况下保持着相对稳定的平衡状态(陶可等,2008)。当肠道菌群的微生态平衡受外界因素(环境条件、病原体和药物等)破坏时,其生理功能(营养代谢和免疫力等)将受到影响,从而影响宿主的生长发育及其健康水平(尹军霞和林德荣,2004;米海峰等,2015)。抗生素已被证实可对肠道微生态产生一定负面影响(丁丽等,2009),因此,利用16S rDNA测序技术研究恩诺沙星对马氏珠母贝肠道微生物群落的影响,对制定马氏珠母贝细菌感染的最佳治疗方案具有重要意义。本研究结果显示,从9个样品(PA1、PA2、PA3、PB1、PB2、PB3、PC1、PC2和PC3)中共获得755159个有效序列,归属于9个门,分别为变形菌门、厚壁菌门、梭杆菌门、放线菌门、蓝藻门、拟杆菌门、软壁菌门、螺旋菌门和异常球菌—栖热菌门。目前,关于水产动物肠道菌群结构的研究结果基本相似。在南移池塘养殖的仿刺身肠道中以厚壁菌门和变形菌门为主(杨求华等,2016),凡纳滨对虾肠道的优势菌门是变形菌门(何远法等,2017),牙鲆初孵仔鱼肠道的优势菌为厚壁菌门和变形菌门(刘增新等,2017),摄食全豆粕蛋白饲料的牛蛙肠道中则以变形菌门、梭杆菌门和厚壁菌门占主导地位(王健等,2018)。本研究结果也表明,门水平下的马氏珠母贝肠道微生物群落以变形菌门、软壁菌门和厚壁菌门为主,相对丰度分别为40.65%、33.87%和15.75%。
本研究通过对比发现,马氏珠母贝经恩诺沙星处理后,不管是低浓度处理(PB,5 mg/L)还是高浓度处理(PC,10 mg/L)其肠道优势菌相对于对照处理(PA,0 mg/L)均发生明显变化,其中,变形菌门相对丰度分别骤升到91.61%和85.00%,软壁菌门相对丰度则大幅降至1.36%和2.41%。软壁菌门是一类缺乏细胞壁的独特细菌,对人类有较高的致病性(Razin et al.,1998),对水产动物是否具有致病作用尚未明确,但根据软壁菌门对恩诺沙星具有较强的敏感性,可选用恩诺沙星作为抑菌剂以降低软壁菌门可能存在的致病风险。此外,Shin等(2015)研究认为变形菌门在肠道中占比的增加是肠道微生态失调的重要标志,同时是一种潜在的疾病诊断标准。本研究结果表明,在恩诺沙星曝露下马氏珠母贝肠道中变形菌门的相对丰度大幅上升,经恩诺沙星处理后均超过85.00%,暗示马氏珠母贝肠道微生态已失去平衡。抗生素的过度使用破坏了肠道微生物群落结构,削弱对病原菌定殖的抵抗力,变形菌门乘机大量繁殖。变形菌门中很多种类为条件致病菌,如大肠杆菌和霍乱弧菌等(林养等,2009),用药后变形菌门的增加可能会导致其显现出致病性,因此,恩诺沙星导致以变形菌门大量繁殖为特征的肠道微生态紊乱应受到高度重视,临床上须谨慎选择合理的治疗方案,以减少恩诺沙星引起的不良影响。
本研究还发现,在属水平上,变形菌门中的弧菌属在施药后明显增加,恩诺沙星低浓度处理(PB,5 mg/L)和高浓度处理(PC,10 mg/L)的弧菌属相对丰度分别达52.10%和40.24%。弧菌广泛流行于全国范围内的海域环境中,作为一种条件致病菌可引起海水养殖鱼类、贝类及甲壳类等暴发细菌性疾病,最终导致养殖生物大量死亡(吴后波和潘金培,2001;杨少丽等,2005)。弧菌属在抗生素处理下不降反升的现象,与许燕等(2018)用氟苯尼考干预斑石鲷的结果存在差异,可能是弧菌对于两种抗生素的敏感性不一致所引起。本研究中,弧菌属大量繁殖表明马氏珠母贝在恩诺沙星治疗中会受到致病弧菌的威胁,因此在马氏珠母贝养殖生产中须谨慎考虑恩诺沙星的使用。
4 结论
恩诺沙星处理浓度达5 mg/L时即对马氏珠母贝肠道微生物群落产生影响,并使其暴露于弧菌等致病菌的威胁下,因此在马氏珠母贝养殖生产中须谨慎使用恩诺沙星。
参考文献:
陈明强,李有宁,邓正华,于刚,马振华,郑兴,洪嘉炜,魏海军,王雨. 2019. 恩诺沙星曝露下企鹅珍珠贝肠道微生物多样性及优势菌变化规律[J]. 南方农业学报,50(4):851-859. [Chen M Q,Li Y N,Deng Z H,Yu G,Ma Z H,Zheng X,Hong J W,Wei H J,Wang Y. 2019. Intestinal microbial diversity and dominant bacteria change analysis of Pteria penguin(Röding) under enrofloxacin exposure[J]. Journal of Southern Agriculture,50(4):851-859.]
丁丽,周维仁,章世元,宦海琳,徐小明,顾金. 2009. 益生菌在水产上的应用及其对鱼类肠道菌群的影响[J]. 饲料工业,30(20):27-30. [Ding L,Zhou W R,Zhang S Y,Huan H L,Xu X M,Gu J. 2009. Application of probio-tics in aquaculture and effects on intestinal microflora in fish[J]. Feed Industry,30(20):27-30.]
郭荔,胡冬民,戴小华,王丽平. 2017. 糖尿病大鼠P-糖蛋白编码基因Abcb1 mRNA的表达及其对口服恩诺沙星药动学的影响[J]. 江苏农业学报,33(4):874-880. [Guo L,Hu D M,Dai X H,Wang L P. 2017. Abcb1 mRNA expre-ssion levels in different organs of diabetic rats and the effect on pharmacokinetics of oral enrofloxain[J]. Jiangsu Journal of Agricultural Sciences,33(4):874-880.]
何远法,迟淑艳,谭北平,张含乐,董晓慧,杨奇慧,刘泓宇,章双. 2017. 酵母培养物对凡纳滨对虾肠道菌群结构的影响[J]. 广东海洋大学学报,37(4):21-27. [He Y F,Chi S Y,Tan B P,Zhang H Y,Dong X H,Yang Q H,Liu H Y,Zhang S. 2017. Effect of yeast culture on intestinal microbiota of Litopenaeus vannamei[J]. Journal of Guangdong Ocean University,37(4):21-27.]
胡梦红. 2006. 抗生素在水产养殖中的应用、存在的问题及对策[J]. 水产科技情报,33(5):217-221. [Hu M H. 2006. The application,problems and countermeasures of antibio-tics in aquaculture[J]. Fisheries Science & Technology Information,33(5):217-221.]
纪明宇,汪运山,杨炜华. 2017. 早期使用抗生素对小儿肠道微生态及生长发育的影响[J]. 中国微生态学杂志,29(6):731-734. [Ji M Y,Wang Y S,Yang W H. 2017. Influence of early-life pulsed antibiotic treatment on gut microbio-me and growth of infants[J]. Chinese Journal of Microe-cology,29(6):731-734.]
李俊辉,罗燕秋,钟雅诗,黄怡,黄荣莲,王庆恒,邓岳文. 2017. 近交对马氏珠母贝生长性状、遗传多样性及矿化基因表达的影响[J]. 南方农业学报,48(1):132-138. [Li J H,Luo Y Q,Zhong Y S,Huang Y,Huang R L,Wang Q H,Deng Y W. 2017. Effects of inbreeding on growth traits,genetic diversity and biomineraliazation gene expression of Pinctada fuctada martensii[J]. Journal of Southern Agriculture,48(1):132-138.]
李同洲,臧素敏,李德發. 1999. 饲用抗生素对仔猪肠道菌群及肠道物质代谢影响的研究[J]. 饲料研究,(5):3-5. [Li T Z,Zang S M,Li D F. 1999. Effects of feeding antibiotics on intestinal microflora and metabolism of intestinal substances in piglets[J]. Feed Research,(5):3-5.]
林养,白桦,吴春芳. 2009. 变形杆菌对常用抗生素的耐药性分析[J]. 海南医学院学报,15(4):327-328. [Lin Y,Bai H,Wu C F. 2009. Analysis of antibiotics resistance of proteus[J]. Journal of Hainan Medical College,15(4):327-328.]
刘开永,汪开毓. 2004. 恩诺沙星在水产中的应用与研究[J]. 中国兽药杂志,38(10):32-34. [Liu K Y,Wang K Y. 2004. Study and practice on enrofloxacin in fishery[J]. Chinese Journal of Veterinary Drug,38(10):32-34.]
刘礼辉,张德锋,李宁求,石存斌,颜曦,付小哲,林强. 2015. 鲮鱼源无乳链球菌的鉴定、血清型分析及药敏试验[J]. 南方农业学报,46(11):2053-2058. [Liu L H,Zhang D F,Li N Q,Shi C B,Yan X,Fu X Z,Lin Q. 2015. Identification,serotype analysis and drug sensitivity test of Streptococcus agalactiae from Cirrhinus molitorella[J]. Journal of Southern Agriculture,46(11):2053-2058.]
劉颖,王海斌,周刚,霍永久,董丽,王海飞,包文斌,喻礼怀. 2017. 抗生素对仔猪肠道微生物的影响[J]. 动物营养学报,29(8):2912-2922. [Liu Y,Wang H B,Zhou G,Huo Y J,Dong L,Wang H F,Bao W B,Yu L H. 2017. E-ffects of antibiotics on intestinal microorganisms of piglets[J]. Chinese Journal of Animal Nutrition,29(8):2912-2922.]
刘增新,柳学周,史宝,徐永江,刘权. 2017. 牙鲆(Paralichthys olivaceus)仔稚幼鱼肠道菌群结构比较分析[J]. 渔业科学进展,38(1):111-119. [Liu Z X,Liu X Z,Shi B,Xu Y J,Liu Q. 2017. Composition of intestinal bacterial community of Japanese flounder(Paralichthys olivaceus) during early life stages[J]. Progress in Fishery Sciences,38(1):111-119.]
陆武,沈红芬,刘军. 2009. 抗菌药物致肠道菌群失调的机制及防治[J]. 药学服务与研究,9(3):222-224. [Lu W,Shen H F,Liu J. 2009. Imbalance of intestinal flora induced by antibacterials,and its treatment and prevention[J]. Pharmaceutical Care and Research,9(3):222-224.]
陆专灵,钟一治,赵忠添,雷燕,韦友传,张益峰. 2016. 黄喉拟水龟白眼病病原菌分离鉴定及药敏试验[J]. 南方农业学报,47(11):1974-1978. [Lu Z L,Zhong Y Z,Zhao Z T,Lei Y,Wei Y C,Zhang Y F. 2016. Isolation,identification and drug sensitivity test of pathogen causing withe eye disease of Mauremys mutica[J]. Journal of Southern Agriculture,47(11):1974-1978.]
马驿,陈杖榴,曾振灵. 2007. 恩诺沙星对土壤微生物群落功能多样性的影响[J]. 生态学报,27(8):3400-3406. [Ma Y,Chen Z L,Zeng Z L. 2007. Effects of enrofloxacin on functional diversity of soil microbial communities[J]. Acta Ecologica Sinica,27(8):3400-3406.]
米海峰,孙瑞健,张璐,李宝圣,王武刚,吴业阳,王用黎. 2015. 鱼类肠道健康研究进展[J]. 中国饲料,(15):19-22. [Mi H F,Sun R J,Zhang L,Li B S,Wang W G,Wu Y Y,Wang Y L. 2015. Research progress on the fish intestine[J]. China Feed,(15):19-22.]
陶可,王永才,童晓莉,周勤飞,谭智忠,熊宜强. 2008. 兔不同时期胃肠道内微生物区系的变化与消化道疾病的调控[J]. 中国养兔杂志,(5):44-46. [Tao K,Wang Y C,Tong X L,Zhou Q F,Tan Z Z,Xiong Y Q. 2008. A review on bacterial flora of the rabbit gastrointestinal tract in diffe-rent stage and the controlling of digestive system disease[J]. Chinese Journal of Rabbit Farming,(5):44-46.]
王爱丽,武庆斌,孙庆林. 2009. 抗生素对新生大鼠肠道菌群和肠道免疫发育的影响[J]. 中国微生态学杂志,21(6):512-514. [Wang A L,Wu Q B,Sun Q L. 2009. Influences of antibiotics administration on the intestinal flora and immune system development of neonatal rats[J]. Chinese Journal of Microecology,21(6):512-514.]
王大鹏,何安尤,曹占旺,甘西. 2011. 北海营盘新马氏珠母贝养殖区养殖容量的研究[J]. 南方农业学报,42(12):1555-1559. [Wang D P,He A Y,Cao Z W,Gan X. 2011. Carrying capacity of Yingpan new Pinctada martensii culture area in Beihai City,Guangxi[J]. Journal of Sou-thern Agriculture,42(12):1555-1559.]
王健,王玲,鲁康乐,宋凯,张春晓. 2018. 摄食全豆粕蛋白饲料的牛蛙肠道微生物组成[J]. 集美大学学报(自然科学版),23(4):241-248. [Wang J,Wang L,Lu K L,Song K,Zhang C X. 2018. An analysis of the gut microbial co-mmunity of bullfrog[Rana(Lithobates) catesbeiana] fed with soybean meal based diets[J]. Journal of Jimei University(Natural Science),23(4):241-248.]
王俐,蔡辉益,刘国华. 2003. 不同抗生素对肉鸡肠道微生物的影响[J]. 中国饲料,(6):21-22. [Wang L,Cai H Y,Liu G H. 2003. The effect of application different antibio-tics on microorganism of broiler[J]. China Feed,(6):21-22.]
吴后波,潘金培. 2001. 弧菌属细菌及其所致海水养殖动物疾病[J]. 中国水产科学,8(1):89-93. [Wu H B,Pan J P. 2001. Progress in studies of vibriosis in aquaculture[J]. Journal of Fishery Sciences of China,8(1):89-93.]
吴宁,陈梦玫,王素芳. 2017. 贝类免疫机制的研究进展[J]. 药物生物技术,24(1):68-71. [Wu N,Chen M M,Wang S F. 2017. Research progress of shellfish immune mechanism[J]. Pharmaceutical Biotechnology,24(1):68-71.]
许燕,王印庚,张正,姜燕,廖梅杰,李彬,王凯,李文生. 2018. 不同健康程度和抗生素氟苯尼考干预下斑石鲷肠道菌群的结构差异[J]. 水产学报,42(3):388-398. [Xu Y,Wang Y G,Zhang Z,Jiang Y,Liao M J,Li B,Wang K,Li W S. 2018. Variance analysis of bacterial community in the intestine of cultured spotted knifejaw(Oplegnathus punctatus) at different healthy levels and intervened with florfenicol[J]. Journal of Fisheries of China,42(3):388-398.]
楊创业,吴丹阳,王庆恒,邓岳文,杜晓东. 2015. 马氏珠母贝生长性状遗传力估计[J]. 中国农学通报,31(23):25-29. [Yang C Y,Wu D Y,Wang Q H,Deng Y W,Du X D. 2015. Heritability estimation for growth traits of Pinctada martensii[J]. Chinese Agricultural Science Bulletin,31(23):25-29.]
杨求华,陆振,林琪,黄瑞芳,何丽斌,葛辉,周宸,杜虹. 2016. 南移池塘养殖仿刺参肠道菌群结构分析[J]. 渔业研究,38(3):192-201. [Yang Q H,Lu Z,Lin Q,Huang R F,He L B,Ge H,Zhou C,Du H. 2016. Bacterial component analysis of the gut of South Apostichopus japonicus cultured in pond[J]. Journal of Fisheries Research,38(3):192-201.]
杨少丽,王印庚,董树刚. 2005. 海水养殖鱼类弧菌病的研究进展[J]. 海洋水产研究,26(4):75-83. [Yang S L,Wang Y G,Dong S G. 2005. Progress of research on vibriosis in marine cultured fish[J]. Marine Fisheries Research,26(4):75-83.]
尹军霞,林德荣. 2004. 肠道菌群与疾病[J]. 生物学通报,39(3):26-28. [Yin J X,Lin D R. 2004. Intestinal microbiota and diseases[J]. Bulletin of Biology,39(3):26-28.]
Burgents J E,Burnett K G,Burnett L E. 2004. Disease resistance of Pacific white shrimp,Litopenaeus vannamei,fo-llowing the dietary administration of a yeast culture food supplement[J]. Aquaculture,231(1-4):1-8.
Caporaso J G,Kuczynski J,Stombaugh J,Bittinger K,Bushman F D,Costello E K,Fierer N,Peña A G,Goodrich J K,Gordon J I,Huttley G A,Kelley S T,Knights D,Koenig J E,Ley R E,Lozupone C A,McDonald D,Muegge B D,Pirrung M,Reeder J,Sevinsky J R,Turnbaugh P J,Walters W A,Widmann J,Yatsunenko T,Zaneveld J,Knight R. 2010. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods,7(5):335-336.
Chen H,Song Q,Diao X,Zhou H. 2016. Proteomic and metabolomic analysis on the toxicological effects of Benzo[a]pyrene in pearl oyster Pinctada martensii[J]. Aquatic Toxicology,175:81-89.
Fang X,Liu X,Liu W,Lu C. 2012. Pharmacokinetics of enrofloxacin in allogynogenetic silver crucian carp,Carassius auratus gibelio[J]. Journal of Veterinary Pharmacology and Therapeutics,35(4):397-401.
Magoč T,Salzberg S L. 2011. FLASH:Fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics,27(21):2957-2963.
Pérez T,Balcázar J L,Ruiz-Zarzuela I,Halaihel N,Vendrell D,de Blas I,Múzquiz J L. 2010. Host-microbiota interactions within the fish intestinal ecosystem[J]. Mucosal Immunology,3(4):355-360.
Razin S,Yogev D,Naot Y. 1998. Molecular biology and pathogenicity of mycoplasmas[J]. Microbiology & Molecular Biology Reviews,62(4):1094-1156.
Ring E,Olsen R E,Mayhew T M,Myklebust R. 2003. Electron microscopy of the intestinal microflora of fish[J]. Aquaculture,227(1-4):395-415.
Round J L,Mazmanian S K. 2009. The gut microbiota shapes intestinal immune responses during health and disease[J]. Nature Reviews Immunology,9(5):313-323.
Shin N R,Whon T W,Bae J W. 2015. Proteobacteria:Microbial signature of dysbiosis in gut microbiota[J]. Trends in Biotechnology,33(9):496-503.
Wang Q,Garrity G M,Tiedje J M,Cole J R. 2007. Naive Bayesian classifier for rapid assignment of rRNA sequen-ces into the new bacterial taxonomy[J]. Applied and Environmental Microbiology,73(16):5261-5267.
Yamashiro Y. 2017. Gut microbiota in health and disease[J]. Annals of Nutrition & Metabolism,71(3-4):242-246.
(責任编辑 兰宗宝)
