酵母肽体重控制代餐粉调节糖脂代谢功能评价
2019-09-10赵可心段盛林韩诗雯潘聪于伟厚夏凯
赵可心 段盛林 韩诗雯 潘聪 于伟厚 夏凯



摘 要:目的:评价酵母肽体重控制代餐粉对于调节糖脂代谢的作用。方法:用酵母肽以及多种谷物粉配制体重控制代餐粉,采用体外消化的方法测定其GI值。提取得代餐粉水提物,得率为42.97%。将所得的水提物作用于游离脂肪酸诱导的胰岛素抵抗HepG2细胞,采用MTT实验检测其对细胞的毒性,观察HepG2细胞上清葡萄糖、胞内糖原、胞内TG、胞内TC以及油红O染色的变化情况。结果:代餐粉的血糖生成指数(Glycemic Index,GI)为44.23,为低GI食品;其水提物在100~500μg/mL时对细胞的增殖没有影响;与对照组相比,模型组细胞内糖原的含量显著降低,上清葡萄糖,胞内TG、TC的含量均显著升高,代餐粉处理后胞内糖原的含量明显上升,上清葡萄糖,胞内TG、TC的含量均显著下降;油红O染色结果说明,模型组细胞内出现了大量小油滴,说明模型组出现脂代谢异常,而二甲双胍和代餐粉处理后,红色区域明显减少,且500μg/mL代餐粉处理组效果优于300μg/mL。结论:酵母肽体重控制代餐粉可以减缓葡萄糖的释放,调节HepG2细胞的糖脂代谢,减轻HepG2胰岛素抵抗。
关键词:酵母肽;代餐粉;血糖生成指数;糖脂代谢
酵母肽是以优质鲜酵母为原料,利用多种酶降解酵母蛋白,破除酵母壁并从酶解体系中分离纯化而制成的小分子多肽[1],其氨基酸種类齐全,比例更接近于联合国粮农组织和世界卫生组织推荐的理想蛋白质的氨基酸组成比例,是优质的蛋白质来源[2]。代餐粉是一种由谷类、豆类、薯类食材等为主,其他植物的根、茎、果实等可食用部分为辅制成的一种单一或综合性冲调粉剂产品。因此,以酵母肽为主,辅以谷物粉、紫薯粉制备而成的营养代餐粉,将为快节奏高强度生活下追求健康生活的人们提供更便利的饮食和均衡的营养。
低血糖生成指数(Glycemic Index,GI)食物进入肠道后停留的时间长,释放缓慢,使得血液中葡萄糖峰值较低,引起餐后血糖反应较小,需要的胰岛素也相应减少,避免了血糖的剧烈波动,所以能够有效控制血糖,既可以预防高血糖也能够预防低血糖[3-6]。同时低GI膳食能降低血脂,改善胰岛素抵抗,其原因是血液游离脂肪酸水平在进食低GI膳食后被抑制,同时拮抗激素的反应,进而使外周组织对葡萄糖的摄取利用率增加[7]。因此,低GI膳食可以调节糖脂代谢,达到轻脂减重和改善胰岛素抵抗的效果。
本研究中酵母肽体重控制代餐粉中含有高膳食纤维的紫甘薯粉和木耳粉,脂肪代谢促进剂左旋肉碱,优质蛋白酵母肽以及各种谷物粉。研究表明,血清高浓度左旋肉碱可改善胰岛素抵抗,促进糖脂代谢,对体重控制起辅助作用[8]。从配方来讲,该代餐粉不仅营养全面,饱腹感强,还能调节糖脂代谢,控制体重。本研究评价了酵母肽体重控制代餐粉对胰岛素抵抗HepG2细胞糖脂代谢的影响。
1 材料与方法
1.1 材料与试剂
酵母肽体重控制代餐粉,中国食品发酵工业研究院自行研发;白面包,市场购买;人肝癌细胞株(HepG2),北京协和细胞中心;DMEM培养基、磷酸盐缓冲液(PBS)、DMEM无糖培养基、小牛血清,美国Gibco;油酸(OA)、棕榈酸(PA)、DCFH-DA、二甲基亚砜(DMSO)、噻唑兰(MTT)、油红O染色剂、胰蛋白酶、胃蛋白酶、淀粉转葡萄糖苷酶和胰酶,美国Sigma化学公司;无FFA牛血清蛋白(BSA),日本WAKO公司;RIPA裂解液、TG试剂盒、葡萄糖试剂盒,碧云天生物技术研究所;乙腈、甲醇,均为色谱纯;瓜尔豆胶,北京化工厂;95%乙醇、磷酸二氢钠、磷酸氢二钠、盐酸、氢氧化钠,国产分析纯。
1.2 仪器与设备
高效液相色谱仪,日本岛津公司;倒置生物显微镜,日本OLympus公司;生物安全柜,中国济南鑫贝西生物技术有限公司;细胞培养箱,日本松下公司;Spectra Max i3酶标仪,美国Molecular Devices公司;分析天平,梅特勒-托利多仪器有限公司;超声波清洗仪,昆山超声仪器有限公司;pH计,上海雷磁仪器厂;GL-20G-Ⅱ型高速冷冻离心机,上海安亭科学仪器厂;DK-8D三温三控水槽,上海博迅实业有限公司。
1.3 方法
1.3.1 体外模拟消化测定酵母肽体重控制代餐粉的GI值 (1)口腔模拟[9]:取含1 g可利用的碳水化合物的各样品组放入一烧杯中,加入 3mL 0.1mol/L的磷酸缓冲液和1mL预先加热到37℃的淀粉酶,用研钵棒轻轻上下敲打15次后(或15s)(保持在37℃的环境中)。(2)胃部模拟:即用4mL 0.1mol/L的磷酸缓冲液冲洗研钵棒,保证研钵棒上的样品都转移至烧杯中,加入6mL含有0.4g/L的NaCl、0.05g胃蛋白酶和0.05g瓜尔豆胶的0.1mol/L磷酸缓冲液,利用2mol/L HCl溶液调到pH1.5,放入3~5颗玻璃球,然后放在37℃摇床中保温30min。(3)小肠模拟[10]:将10 mL磷酸缓冲液(pH 6.9,0.5 mol/L)加入到上述溶液中,利用50%的NaOH溶液调节pH为6.9;然后加入125 μL MgCl2-CaCl2溶液、125 μL 胰酶溶液、400 μL淀粉转葡萄糖苷酶,补充蒸馏水至50 mL,在37℃摇床中保温180 min。不同时间取1 mL样品放入含有4 mL 95%的乙醇溶液中(预热至60℃),沸水浴灭酶后自然冷却,10 000 r/min离心10min,上清过 0.45 μm 微孔滤膜后进行高效液相色谱测定。(4)葡萄糖的测定:色谱柱:Hypersil NH2S氨基色谱柱(4.6×250 mm,5 μm)、柱温40℃、流动相:乙腈∶水 70∶30(V/V)、流速1.0 mL/min、进样量10 μL[11]。(5)计算方法:按照葡萄糖释放量,计算碳水化合物水解率,绘制碳水化合物水解率和时间关系图,模拟方程,计算曲线下面积。定义面包的水解率为100,从而计算样品的水解率HI,按照GI与HI的关系式:GI=0.862HI+8.189计算样品的GI[12-13]。
1.3.2 超声法制备酵母肽体重控制代餐粉水提物 取酵母肽体重控制代餐粉10 g,置于烧杯中,加入250 mL 去离子水,料液比为1∶25,温度为30 ℃;超声波辅助提取1 h;提取液经真空抽滤得到澄清提取液①;在滤渣中继续加入250 mL 去离子水,超声波辅助提取1 h,真空抽滤得到澄清提取液②;合并提取液①和②,真空旋转蒸发浓缩,浓缩后浸膏采用真空冷冻干燥,得到酵母肽体重控制代餐粉水提物[14],水提物得率为42.97%。
1.3.3 人肝癌细胞株HepG2的培养 人肝癌细胞株HepG2细胞培养于含有10%新生牛血清、青霉素100 U/mL和链霉素100 μg/mL的DMEM培养基中,于培养箱37℃、5% CO2培养条件下培养。选取对数生长期细胞进行实验。将细胞以1×106个/mL浓度接种于96孔板,待细胞贴壁并长满时,用PBS润洗细胞1次,加入不同的处理液。实验分组如下,对照组:25 mmol/L葡萄糖组(25G 1% BSA)、模型组:20 mmol/L葡萄糖+15 mmol/L果糖组(20G 15F 1 mmol/L FFA)组以及模型组中加入各浓度酵母肽体重控制代餐粉提取物[15]。
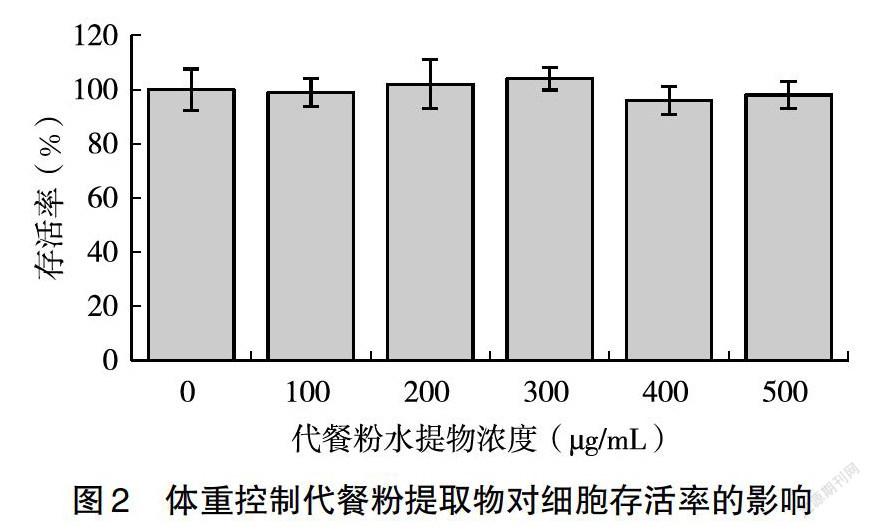
1.3.4 MTT法测定HepG2细胞存活率 取96孔培养板,每孔加100 μL细胞悬液,HepG2细胞浓度为1×105个/mL,37℃培养24 h后弃去培养液,用PBS清洗1次,每孔加入100μL100、200、300、400、500μg/mL的酵母肽体重控制代餐粉水提物干预24h后除去培养液,加入0.5 mg/mL MTT-DMEM于37℃避光孵育4 h,再加入100 μL DMSO,震荡混匀以完全溶解出MTT紫色结晶产物。用酶标仪在490nm处测定吸光度值。以对照组细胞的细胞存活率为100%计算其余组别细胞存活率。
1.3.5 油红O染色 油红O是一种脂溶性偶氮染料,具有很强的脂溶性和染脂性,该染料可特异性的与组织内或细胞内的甘油三脂(TG)等中性脂肪结合成小滴状而使脂类物质着色呈现橘红色,同时又可以避免使细胞内的其他成分与油红O发生反应而被其染色,以干扰实验结果[16-18]。细胞加样处理24 h后,弃掉旧培养基,用PBS缓冲液洗去残余的细胞培养基,加入新鲜配制好的75%乙醇,室温环境下固定细胞10min。再用PBS缓冲液洗去残余的乙醇溶液,重復3次,然后加入新鲜配制的油红O染液工作液,室温下染色10 min。弃掉油红O,用PBS缓冲液洗去残余的油红O,重复3次。将细胞培养皿置于倒置相差显微镜下观察细胞中脂滴的形成。
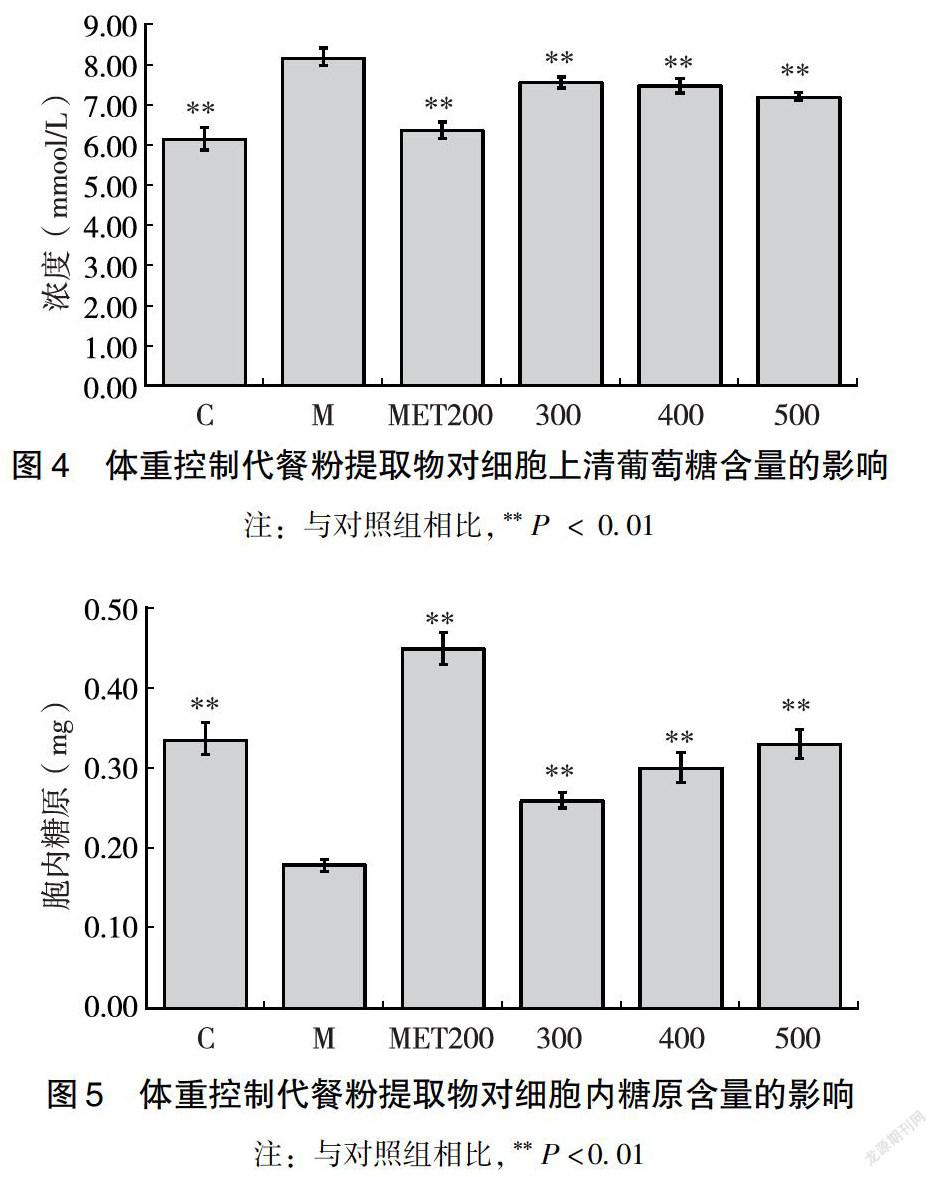
1.3.6 糖代谢指标的检测 细胞糖吸收测试:将对数期生长的细胞接于96孔板中,待细胞长满后,弃去上清,PBS清洗1次,各组(每组设置3个平行)细胞加样处理24 h后,小心弃去培养液,用PBS洗1次,换为12.5 mmol/L DMEM培养基,培养 24 h后取5μL上清液,用葡萄糖试剂盒测定葡萄糖含量。
细胞内糖原含量的检测:将对数期生长的细胞接于12孔板中,待细胞长满后,弃去上清,PBS清洗1次,各组(每组设置3个平行)细胞加样处理24 h后,小心弃去培养液,PBS 洗1次,细胞用RIPA裂解液裂解,用糖原试剂盒测定胞内糖原含量。结果以模型组的百分比表示。
1.3.7 脂代谢指标的检测 将对数期生长的细胞接于12孔板中,待细胞长满后,弃去上清,PBS清洗1次,各组(每组设置3个平行)细胞加样处理24 h后,小心弃去培养液,将板内待测定细胞用PBS润洗2次后,加入RIPA裂解液。充分裂解后,用TG试剂盒测定TG含量,TC试剂盒测定TC含量。结果以模型组TG和TC含量的百分比表示(%)。
1.4 统计学处理
采用每组实验重复3次,结果以X±SD表示。采用SPSS 23软件进行单因素方差分析,来判断显著性差异,*P<0.05代表有显著性差异,**P < 0.01代表有极显著性差异。
2 结果与分析
2.1 酵母肽体重控制代餐粉的GI值
以葡萄糖浓度为横坐标、峰面积为纵坐标,绘制葡萄糖标准曲线,进行线性回归分析,得到回归方程为Y=61 244X-183.7,r2=0.999(n=3),表明葡萄糖在0~2 mg/mL浓度范围内线性良好。对体重控制代餐粉体外消化过程中葡萄糖的变化进行检测。如图1所示,随着消化时间的延长,白面包和体重控制代餐粉酶解后的葡萄糖浓度都在不断增加。相比白面包组来讲,体重控制代餐粉酶解后葡萄糖浓度增加速度比较缓慢,对血糖浓度影响较小。经计算得知,白面包GI值为94.38,酵母肽体重控制代餐粉GI值为44.23,为低GI食品。结果表明,酵母肽体重控制代餐粉可以有效抑制因摄入可溶性碳水化合物而导致的血糖升高,有利于调节糖代谢。
2.2 MTT法测定HepG2细胞存活率
MTT法是一种检测细胞存活和生长的方法,其检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲臜并沉积在细胞中,而死细胞无此功能[19]。二甲基亚砜(DMSO)能溶解细胞中的甲臜,用酶联免疫检测仪在540 nm波长处测定其光吸收值,可间接反映活细胞数量。酵母肽体重控制代餐粉水提物处理细胞24 h后,发现水提物浓度为0~500 μg/mL时对HepG2细胞增殖没有明显影响,说明该浓度的水提物对HepG2细胞无毒性,因此,后续细胞实验可选用0~500 μg/mL的提取物对细胞进行处理(图2)。
2.3 油红O染色
油红O染色结果表明,对照组细胞与模型组细胞的细胞形态出现明显差异,大量模型组细胞被油红O染成红色,说明模型组细胞内发生脂质累积,出现小油滴,表明胰岛素抵抗模型构建成功。阳性对照二双胍组被染成红色的区域较少,说明二甲双胍具有明显的促进脂代谢的作用,抑制脂质在细胞内积累。300 μg/mL和500 μg/mL的代餐粉提取物两组的红色油滴较少,500 μg/mL组红色区域明显少于300 μg/mL,且说明酵母肽体重控制代餐粉可以促进脂代谢,抑制脂质在细胞内积累且呈现剂量依赖性(图3)。
2.4 酵母肽体重控制代餐粉对胰岛素抵抗HepG2细胞糖代谢的影响
与对照组相比,模型组细胞上清葡萄糖的含量上升,细胞内糖原的含量下降,说明模型组细胞吸收葡萄糖的能力下降,糖原降解速度加快,肝糖异生明显,说明FFA诱导后HepG2细胞内糖代谢异常。二甲双胍处理后,细胞上清葡萄糖含量显著下降,胞内糖原显著上升(**P<0.01),说明二甲双胍能够促进细胞吸收葡萄糖,抑制细胞内糖原的降解。代餐粉水提物处理24 h后,上清葡萄糖含量明显下降(**P <0.01),且与水提物浓度呈现负相关趋势;胞内糖原的含量显著上升(**P<0.01),且呈现剂量依赖性,表明体重控制代餐粉水提物可促进糖脂代谢紊乱HepG2细胞摄取葡萄糖,抑制细胞内肝糖原降解,从而改善胰岛素抵抗。且代餐粉水提物改善胰岛素抵抗HepG2细胞糖代谢的方式与阳性对照药物二甲双胍一致(图4、图5)。
2.5 酵母肽体重控制代餐粉对胰岛素抵抗HepG2细胞脂代谢的影响
与对照组相比,模型组细胞内TG和TC的含量显著上升(**P<0.01),说明FFAs诱导后,TG和TC在细胞内发生累积,细胞脂代谢异常。200μg/mL的二甲双胍处理后,细胞内TG和TC的含量显著低于模型组(**P<0.01),说明二甲双胍能够抑制胰岛素抵抗HepG2细胞内TG和TC的积累,调节细胞的脂代谢。加样处理24 h后,与模型组相比,随着样品浓度增加,胞内TG水平整体低于对照组,且400μg/mL组和500μg/mL组有显著性差异(*P<0.05)。由图7可知,加样处理24 h后,与模型组相比,随着样品浓度增加,胞内TC水平整体显著低于对照组(*P<0.05)。这表明体重控制代餐粉提取物可能通过促进胞内TG的释放以及胞内脂肪代谢,从而减少了胞内TG的累积,其作用方式与阳性药物二甲双胍一致。且体重控制代餐粉提取物促进脂代谢的功能呈现一定的剂量依赖性(图6、图7)。
3 结论
本研究对Englyst[20]的体外消化方法进行完善,通过模拟食物的体内消化过程,确定了酵母肽体重控制代餐粉为低GI食品,代餐粉相对于白面包而言,葡萄糖释放更加缓慢,不会导致人体血糖短时间迅速上升,从而起到控制糖代谢的作用。脂质过度蓄积(主要是TG)是造成肥胖、形成非酒精性脂肪肝、影響肝功能正常进行的先决因素[21]。与正常组细胞相比,模型组TG含量急剧上升且细胞形态发生变化,细胞轮廓不清晰,细胞内油脂滴多,细胞外有大量油圈,说明FFAs诱导后HepG2细胞已发生严重的细胞损伤且脂质蓄积过多。代餐粉水提物处理后,细胞内TG和总胆固醇(TC)的水平显著降低,油红O染色图中代餐粉组小油滴的含量明显减少,说明酵母肽体重控制代餐粉能够抑制TG和TC在细胞内的积累从而维持脂代谢的平衡。
肝脏是糖代谢最主要器官之一,对维持血糖稳定有重要作用,主要表现在糖异生、糖原合成和摄取、利用及释放葡萄糖。肝脏糖代谢异常产生胰岛素抵抗,且为2型糖尿病基本病理生理现象[22-23]。因此,维持肝脏正常的糖代谢对机体具有重要意义。本研究发现,酵母肽体重控制代餐粉提取物能够促进细胞吸收葡萄糖,减缓糖原的降解,从而维持正常的糖代谢平衡。
参考文献
[1]梁天姣.壳寡糖的制备及其在酵母多肽分离纯化上的应用研究[D]. 广东湛江:广东海洋大学,2015.
[2]江建梅,董连杰,陈冠青.酵母多肽在食品领域的应用及前景[J]. 食品安全导刊,2013(1):56-57.
[3]Jenkins DJ,Wolever TM,Taylor RH,et al.Glycemic index of foods:a physiological basis for carbohydrate exchange[J]. The American Journal of Clinical Nutrition,1981,34(3):362-366.
[4]The committee on food and nutrition of American diabetic association.Nutritional recommendations and principles for individuals with diabetes mellitus [J]. Diabetes Care,1991,14(25):20.
[5]Carbohydrates in human nutrition:Report of a Joint FAO/WHO Expert Consultation[M]. Food and Nutrition Paper,FAO 66.FAO Rome,1998.
[6]Granfeldt Y.Food factors affecting metabolic responses to cereal products[J]. University of Lund,1994.
[7]孙建琴,沈秀华,陈霞飞.食物血糖指数与糖尿病防治[J].肠外与肠内营养,2005,12(5):311-314.
[8]王诗琪,郭昆全.左旋肉毒碱与2型糖尿病[J]. 中国糖尿病杂志,2017(11):1051-1053.
[9]Englyst HN,Kingman SM,Cummings JH.Classification and measurement of nutritionally important starch fractions[J]. European Journal of Clinical Nutrition,1992(46):33-50.
[10]Granfeldt Y.Food factors affecting metabolic responses to cereal products[J]. University of Lund,1994.
[11]刘国玉.复合糖元模式研究及其在低GI特膳米中应用[D].中國食品发酵工业研究院,2016.
[12]杨月欣,崔红梅,王岩,等.常见谷类和薯类的血糖生成指数[J]. 营养学报,2003,25(2):78-82.
[13]Foster-Powell K,Foster-Powell K,Miller JB.International tables of glycemic index[J]. The American Journal of Clinical Nutrition,1995,62(4):871-890.
[14]刘杰尔.松花粉成分分析及其轻身减肥功能初探[D].杭州:浙江大学,2008.
[15]柳嘉,郭孝萱,吴薇,等.高糖高脂诱导胰岛素抵抗HepG2细胞模型的建立及活性成分的功能评价[J]. 食品科技,2012,37(3):73-78.
[16]郑婧.肉桂多酚对 HepG2细胞脂质代谢的影响及其机制[J]. 山东医药,2017(1):38-40.
[17]欧露,麻燕妮,张彩平,等.烟酸通过下调 PCSK9的表达促进 HepG2细胞摄取LDL-C[J].中国药理学通报,2017(2):243-248.
[18]李欣,王帅,周岳,等.羟基肉桂酸对HepG2和C2C12细胞糖脂代谢的调节作用[J]. 国际药学研究杂志,2017(7):693-698.
[19]边兴艳.MTT比色法及其应用[J].国外医学临床生物化学与检验学分册,1998,19(2):83-85.
[20]Englyst HN,Kingman SM,Cummings JH.Classification and measurement of nutritionally important starch fractions[J]. European Journal of Clinical Nutrition,1992(46):33-50.
[21]Cheung O,Sanyal A J.Abnormalities of lipid metabolism in nonalcoholic fatty liver disease[J]. Seminars in Liver Disease,2008,28(4):351-359.
[22]Stuart S,Andrzej W,Anil K J.Structural and functional organization of the animal fatty acid synthase[J]. Progress in Lipid Research,2003,42(4):289-317.
[23]Roncari D A.Abnormalities of adipose cells in massive obesity[J]. International Journal of Obesity,1990,14(3):187-192.
