T2WI机器学习在鉴别高级别胶质瘤和脑单发转移瘤中的应用
2019-09-10刘小彤尹畅畅卞益同钱步月
刘 哲,刘小彤,尹畅畅,梁 挺,卞益同,王 斐,钱步月,杨 健
(西安交通大学:1. 生命科学与技术学院,陕西西安 710049;2. 第一附属医院放射科,陕西西安 710061;3. 电子与信息工程学院,陕西西安 710049)
高级别胶质瘤和脑单发转移瘤的术前诊断将直接影响其治疗决策、手术计划和临床分期[1],但相似的影像学表现给二者的鉴别带来了极大的困难[2]。目前,区分高级别胶质瘤和脑单发转移瘤的方法多为功能磁共振对瘤周水肿进行半定量分析,但其对强化瘤体的分析有一定局限性[3],并且其设备依赖性强,缺乏统一的诊断标准而无法广泛普及[4]。T2WI序列作为常规磁共振的序列之一,可以清晰地显示病灶水肿范围,并且有文献报道,基于T2WI的半定量分析[2]有助于高级别胶质瘤和脑单发转移瘤的鉴别,但此方法容易受医师主观因素的影响,且半定量分析参数单一,提供的诊断价值有限,因此结果差异较大。机器学习作为一种强大的人工智能算法,可以通过众多图像特征提练出疾病的分类模型,提供更多医师肉眼无法观察到的信息,在疾病诊断中具有一定优势[5-7]。因此,本研究拟探讨基于T2WI图像特征机器学习算法在鉴别高级别胶质瘤和脑单发转移瘤中的价值。
1 材料与方法
1.1 临床资料回顾性收集我院2016年1月至2018年11月颅内高级别胶质瘤和脑单发转移瘤患者。纳入标准:①通过手术病理证实的高级别胶质瘤,以及通过手术或有明确原发病史且随访证实的脑单发转移瘤;②术前在我院行常规MRI检查,包括轴位T2WI序列;③T2WI图像无明显伪影。排除标准:①未经病理证实且颅外无明确原发病史的颅内单发占位;②T2WI图像有严重伪影。
最终纳入高级别胶质瘤中World Health Organization(WHO)Ⅲ级患者21例,WHO Ⅳ级20例,男/女为21/20,平均年龄(48.9±12.2)岁;脑单发转移瘤包括肺癌脑转移17例,肺外恶性肿瘤脑单发转移17例,男/女为23/11,平均年龄(59.8±12.7)岁。两组间性别无统计学差异(P=0.11),脑转移瘤组患者年龄明显高于高级别胶质瘤患者,具有统计学差异(P<0.01,表1)。
表1 患者人口统计学资料
Tab.1 Basic demographic information of the patients

特征总数(n=75)胶质瘤(n=41)转移瘤(n=34)P性别---P=0.11男(n)442123-女(n)312011-年龄(岁)53.8±13.548.9±12.259.8±12.7P<0.01∗病理(n)-间变型星形细胞瘤WHO Ⅲ(15)少突胶质细胞瘤WHO Ⅲ(6)胶质母细胞瘤WHOⅣ(20)肺癌(17),乳腺癌(4),肾癌(3),直肠癌(2),前列腺癌(2),副鼻窦癌(1),多发性骨髓瘤(1),骨肉瘤(1),卵巢癌(1),膀胱癌(1),食管癌(1)-
*P<0.05为差异有统计学意义。
1.2 检查方法所有T2WI图像均由本院磁共振设备采集,具体设备及参数:飞利浦1.5T,头颅8通道线圈,扫描参数:TR 2 403 ms,TE 110 ms;层厚6 mm,层间距1 mm,矩阵256×194;GE1.5T(Optima),头颅8通道线圈,扫描参数:TR 5 460 ms,TE 132 ms,层厚5 mm,层间距1.5 mm,矩阵320×320;GE3.0T(HDxt),头颅8通道线圈,扫描参数:TR 4 680 ms,TE 105 ms,层厚5 mm,层间距1.5 mm,矩阵384×384;GE 3.0T(750 w),头颅16通道线圈,扫描参数:TR 4 848 ms,TE 115 ms,层厚5 mm,层间距1.5 mm,矩阵416×416。
1.3 机器学习模型构建
1.3.1图像分割和特征提取 图像分割前,首先采用Python software 3.7(docs.python.org)对所有图像进行灰度归一化,将矩阵统一转换为256×256,灰度范围转换为0~255,从而确保所有图像基本信息的一致性,最大限度地减少不同扫描设备及参数引起的差异[8]。随后使用ITK-SNAP 3.6.0软件(www.itk-snap.org)手动进行肿瘤分割。由1名具有5年临床经验的放射科住院医师在病理结果不知情的情况下对病灶每层最大水肿范围进行感兴趣区(region of interest, ROI)勾画(图1),最上层和最下层除外。最后对每层分割出来的ROI病灶进行纹理和形态学特征提取,具体参数详见表2。
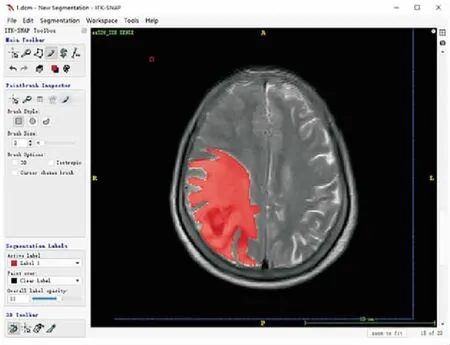
图1 ITK-SNAP对水肿范围进行图像分割
Fig.1 ITK-SNAP performs image segmentation on edema range
表2 机器学习图像特征参数
Tab.2 Machine learning image feature parameters
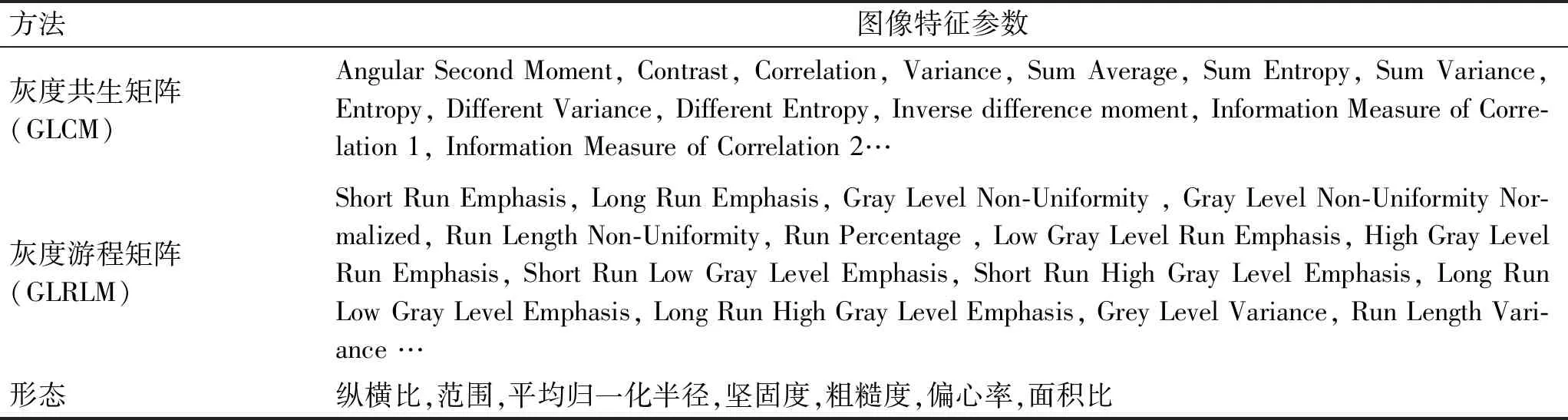
方法图像特征参数灰度共生矩阵(GLCM)Angular Second Moment, Contrast, Correlation, Variance, Sum Average, Sum Entropy, Sum Variance, Entropy, Different Variance, Different Entropy, Inverse difference moment, Information Measure of Corre-lation 1, Information Measure of Correlation 2…灰度游程矩阵(GLRLM)Short Run Emphasis, Long Run Emphasis, Gray Level Non-Uniformity , Gray Level Non-Uniformity Nor-malized, Run Length Non-Uniformity, Run Percentage , Low Gray Level Run Emphasis, High Gray Level Run Emphasis, Short Run Low Gray Level Emphasis, Short Run High Gray Level Emphasis, Long Run Low Gray Level Emphasis, Long Run High Gray Level Emphasis, Grey Level Variance, Run Length Vari-ance …形态纵横比,范围,平均归一化半径,坚固度,粗糙度,偏心率,面积比
GLMC: Grey Level Co-occurrence Matrix. GLRLM: Gray level run length matrix。
1.3.2机器学习模型训练及验证 为了获得更准确的模型,我们以每层ROI获取的特征集作为一个样本,从而增加机器学习的数据,进一步优化模型的稳定性。随后将所有数据分为训练集和测试集两组,按照70%和30%的比例进行随机分配,用训练集数据分别对支持向量机(support vector machine, SVM)、朴素贝叶斯和Logistic回归3种机器学习算法进行训练,将训练好的模型用测试集数据进行验证,最终结果以曲线下面积(area under the curve, AUC)、敏感性和特异度进行表示,Z检验用来比较不同机器模型间AUC的差异。
1.4 半定量分析有文献报道,基于T2WI计算瘤周水肿区/对侧正常脑组织信号比(nSI)半定量分析有助于鉴别高级别胶质瘤和脑单发转移瘤,当nSI阈值为2.88时,AUC可达0.725[2]。因此,本文参照此方法通过计算nSI进行受试者工作特征曲线(receiver operating characteristic, ROC)分析,并与机器学习模型诊断效能进行比较。nSI信号比测定通过Image J 1.44(imagej.nih.gov/ij)软件在肿瘤水肿最大层面进行,ROI大小控制在75~80 mm2(图2)。每位患者均画两组ROI获得两个nSI值,取平均值作为定量分析参数。这些测量和计算均由2位具有3年以上临床经验的放射科医师独立完成。最终取2位观察者的平均nSI值进行ROC分析并评估其最佳阈值。
1.5 统计学分析计量资料用均数±标准差表示,使用单样本Kolmogorov-Smirnov检验确定数据是否处于正态分布,组间比较采用t检验或wilcox符号秩和检验;计数资料用率表示,组间比较采用卡方检验。ROC分析来计算机器学习模型和半定量方法的诊断效能,以AUC值、敏感性和特异度进行表示。Z检验用于评价不同模型间的诊断效能差异,P<0.05为差异有统计学意义。以上统计处理均由R 3.51(www.r-project.org)和MedCalc13.0 (www.medcalc.org)软件完成,其中机器学习应用R软件的e1071、caret和pROC程序包完成。
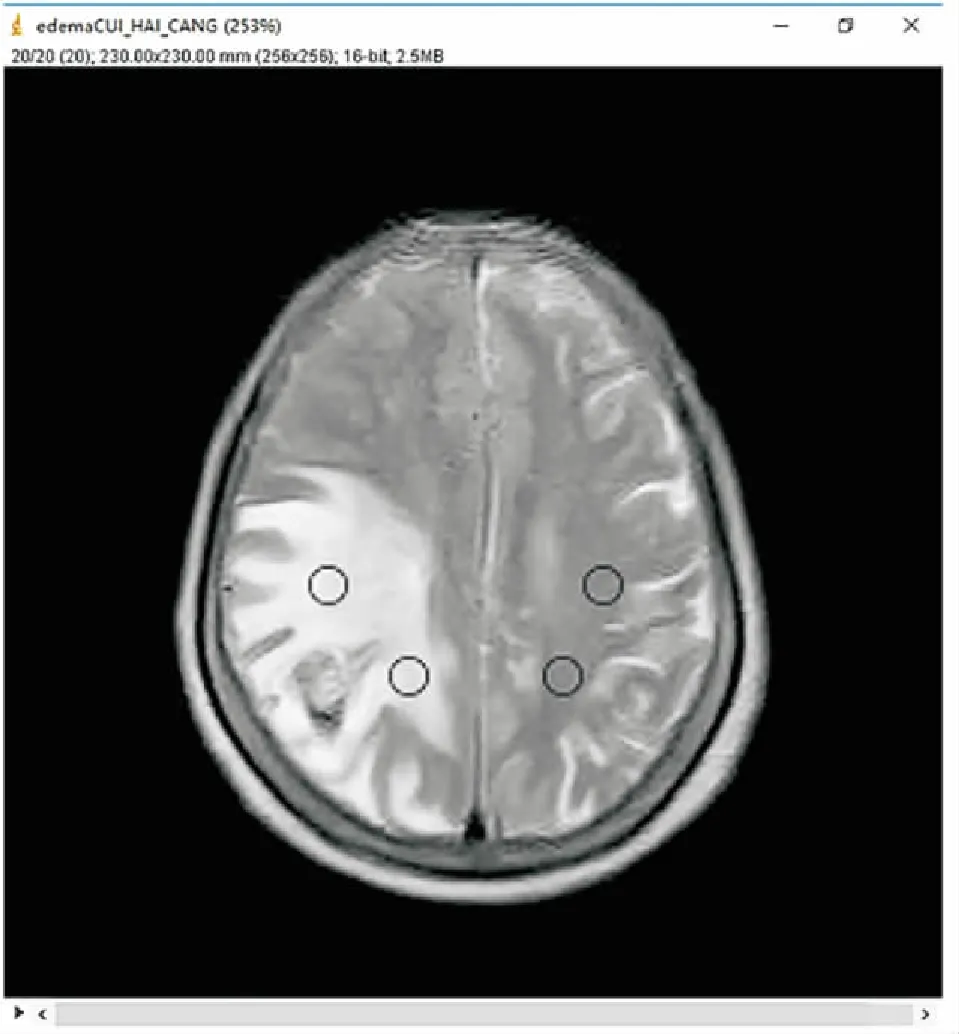
图2 Image J软件对水肿区和对侧正常脑组织ROI勾画
Fig.2 The Image J software outlines the ROI of the edema area and the contralateral normal brain tissue
2 结 果
2.1 图像特征的单因素分析本研究通过T2WI图像共获取高级别胶质瘤370组数据和脑单发转移瘤277组数据,每组数据均包含灰度共生矩阵、灰度游程矩阵和形态学等共68个特征(表2)。通过单因素分析最终确定35个具有统计学差异的特征纳入模型建模(表3)。
2.2 机器学习模型诊断效能的评价3种机器学习模型具体ROC诊断效能AUC值、敏感性及特异度见表4。3种机器学习模型间AUC比较见表5与图3,其中训练集和测试集SVM模型AUC值均高于Logistic和朴素贝叶斯模型,且具有统计学差异。Logistic回归和朴素贝叶斯模型AUC值无统计学差异。
2.3 半定量分析半定量分析中2名医师的测量指标无明显统计学差异(表6)。ROC分析结果显示,nSI阈值为2.78时对高级别胶质瘤和脑单发转移瘤鉴别有最高效能,其AUC值为0.58(95% confidence interval,CI:0.44~0.70),敏感性和特异度分别为39.02%(95%CI:24.2%~55.5%)和88.24%(95%CI:72.5%~96.7%)。半定量分析AUC值明显低于3种机器学习模型,具有统计学差异(表5)。
表3 图像特征的单因素分析结果
Tab.3 Univariate analysis results of image features

图像特征参量转移瘤胶质瘤PFirst order Energy-0.03±1.040.14±1.030.03Shape Sphericity0.08±1.12-0.11±0.970.03Shape Minor Axis-0.10±0.950.18±1.06<0.01Shape Elongation-0.22±1.000.11±0.98<0.01Shape Surface Volume Ratio0.19±1.14-0.09±0.96<0.01Shape Volume-0.03±1.040.14±1.030.03Shape Maximum 2D Diameter Column-0.10±0.920.22±1.07<0.01Short Run Low Gray Level Emphasis0.14±1.010.01±1.050.04Long Run Emphasis-0.14±0.950.13±1.06<0.01Short Run Emphasis0.14±1.010.01±1.050.04Long Run High Gray Level Emphasis-0.14±0.950.13±1.06<0.01Run Percentage0.19±1.13-0.09±0.97<0.01Long Run Low Gray Level Emphasis-0.14±0.950.13±1.06<0.01Run Entropy-0.07±1.090.13±0.960.03Dependence Non Uniformity-0.09±0.910.14±1.16<0.01Gray Level Non Uniformity-0.03±1.040.14±1.030.03Small Dependence Emphasis0.05±0.730.01±1.30<0.01Small Dependence High Gray Level Emphasis0.05±0.730.01±1.3<0.01图像特征参量转移瘤胶质瘤PDependence Non Uniformity Normalized-0.09±0.920.12±1.120.02Large Dependence Emphasis-0.16±1.070.12±0.98<0.01Small Dependence Low Gray Level Emphasis0.05±0.730.01±1.3<0.01Large Area Emphasis0.00±1.050.11±1.070.03Zone Percentage0.10±1.06-0.05±1.090.04Large Area Low Gray Level Emphasis0.00±1.050.11±1.070.03Aspect ratio-0.04±1.170.05±0.90<0.01Solidity-0.12±0.97-0.03±1.080.02Mean val0.33±1.13-0.23±0.9<0.01Eccentricity-0.28±1.070.04±1.01<0.01Angular second moment0.03±1.04-0.14±1.020.03Contrast0.39±1.37-0.17±0.66<0.01Sum variance0.31±1.34-0.13±0.75<0.01Sum entropy-0.02±1.060.13±1.010.04Entropy-0.01±1.060.13±1.010.04Difference variance-0.13±1.090.07±0.97<0.01Info measure of correlation 2-0.07±1.070.13±0.980.02
表4 机器学习ROC分析结果
Tab.4 ROC analysis of machine learning methods

方法训练集(n=423)AUC敏感性特异度测试集(n=224)AUC敏感性特异度SVM0.79(0.75~0.83)70.88%(65.0%~76.3%)77.13%(70.5%~82.9%)0.71(0.64~0.77)66.06%(56.4%~74.9%)70.79%(60.2%~80.0%)Logistic回归0.77(0.73~0.81)73.18%(67.4%~78.5%)71.81%(64.8%~78.1%)0.67(0.60~0.73)54.13%(44.3%~63.7%)74.16%(63.8%~82.9%)朴素贝叶斯0.72(0.67~0.76)75.10%(69.4%~80.2%)60.64%(53.3%~67.7%)0.62(0.55~0.69)63.30%(53.5%~72.3%)55.06%(44.1%~65.6%)
()内表示95% confidence interval(CI);ROC: receiver operating characteristic;SVM: support vector machine。
表5 机器学习与半定量分析AUC比较
Tab.5 AUC comparison of machine learning and semiquantification methods

方法SVMLogistic回归朴素贝叶斯nSI半定量SVM-Z=1.96,P=0.04Z=2.52,P=0.01Z=3.15,P<0.01Logistic回归Z=1.96,P=0.04-Z=1.68,P=0.09Z=2.92,P<0.01朴素贝叶斯Z=2.52,P=0.01Z=1.68,P=0.09-Z=2.09,P=0.04nSI半定量Z=3.15,P<0.01Z=2.92,P<0.01Z=2.09,P=0.04-
AUC: area under the curve; SVM: support vector machine。

图3 机器学习训练集(A)和测试集(B)ROC分析
Fig.3 ROC analysis of machine learning training set (A) and test set (B)
表6 不同医师测量nSI数据的比较
Tab.6 Comparison of nSI data measured by different doctors
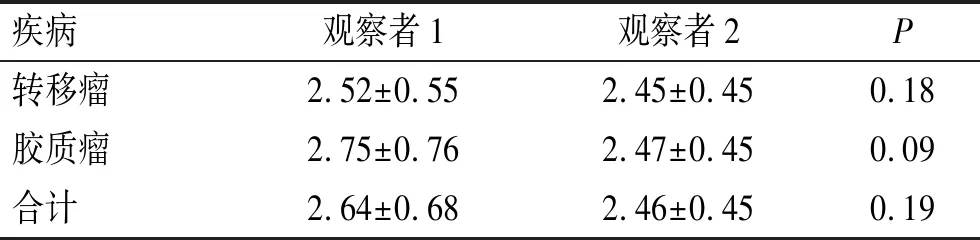
疾病观察者1观察者2P转移瘤2.52±0.552.45±0.450.18胶质瘤2.75±0.762.47±0.450.09合计2.64±0.682.46±0.450.19
3 讨 论
机器学习是人工智能的核心,可以模拟或实现人类的学习行为,获取新的知识或技能并重新构建模型,使之不断改善自身的性能,目前已应用于诸多领域[5]。在本研究中,我们试图研究基于T2WI图像特征的机器学习在鉴别高级别胶质瘤和脑单发转移瘤中的价值,研究结果发现,SVM、朴素贝叶斯和Logistic回归3种机器学习模型诊断效能均高于临床医师半定量分析结果;同时,相比其他两种机器学习算法,SVM具有一定的优势。
众所周知,高级别胶质瘤病灶周围水肿是因为血管源性水肿和瘤周浸润共同形成,而脑单发转移瘤是由于血管源性水肿引起[2],二者疾病在影像学上的表现具有一定差异,但临床医师肉眼分辨较为困难。相反,图像纹理等特征可以提供更高维度的定量数据及信息,已被证明应用于疾病诊断、预后和治疗决策等具有一定的临床价值[9]。因此,本文对众多图像特征进行了单因素分析,最终发现形态学、灰度相关的特征在鉴别高级别胶质瘤和脑单发转移瘤中具有重要意义,这与先前文献报道一致[6-7,10],证明图像纹理和形态学等特征可以在影像图像上观测出不同疾病的细小差异,为疾病鉴别诊断提供了更多帮助。最终我们将筛选出来的特征进行机器学习模型构建,进一步观察不同机器学习方法对高级别胶质瘤和脑单发转移瘤的鉴别能力。
通过机器学习训练和测试,我们发现3种机器学习模型中基于SVM的诊断效能最高,这是因为SVM的优势是生成非线性决策边界,使用线性分类器设计的方法,利用目标函数与数据集之间的关系,实现数据依赖结构风险最小化,而不依赖于数据集的维度,同时可以容忍数据集中的噪声和模糊值[11]。因此,可以在T2WI纹理和形态学特征中训练出较稳定的模型。相比SVM,Logistic回归和朴素贝叶斯训练的模型诊断效能较低,这是因为Logistic回归是一种广义线性回归模型,它与线性回归模型的形式基本相同。可以通过训练获得模型的逻辑概率,但Logistic回归不能处理多重共线性的问题,同时对连续变量异常值比较敏感,因此其结果容易受数据质量的影响[12]。朴素贝叶斯在分类中虽然使用的是零损失函数,可以将错误定义为错误预测的数量,不会惩罚不准确的概率估计,只将最大概率分配给正确的类,但其潜在条件是属性之间的独立性假设,这在复杂的医学数据集中较难实现[13],从而影响结果。因此,SVM算法在高级别胶质瘤和脑单发转移瘤的鉴别中具有一定的优势。本结果和TSOLAKI[13]的报道一致。但由于其属于黑箱算法,可解释性较差,因此在临床应用中仍有一定的局限性。鉴于Logistic回归方法的可解释性强,在疾病诊断和因素分析中仍具有重要价值。
本研究还对数据进行了医师半定量ROC分析,最终nSI阈值为2.78时具有最大鉴别能力,与之前文献报道的2.88基本一致[2],但诊断效能明显低于以往文献的报道[2]。其原因可能有以下两点:①瘤周水肿区ROI选择位置影响其诊断结果。有文献报道,ROI越接近瘤体,其结果越有利于鉴别两种疾病[2],而我们在基于T2WI勾画ROI时对其选择只能尽量靠近瘤体,医师主观的判断会影响结果的准确性。②本组病理纳入了WHOⅢ、Ⅳ两级胶质瘤,而之前的报道仅包含胶质母细胞瘤[2],可能是WHOⅢ级胶质瘤的纳入影响了结果,但这需要更多数据进行验证。最后,本研究还将医师半定量分析结果与机器学习方法进行了对比,发现医师半定量方法的诊断效能明显低于3种机器学习方法,这进一步证明T2WI图像特征机器学习在鉴别高级别胶质瘤和单发转移瘤中具有一定优势,当然仍需要大样本来进一步提高其诊断效能,为临床术前诊断提供帮助。
本研究除了回顾性分析的局限性外,还有以下4点局限性:①本研究没有加入T1WI和增强图像进行分析,毕竟T1WI、T2WI和增强检查是颅内疑似肿瘤患者首选的检查方案[14],T2WI联合增强图像机器学习或许能进一步提高模型的诊断效能,我们将进一步研究。②本研究所获得的图像来自本院不同的磁共振设备,可能会引起结果偏倚,但是本文在图像处理前对所有图像进行了灰度和矩阵的归一化,从而降低了因设备不同而引起的差异[8]。③本研究纳入的样本量较少,其机器学习模型可能不是最优模型,但是本文对T2WI全瘤逐层进行了分析,病变层数的增加或许可以提高模型的诊断效能。当然,我们仍需要更多的数据对模型进行不断训练,从而不断提高其分类的准确性。④本研究仅讨论了3种机器学习算法,下一步我们将探索更多的机器学习算法,以期进一步提高机器学习对颅内高级别胶质瘤和脑单发转移瘤的鉴别能力。
综上所述,T2WI水肿图像特征机器学习模型在术前鉴别高级别胶质瘤和脑单发转移瘤中具有一定优势,但也有局限性,仍需更多的研究证明其诊断价值并规范其临床应用,其中SVM模型更具潜力。
