程序性细胞死亡因子4基因在体干扰大鼠模型的构建
2019-09-10吕社民王慧渊杨旭东
钟 波,侯 伟,吕社民,王慧渊,耿 妍,杨旭东,薛 丽
(西安交通大学:1. 第二附属医院小儿内科,陕西西安 710004;2. 医学部基础医学院生物化学与分子生物学系,陕西西安 710061;3. 第二附属医院检验科,陕西西安 710004)
支气管哮喘(简称哮喘)是世界范围内一种常见的慢性呼吸道疾病,以气道重塑为突出的病理学特征[1]。整体而言,哮喘是一种环境因素与易感基因共同作用的疾病,所涉及的易感基因达到一百余种[2]。尽管在遗传学病因方面的研究已经取得了明显进展,但有关哮喘易感基因的筛选与鉴定仍需进一步研究[3],筛选哮喘相关差异表达基因对了解其发病机制具有突出意义。因此,我们之前的研究在E3大鼠体内使用鸡卵清蛋白(ovalbumin, OVA)促使产生抗原诱导肺部炎症(antigen induced pulmonary inflammation, AIPI)模型,通过抑制性消减杂交技术构建了大鼠肺组织差异表达的cDNA文库,筛选出1个上调表达的差异基因,名为程序性细胞死亡因子4(programmed cell death 4, Pdcd4),并确定其在E3大鼠AIPI模型中的表达水平升高[4]。为进一步了解该基因的功能,本研究建立了Pdcd4基因的在体干扰大鼠模型。
1 材料与方法
1.1 动物及试剂8~12周龄近交系E3大鼠32只,雌雄皆有,为西安交通大学医学部基础医学院生物化学与分子生物学系提供。OVA与铝佐剂购自Sigma公司,Trizol购自 Invitrogen公司,RevertAidTMFirst Strand cDNA Synthesis Kit购自Fermentas公司、SYBR®Premix ExTaqTMⅡ购自TaKaRa公司,ELISA试剂盒购自Cell Signaling Technology公司,Pdcd4 shRNA质粒购自上海吉玛基因技术有限公司(Pdcd4 shRNA序列GCGGAGATGTTAAGGGATTTG,NC-shRNA序列GTTCTCCGAACGTGTCACGT)。其他试剂均为国产分析纯。
1.2 动物模型构建8~12周龄的E3大鼠32只,按体质量随机分为4组,每组各8只。所有大鼠均在第0天腹腔注射OVA/铝佐剂的混悬液致敏;从第14天起,对照组大鼠用PBS双侧滴鼻,其余大鼠用1 mg/mL的OVA溶液双侧滴鼻攻击,共持续1周,构建AIPI模型;后分为3组,于第13天和第17天,各组分别鼻腔滴注50 μL(1 μg/μL)的Pdcd4 shRNA质粒溶液(Pdcd4干扰组)、50 μL NC-shRNA质粒溶液(无关质粒组)及50 μL医用注射用水(AIPI模型组)。
第21天时麻醉大鼠,经腹主动脉取血后,获取支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF),离心后分别留取上清和细胞沉淀,取部分细胞用于细胞计数,剩余细胞用于检测Pdcd4的mRNA表达;留取肺组织制作病理切片进行相关染色。本研究经过西安交通大学动物实验伦理委员会的批准。模型构建的具体流程如图1所示。

图1 大鼠在体干扰流程示意图
Fig.1 Schematic diagram of rat RNAiinvivo
1.3 组织化学染色常规制作肺组织HE染色切片,显微镜下观察气道周围炎性细胞的浸润情况。将炎性细胞浸润情况分为4个等级:0级,无炎性细胞浸润;1级,气道周围有一层炎性细胞;2级,气道周围有两层炎性细胞浸润;3级,气道周围有两层以上炎性细胞浸润。将切片上的每一个气道计分,并把所有气道的分值相加求平均值,以代表气道炎症的整体情况。
计数板上滴加20 μL BALF细胞悬液,显微镜下常规观察并计BALF中总的细胞数。Wright-Giemsa染液处理BALF细胞,显微镜下计数,每一张玻片上连续观察200个细胞,分别记录淋巴细胞、嗜酸性粒细胞和巨噬细胞等的数目。
1.4 RT-qPCR检测Pdcd4基因mRNA表达常规用Trizol提取BALF细胞中总RNA,按照RevertAidTMFirst Strand cDNA Synthesis Kit说明书操作,反转录生成cDNA。RT-qPCR检测Pdcd4在体RNA干扰的效率,反应体系:20倍稀释的cDNA 4 μL、SYBR®Premix ExTaqTMⅡ 4 μL、Pdcd4上下游引物各0.5 μL,混匀、瞬时离心。反应条件:95 ℃ 1 min;40个循环,95 ℃ 10 s,62 ℃ 30 s,72 ℃ 30 s。GAPDH为内参,各引物信息见表1。计算并比较基因相对表达水平。
表1 基因引物信息
Tab.1 Information of gene primers
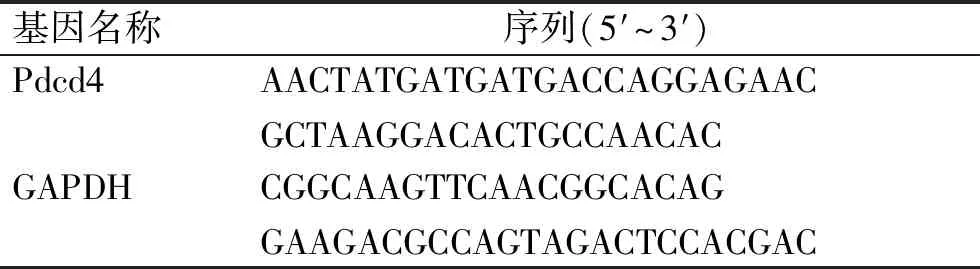
基因名称序列(5′~3′)Pdcd4AACTATGATGATGACCAGGAGAACGCTAAGGACACTGCCAACACGAPDHCGGCAAGTTCAACGGCACAGGAAGACGCCAGTAGACTCCACGAC
1.5 常规ELISA检测大鼠血清中的OVA特异性IgG将5 μg/mL的OVA溶液加入96孔板,4 ℃过夜。洗脱缓冲液进行洗脱后,每孔加入100 μL封闭液,37 ℃孵育1 h。洗脱缓冲液洗板3次。用1×PBS将血清稀释100倍,每孔加入50 μL血清样品,37 ℃孵育1 h。洗脱后用封闭液将1 μg/μL马辣根过氧化物酶标记的小鼠抗大鼠λ/κ链抗体稀释3 000倍,取50 μL加入各孔,37 ℃孵育1 h。洗脱后加入显色剂TMB 100 μL,室温避光孵育20 min。加入100 μL终止液,室温避光10 min内全波长酶标仪450 nm波长下读取吸光度(A)值。
同样用ELISA法检测大鼠血清中的总IgE,包被抗体为50 μL 2 μg/mL的小鼠抗大鼠IgE重链抗体,用1×PBS将血清稀释1 000倍,其余步骤同OVA特异性IgG检测。
1.6 血清一氧化氮的测定在镉粒中加入5 mmol/L CuSO4使镉粒活化,0.2 mol/L的甘氨酸缓冲液(pH 7.5)洗涤3次。在100 μL BALF上清中加入400 mg铬粒,37 ℃下震荡30 min,瞬时离心后吸取上清100 μL,加入等量Griess试剂,震荡混匀,室温孵育1 h,545 nm波长下测定A值。将100、50、25、12.5、6.25 μmol/L的NaNO2各吸取100 μL,加入等量Griess试剂混匀,室温孵育1 h,545 nm波长下测定A值,拟合出标准曲线。根据标准曲线方程计算出待测样品中一氧化氮的含量。
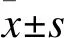
2 结 果
2.1 肺组织切片的HE染色与病理学计数结果与对照组相比,AIPI模型组、无关质粒组及Pdcd4干扰组大鼠的HE染色显示,肺组织切片中可见支气管周围及肺泡中有大量炎症细胞浸润。对支气管周围渗出的细胞进行统计学分析发现,后3组的病理学计数值均较对照组明显升高(图2),表明成功诱导肺部炎症模型。但是,Pdcd4干扰组与无关质粒组的病理学计数没有差异,提示Pdcd4的在体干扰对于肺组织炎症渗出没有明显影响。
2.2 BALF细胞中Pdcd4的mRNA表达变化RT-qPCR检测结果显示,Pdcd4 shRNA干扰组大鼠BALF细胞中Pdcd4的mRNA表达明显下调(图3),提示大鼠Pdcd4基因干扰模型的构建是成功的。
图2 AIPI大鼠肺组织的病理学改变
Fig.2 Pathological changes of AIPI rat lung tissues

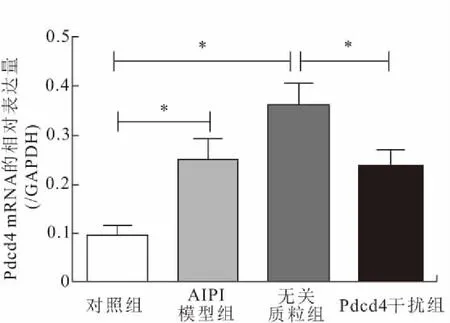
图3 各组大鼠BALF细胞中Pdcd4 mRNA的表达变化
Fig.3 Pdcd4 mRNA expression of BALF cells of rats in groups
2.3 BALF细胞计数结果分别计数各组BALF中总细胞、淋巴细胞、巨噬细胞及嗜酸性粒细胞数,结果显示,Pdcd4干扰组与无关质粒组的嗜酸性粒细胞数有明显差异,表明Pdcd4干扰可以减少肺泡嗜酸性粒细胞的浸润。但两组的总细胞、淋巴细胞、巨噬细胞等计数没有明显差异(图4)。
2.4 血清中一氧化氮、总IgE、OVA特异性IgG的检测结果Pdcd4在体干扰后,大鼠血清一氧化氮、总IgE、OVA特异性IgG等指标均没有明显变化(图5)。
3 讨 论
RNA干扰是一种由小分子双链RNA引起的转录后基因沉默现象,作用于转录水平、转录后水平和翻译水平,抑制目的基因的表达[5]。RNA干扰技术现已在基础研究领域广泛应用[6]。本研究通过将Pdcd4的干扰质粒滴入AIPI大鼠鼻腔,下调大鼠体内Pdcd4的表达,构建了大鼠Pdcd4基因的在体干扰模型,为进一步研究该基因的功能奠定了基础。
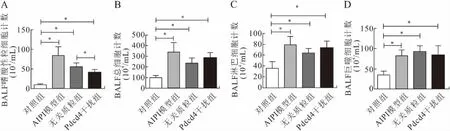
图4 各组大鼠BALF细胞计数的结果分析
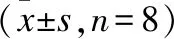
*P<0.05。

图5 血清一氧化氮(A)、总IgE(B)、OVA特异性IgG(C)的检测结果
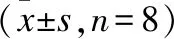
*P<0.05。
大鼠Pdcd4基因定位于1号染色体,小鼠定位于19号染色体,人类染色体定位于10号染色体,DNA全长为26.9 kb,含13个外显子,cDNA全长约3.5 kb,其中编码区约1.4 kb,其蛋白质分子质量51.6 ku,共含469个氨基酸[6-7]。该基因最初是在凋亡发生时筛选出的上调基因,其表达产物通过抑制相关基因的转录和翻译,调节不同的信号转导途径,作用于细胞周期,从而对细胞的程序性死亡发挥重要调节作用,抑制肿瘤生成[8-9]。
近年来发现Pdcd4也参与了炎症的发生发展过程。ASUDA等[10]发现LPS抑制小鼠巨噬细胞系RAW264.7细胞中Pdcd4 mRNA与蛋白质的表达。同时,研究表明Pdcd4不仅受炎症因子的调节,同时其本身也可以调节炎症因子的产生。通过siRNA技术下调RAW264.7细胞中Pdcd的表达,可以明显加强LPS诱导的TNF-α蛋白的产生,提高IFN-γ、CCL1、CCL20和IL-10等分子在mRNA的表达,表明Pdcd4可以抑制以上这些炎性介质的产生。有研究发现,Pdcd4基因敲除小鼠的淋巴细胞可以产生促进肿瘤生长,但可抑制炎症反应的因子,导致小鼠淋巴瘤发病率明显升高,但对炎症性疾病如自身免疫性脑脊髓炎和糖尿病则出现明显的抵抗[11]。
有文献报道,Pdcd基因启动子的多态性与儿童哮喘的严重程度存在相关性[12],进一步表明深入了解Pdcd4对于哮喘发病机制的研究意义。哮喘气道炎症的关键效应细胞之一为嗜酸性粒细胞,该细胞可以合成并分泌碱基蛋白、嗜酸性粒细胞过氧化酶等物质,对气道上皮组织和肺组织产生损伤,进而使机体表现出气道高反应性;另外,嗜酸性粒细胞可以影响哮喘气道神经的反应性,从而使该细胞在哮喘气道炎症反应中发挥重要作用[13]。本研究结果表明,Pdcd4的在体干扰可以减少AIPI大鼠肺泡嗜酸性粒细胞的浸润,提示Pdcd4可能通过这一途径影响哮喘的发生和发展,但其进一步可能产生的效应及具体的机制需要后续进行深入研究。
