不同种类细菌所致早产儿院内感染败血症的临床特点
2019-09-10方广东陈长春余仁强姜善雨
方广东,陈长春,周 勤,余仁强,姜善雨,周 洲
(南京医科大学附属无锡妇幼保健院新生儿科,江苏无锡 214002)
新生儿院内感染败血症是导致新生儿死亡的主要原因之一,其发病率、病死率及遗留不良神经系统结局率均较高[1],尤其是免疫力低下的早产儿、极低出生体重儿发生的细菌感染败血症。如何及时有效地发现早产儿院内细菌感染败血症并针对性地应用抗生素是NICU医师面临的难题。本文回顾性分析2008年5月-2018年4月期间就诊于本院的99例确诊为早产儿院内细菌感染败血症的临床特点、病原菌及药敏结果等情况,探讨不同临床表现及实验室检查结果所对应的早产儿院内细菌感染败血症的可能病原菌,为临床合理应用抗生素提供理论依据。
1 对象与方法
1.1 研究对象选取2008年5月-2018年4月首次入住我院新生儿科的99例确诊为院内细菌感染败血症的早产儿作为研究对象。早产儿确诊败血症诊断标准参照《实用新生儿学》[2]:血培养检出明确病原菌并具有腹胀、呼吸困难、发热、反应差等临床表现。早产儿在入院48 h后发生的或在院内出生时获得的无明确潜伏期细菌的感染,认定为院内感染[3]。去除1例为革兰氏阳性菌和革兰氏阴性菌混合感染的败血症早产儿,剩余98例早产儿根据革兰阴性菌感染和革兰阳性菌感染分为2组。
1.2 方法
1.2.1临床资料收集 采用回顾性分析方法,通过调阅医院电子病历查询系统,收集两组早产儿的临床资料,包括性别、年龄、出生体质量、侵袭性操作(中心静脉置管)、实验室检查结果、临床表现、病原菌及药敏试验结果、并发症、预后等情况。

2 结 果
2.1 患儿一般临床情况99例患儿中,男55人,女44人,男女之比为1.25∶1;胎龄25+6~36+6周,平均(30.73±2.71)周;入院时间为5~60 min,平均(19.39±9.34)min;出生体质量610~2 470 g,平均(1 430.66±441.19)g,其中极低出生体质量儿(出生体质量<1 500 g)66例;留置经外周静脉中心静脉导管(peripherally inserted central catheter, PICC)27例。主要表现为呼吸困难(包括呼吸暂停)60例(60.1%),腹胀23例(23.2%),发热19例(19.2%);白细胞升高(>20×109/L)12例(12.1%);白细胞下降(<5×109/L)14例(14.1%),C反应蛋白(CRP)升高(>8 mg/L)65例(65.7%),血小板下降(<100×109/L)22例(22.2%)。治疗后血培养转阴87例(87.9%),好转后转院3例(3.0%),放弃治疗6例(6.1%),死亡3例(3.0%)。并发休克或(和)坏死性小肠结肠炎或(和)中枢感染23例(23.2%)、支气管肺发育不良15例(15.2%)。
2.2 患儿败血症的发生情况早产儿院内细菌感染败血症占同期住院早产儿的1.16%(99/8 512),其中前5年和后5年早产儿院内细菌感染败血症的发生率分别为0.74%(27/3 656)和1.48%(72/4 856)。发生败血症时间为入院后3~60 d(>48 h),平均(14.43±9.94)d。
2.3 患儿的病原菌及药物敏感试验99例患儿中,革兰氏阳性菌(G+)感染69例(69.7%),其中1例为2种革兰氏阳性菌混合感染;革兰氏阴性菌(G-)感染29例(29.3%),革兰氏阳性菌和革兰氏阴性菌混合感染1例(1.0%)。共培养出细菌101株。其中革兰氏阳性菌71株(70.3%):表皮葡萄球菌26株(36.6%,包括耐甲氧西林凝固酶阴性葡萄球菌20例、多重耐药菌1例),金黄色葡萄球菌16株(22.5%,包括耐甲氧西林葡萄球菌5例及耐青霉素酶葡萄球菌2例),溶血性葡萄球菌8株(11.3%,包括耐甲氧西林凝固酶阴性葡萄球菌4例),沃氏葡萄球菌4株(5.6%),华纳葡萄球菌5株(7.0%),屎肠球菌3例(占4.2%),头状葡萄球菌2例(2.8%),无乳链球菌2例(2.8%),粪肠球菌、孪生球菌属、藤黄微球菌、浅绿气球菌及人葡萄球菌人亚种各1株(1.4%);革兰氏阳性菌中凝固酶阴性葡萄球菌共46例(64.8%)。革兰氏阴性菌30株(29.7%),其中肺炎克雷伯菌12株(40.0%,包括产超广谱β-内酰胺酶菌8例),大肠埃希菌9株(30.0%,包括产超广谱β-内酰胺酶菌4例),阴沟肠杆菌7株(23.3%,包括多重耐药菌1例),鲍曼/溶血不动杆菌2株(6.7%)。26株表皮葡萄球菌对青霉素均耐药,对万古霉素及利奈唑胺均敏感(表1)。12株肺炎克雷伯菌对氨苄西林、哌拉西林均耐药,对亚胺培南、美罗培南均敏感。常见革兰氏阳性菌对常用抗菌药物的耐药率见表1,常见革兰氏阴性菌对常用抗菌药物的耐药率见表2。
2.4 革兰氏阴性菌组和革兰氏阳性菌组患儿临床表现及实验室结果比较革兰氏阴性菌组严重并发症、白细胞下降、CRP升高、腹胀、血小板下降的发生率明显高于革兰氏阳性菌组,差异具有统计学意义(P<0.05);革兰氏阴性菌组放弃或死亡率明显高于革兰氏阳性菌组,差异具有统计学意义(P<0.05,表3)。
表1 常见革兰氏阳性菌对常用抗菌药物的耐药率
Tab.1 Rate of common gram-positive bacteria’s resistance to commonly used antibiotics [n(%)]

药物表皮葡萄球菌(n=26)金黄色葡菌球菌(n=16)溶血性葡萄球菌(n=8)青霉素26(100.00)16(100.00)8(100.00)庆大霉素10(38.46)6(37.50)5(62.50)红霉素11(42.31)6(37.50)2(25.00)克林霉素8(30.77)1(6.25)0(0.00)利福平3(11.54)0(0.00)1(12.50)左氧氟沙星15(57.69)2(12.50)2(25.00)复方磺胺甲恶唑7(26.92)2(12.50)2(25.00)万古霉素0(0.00)0(0.00)0(0.00)利奈唑胺0(0.00)0(0.00)0(0.00)
表2 常见革兰氏阴性菌对常用抗菌药物的耐药率
Tab.2 Rate of common gram-negative bacteria’s resistance to commonly used antibiotics [n(%)]

药物肺炎克雷伯杆菌(n=12)大肠杆菌(n=9)氨苄西林12(100.00)9(100.00)哌拉西林12(100.00)9(100.00)头孢呋辛10(83.33)2(22.22)阿莫西林/棒酸1(8.33)3(33.33)哌拉西林他唑巴坦1(8.33)2(22.22)头孢唑林10(83.33)5(55.56)头孢呋辛10(83.33)2(22.22)头孢噻肟6(50.00)5(55.56)环丙沙星1(8.33)0(0.00)庆大霉素2(16.67)1(11.11)复方磺胺甲恶唑7(58.33)2(22.22)亚胺培南0(0.00)0(0.00)美罗培南0(0.00)0(0.00)
3 讨 论
早产是新生儿感染败血症的主要危险因素,早产儿发生感染的风险是足月新生儿的11倍[4]。早产儿败血症可导致远期神经系统后遗症,如学习障碍、认知障碍、脑性瘫痪、听力和视力下降。有研究报道,革兰氏阳性菌感染与认知、运动迟缓有关[4],合并感染性休克的新生儿败血症是新生儿死亡和致残的主要原因[4-5]。因此,关注早产儿败血症的发病率、病原菌种类、临床表现及实验室检查,并指导临床应用抗生素及预后判断,具有重要的实际意义。
3.1 革兰氏阴性菌和革兰氏阳性菌分布世界范围内新生儿败血症发生率呈上升趋势。国外早产儿败血症发病率为8.5%~42%[6],国内为1.5%~3.1%[7]。本研究显示,早产败血症发病率为1.16%,低于国内外的文献报道,考虑除与本科室严格防控医院感染有关外,与统计所包含的病原种类不同亦有关。对本院10年来早产儿败血症分阶段分析结果显示,前5年和后5年发病率分别为0.74%、1.48%,呈上升趋势,考虑与近年来收治极、超低出生体质量儿比例增加以及极低出生体质量儿的高存活率有关。本研究结果显示,革兰氏阳性菌主要为表皮葡萄球菌 (36.6%),革兰氏阴性菌主要为肺炎克雷伯杆菌(40.0%),这与钟巧等[8]和PRIETO等[9]研究结果一致。因此,临床需重视表皮葡萄球菌、肺炎克雷伯杆菌感染的防治。尽管有研究者认为表皮葡萄球菌是广泛存在于皮肤表面的机会菌,是血培养最常见的污染菌,且临床表现多较轻,不一定是真正的病原体,但我们仍应予以足够的重视,尤其是发生在皮肤完整性受到破坏的极低、超低出生体质量儿机体时[2]。本研究感染病原菌中革兰氏阳性菌占70.3%,革兰氏阴性菌占29.7%,这与张赟等[7]研究一致,而与李秋平等[10]研究结果不一致,可能与早产儿种类以及早产儿来源不同有关,仍需进行大样本、多中心临床随机对照研究进一步佐证。革兰氏阴性菌和革兰氏阳性菌分别对碳青霉烯类抗生素美罗培南和万古霉素100%敏感,在发生相应病原菌感染时可考虑应用,但因它们的应用易引起菌群失调及多重耐药菌株产生,且目前临床已出现对万古霉素和美罗培南耐药的菌株,临床上须严格控制其应用。
表3 革兰阴性菌组和革兰阳性菌组患儿临床表现及实验室结果的比较
Tab.3 Comparison of clinical and laboratory results between gram-negative and gram-positive bacteria groups
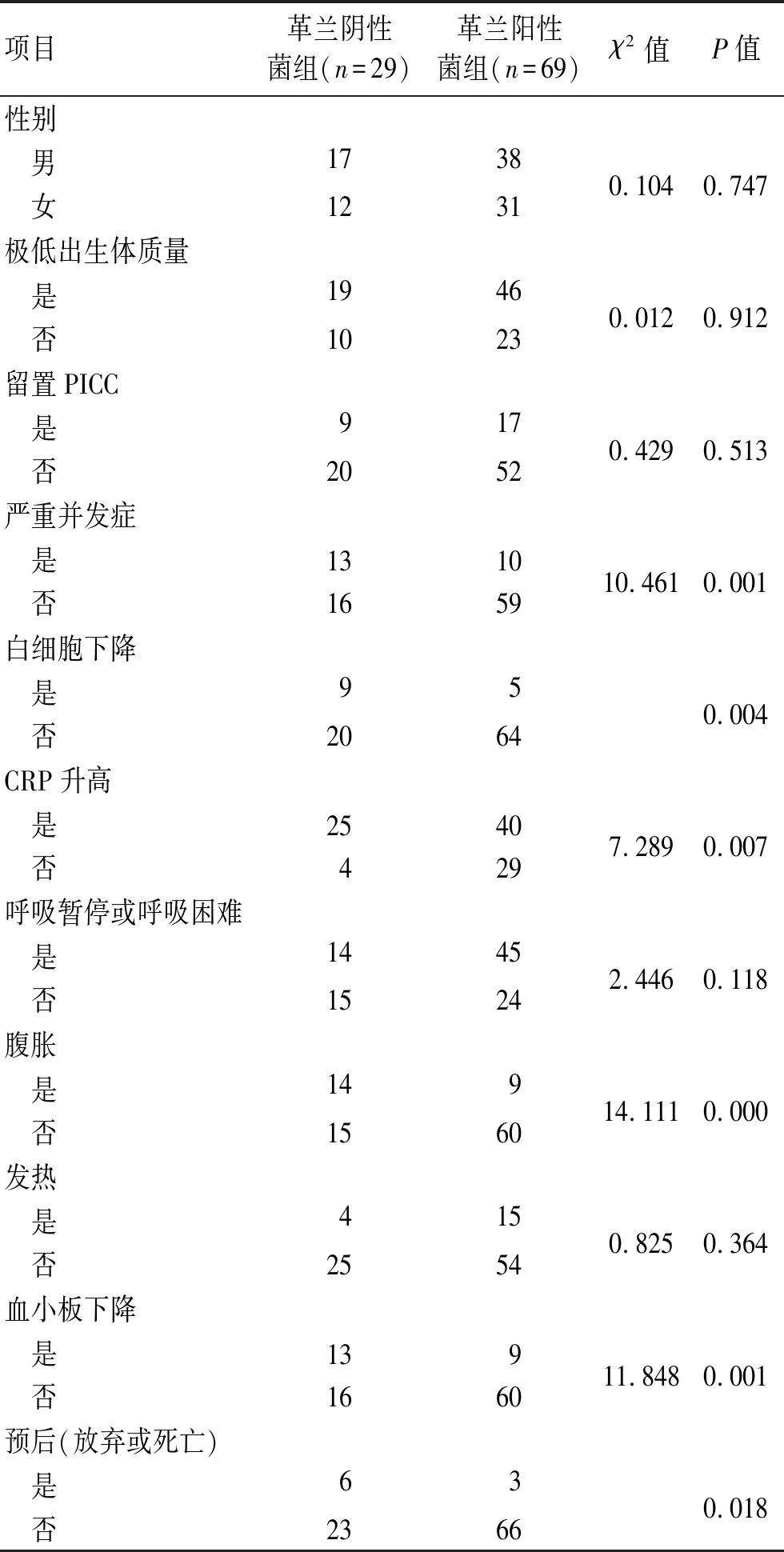
项目革兰阴性菌组(n=29)革兰阳性菌组(n=69)χ2值P值性别 男1738 女12310.1040.747极低出生体质量 是1946 否10230.0120.912留置PICC 是917 否20520.4290.513严重并发症 是1310 否165910.4610.001白细胞下降 是95 否20640.004CRP升高 是2540 否4297.2890.007呼吸暂停或呼吸困难 是1445 否15242.4460.118腹胀 是149 否156014.1110.000发热 是415 否25540.8250.364血小板下降 是139 否166011.8480.001预后(放弃或死亡) 是63 否23660.018
严重并发症包括休克、坏死性小肠结肠炎及中枢感染。
3.2 革兰氏阴性菌和革兰氏阳性菌实验室检查分析由于早产儿院内感染败血症的临床症状多不典型,且寻找病原学依据的血培养所需周期长,临床院内感染发生时仍以经验性应用抗生素为主,容易延误诊治及滥用抗生素。随着科学技术的发展,国内外研究者聚焦于病原体基因测序、炎症因子检测等快速检测手段,但仍处于实验研究阶段[9-11]。由于外周血白细胞受多种因素影响,故不能作为诊断新生儿败血症的单一指标;有文献报道,肠杆菌属更易引起血小板下降,所以血小板减少预测新生儿败血症存在一定价值;尽管CRP与新生儿败血症有一定相关性,但单独依靠检测CRP这一指标来诊断新生儿败血症是不可靠的[1]。本研究发现,革兰氏阴性菌和革兰氏阳性菌在白细胞、血小板、CRP方面存在一定差异,革兰氏阴性菌更易出现白细胞及血小板下降、CRP升高。因此,联合检测白细胞、血小降及CRP可作为判断病原菌种类的参考指标,为临床合理选用抗生素具有一定的参考价值。
3.3 革兰氏阴性菌和革兰氏阳性菌临床表现及预后分析早产儿院内细菌感染败血症革兰阳性菌中主要是表皮葡萄球菌,已证实其与支气管肺发育不良、脑白质损伤、坏死性小肠结肠炎和早产儿视网膜病变有关[12-14]。本研究显示,两组之间临床表现差异较大,革兰氏阴性菌组中休克、坏死性小肠结肠炎、中枢感染及腹胀的发生率明显高于革兰氏阳性菌组。因此,休克、坏死性小肠结肠炎、中枢感染及腹胀可作为判断病原菌种类的参考指标,但仍需大样本、多中心临床随机对照研究进一步证实。两组之间呼吸暂停或呼吸困难、发热的比较差异无统计学意义,而李秋平等[10]研究结果表明,革兰氏阴性杆菌组呼吸暂停的发生率要高于革兰氏阳性球菌组,出现此不一致结果的原因可能与样本及本研究纳入呼吸困难早产儿等因素有关。两组之间预后比较表明,革兰氏阴性菌组放弃或死亡率明显高于革兰氏阳性菌组,这与革兰氏阴性菌感染中毒症状重、耐药率高等因素有关[15-16]。
本研究回顾过去10年早产儿医院细菌感染败血症的临床资料,发现早产儿院内细菌感染败血症的主要病原菌为革兰氏阳性菌。革兰氏阴性菌感染更易发生休克、中枢感染、腹胀等并发症,实验室检验更多表现为白细胞及血小板下降、CRP升高。在临床考虑早产儿院内感染败血症时,可首先根据临床表现推测可能性大的病原菌,结合本地区或本科室的感染流行病学特点,选用针对性强的抗生素,在药敏试验结果出来后,可结合临床表现及药敏结果决定后续治疗方案,以增加抗生素应用的合理性。当然,由于其临床表现的非特异性,在治疗效果不理想时,要想到其他种类病原菌、特殊部位感染及混合感染等可能性,需要时及时调整用药。由于本研究样本量少且为单中心研究,因此,本研究成果只能为将来深入研究提供线索,确切结论仍需进行大样本、多中心临床随机对照研究进一步证实。
