MGBA抗原特异性CD8+CTL细胞与CIK细胞杀瘤活性的对比研究
2019-09-10崔慧霞史绪生姜又红张文陆
崔慧霞,李 妍,孟 迪,史绪生,张 佩,姜又红,张文陆
(1. 锦州医科大学护理学院,辽宁锦州 121001;2. 中国医科大学附属第一医院肿瘤研究所生物治疗室,辽宁沈阳 110001;3. 锦州医科大学附属第一医院放疗科,辽宁锦州 121001)
手术、放疗和化疗是肿瘤患者的3大治疗方式。近年来,随着医学科技的发展,生物治疗逐渐成为肿瘤治疗研究的热点,成为了继3大治疗后的第四大治疗方式[1]。其中,免疫细胞治疗是肿瘤生物治疗的最核心部分,抗原特异性的细胞毒性T淋巴细胞(cytotoxic T lymphocyte, CTL),尤其是CD8+CTL与细胞因子诱导的杀伤细胞(cytokine-induced killer, CIK)是免疫细胞治疗中最主要的肿瘤杀伤细胞,被广泛研究和应用[2]。而鲜有研究其对相同的靶细胞杀瘤效果的观察。乳腺珠蛋白A(mammaglobin-A, MGBA)是乳腺癌专一性过表达的一种蛋白[3],本研究用MGBA腺病毒转染人树突状细胞(dendritic cell, DC),再用DC细胞制备MGBA抗原特异性CD8+CTL与CIK细胞,比较对乳腺癌的杀瘤效果。
1 材料与方法
1.1 材料与试剂新鲜外周血来源于健康志愿者;乳腺癌细胞株MDA-MB-415和MDA-MB-231购自上海细胞库;淋巴细胞分离液购自天津灏洋生物技术有限公司;腺病毒Ad-null和Ad-MGBA为本室构建;细胞因子GM-CSF、TNF-α、IFN-γ、IL-1、IL-2、IL-4、CD3单抗等均购自厦门特宝公司;藻红蛋白(PE)标记的鼠抗人CD80、别藻青蛋白(APC)标记的鼠抗人CD83、异硫氰酸荧光素(FITC)标记的鼠抗人CD86、异硫氰酸荧光素(FITC)标记的鼠抗人CD8及相应的同型对照抗体均购自美国BD公司;人CD8+T细胞免疫磁珠分选试剂盒购自DYNAL公司;PE/7AAD凋亡试剂盒购自南京凯基生物科技有限公司。
1.2 DC细胞的体外培养和表型检测用密度梯度离心法提取健康志愿者外周血单个核细胞,用含胎牛血清的RPMI 1640培养液在37 ℃、50 mL/L CO2条件下静置培养2 h,移除非贴壁细胞(用于后续CIK细胞和CTL细胞的制备),贴壁细胞用含1 000 IU/mL GM-CSF和500 IU/mL IL-4的新鲜培养液培养,置于37 ℃,50 mL/L CO2培养箱中,每2~3 d换液并补充细胞因子。第5天,按MOI 200加入表达人MGBA的重组腺病毒Ad-MGBA,第6天加入TNF-α 1 000 IU/mL,第7天收获成熟DC细胞,用于后续研究。于培养的第1、5、7天用倒置相差显微镜观察DC细胞的形态变化,并分别加入CD80、CD83、CD86荧光抗体及对应的同型对照抗体,用流式细胞仪进行表型分析。
1.3 CIK细胞的制备制作DC细胞时的未贴壁细胞,部分用于CIK细胞制备,部分用于CTL细胞制备。制作CIK时,用含有终浓度为100 IU/mL IL-1、500 IU/mL IL-2、50 ng/mL CD3单克隆抗体培养,每3 d补充细胞因子。第7天收集转染DC细胞,以DC∶CIK=1∶10的比例进行共培养,至第14天收获。在CIK培养的第1、7、14天用CD56抗体、CD3抗体检测CIK的CD3+CD56+阳性的细胞比例。
1.4 CTL细胞的制备制作DC细胞时的部分未贴壁细胞,用含1 000 IU/mL IL-2的培养液培养,每3 d补充细胞因子,用于CTL细胞的培养。收集第7天成熟的DC细胞,添加终质量浓度为10 μg/mL的丝裂霉素于37 ℃ 30 min,再用RPMI 1640不全培养液洗3遍,制成刺激细胞。以DC∶CTL=1∶10的比例进行共培养,培养液为CTL液,至第14天收获。
1.5 MGBA抗原特异性CD8+CTL细胞的分选按磁珠分选试剂盒说明书进行分选。收集成熟的CTL细胞,加入抗人CD8抗体,孵育、洗涤、离心、重悬,再加磁珠,继续孵育,置磁力架提纯、洗脱、重选等程序后获得高纯度的CD8+CTL细胞。用CD8抗体检测分选前后CD8+CTL细胞的比例。
1.6 用流式细胞术分析CD8+CTL和CIK细胞对乳腺癌细胞的细胞毒活性将上述制备的CD8+CTL细胞和CIK细胞与乳腺癌细胞系即MDA-MB-415细胞和MDA-MB-231细胞按效靶比为20∶1的比例进行共培养12 h,然后用Annexin V-PE/7-AAD凋亡检测试剂盒进行免疫染色,对乳腺癌细胞画门后流式细胞仪检测凋亡。
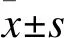
2 结 果
2.1 DC细胞的形态观察倒置相差显微镜观察培养的DC细胞:第1天,DC细胞体积较小,比较松散;第5天细胞呈现小集落样生长,细胞周围开始出现毛刺;加入腺病毒转染继续刺激DC细胞的进一步成熟,培养至第7天时,发现DC细胞呈现典型的毛刺样外观,大部分细胞悬浮生长,细胞体积进一步增大(图1)。
2.2 DC细胞的表型检测流式细胞术检测培养的DC细胞表面共刺激分子CD80、DC83、CD86的表达变化,可见随着时间的延长,表达均得到提高,第2、5、7天的表达差异均具有统计学意义(P<0.05,图2、表1),提示DC细胞的成熟。
2.3 激活的CIK细胞表型检测CIK是一群异质细胞,其中CD3+CD56+阳性的细胞是其典型的杀伤细胞。流式细胞术检测结果显示,CD3+CD56+阳性细胞比例随着培养时间延长逐渐增高(分别为3.47±1.38、20.19±4.45、40.74±10.63),且在第1、7、14天的差异均具有统计学意义(F=8.554,P=0.014,图3),显示CIK的杀伤活性逐渐增强。

图1 相差显微镜观察不同培养阶段的DC细胞形态特点
Fig.1 Morphological characteristics of DCs on different days under the phase-contrast microscope (×400)

图2 流式细胞仪检测各时间点DC细胞的表型变化
Fig.2 Surface protein expression of DCs on different days
表1 各时间点DC细胞表型变化的比较
Tab.1 Comparison of surface protein expression of DCs on different days

(n=8)
2.4 分选前后CD8+CTL细胞的检测CTL为抗原特异性细胞毒性杀伤细胞,其中CD8+CTL是主要的杀伤细胞,用流式细胞术检测分选前后CD8+CTL的比例,分选前CD8+CTL细胞比例仅占17.51%,而用免疫磁珠分选后则高达99.73%(图4),提示分选后的纯度很高,分选成功。
2.5 抗原特异性CD8+CTL和CIK细胞对乳腺癌细胞的细胞毒活性凋亡流式试剂盒检测结果显示,CD8+CTL和CIK对表达 MGBA抗原的乳腺癌MDA-MB-415细胞杀伤率分别是63.07%和48.35%;对不表达MGBA抗原的乳腺癌MDA-MB-231细胞的杀伤率是14.62%和29.29%,差异均有统计学意义(P<0.05,表2、图5)。

图3 不同时间CD3+CD56+CIK细胞比例的检测结果
Fig.3 The percentage of CD3+CD56+CIKs on different days

图4 分选前后CD8+CTLs细胞的检测结果
Fig.4 Percentage of CD8+CTLs before and after purification
表2 MGBA抗原特异性CD8+CTL和CIK细胞对乳腺癌细胞的细胞毒活性的比较
Tab.2 Comparison of the cytotoxic effect of CD8+CTLs and CIKs on breast cancer cells (n=6, %)
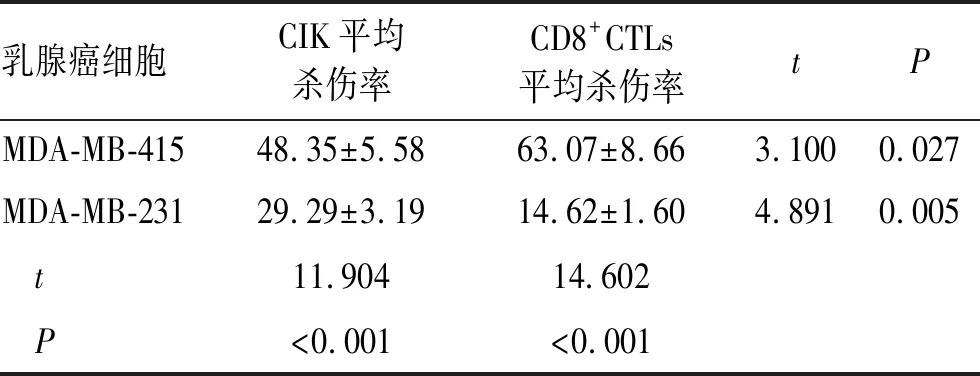
乳腺癌细胞CIK平均杀伤率CD8+CTLs平均杀伤率tPMDA-MB-41548.35±5.5863.07±8.663.1000.027MDA-MB-23129.29±3.1914.62±1.604.8910.005 t11.90414.602 P<0.001<0.001
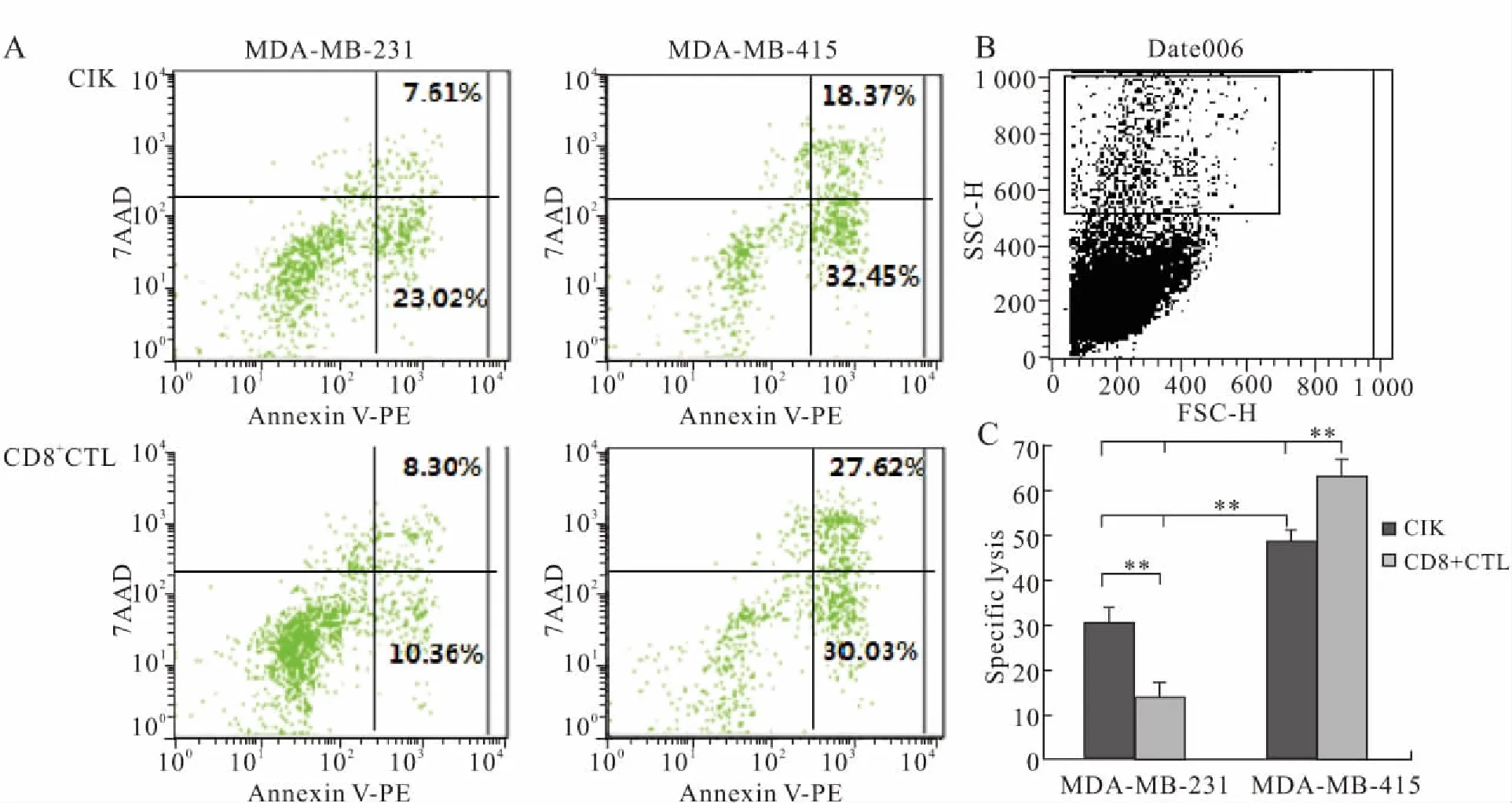
图5 MGBA抗原特异性CD8+CTL和CIK细胞对乳腺癌细胞的细胞毒活性分析
Fig.5 The cytotoxic effects of MGBA specifically stimulated CD8+CTLs and CIKs on breast cancer cells
A:流式细胞术检测结果;B:对乳腺癌细胞画门方式;C:统计学分析;**P<0.01。
3 讨 论
由于各种因素导致肿瘤的发病率、复发率、转移率高,而治愈率低。传统的手术、化疗、放疗是治疗肿瘤的3大治疗手段,但仍然不能很好控制肿瘤,急需找到一种更好的治疗方式,而肿瘤细胞免疫治疗因其独特的优势而成为研究热点,如抗原递呈细胞DC细胞,以及肿瘤杀伤细胞如CTL、CIK、自然杀伤细胞(nature killer, NK)等[1]。
DC细胞是机体免疫反应的始动者,随着DC的成熟,其表面共刺激分子的表达也在提高[1-2]。本研究发现,在DC细胞培养的初期,细胞体积较小,表达共刺激分子CD80、CD83、CD86的量较少,培养第5天出现明显升高,而转染后24 h,培养的第7天表达量分别达到87.23%、31.07%和79.68%,说明绝大多数DC细胞都达到了成熟,从而利于抗原的递呈和对其他免疫杀伤细胞的免疫激活。同时发现,DC细胞在转染后无论从毛刺样外观还是共刺激分子的表达都明显提高,提示腺病毒转染能够促进DC细胞的成熟,这在本研究团队的其他研究中已有报道[4]。
CIK细胞是一群异质细胞。其中表达CD3和CD56两种膜蛋白的细胞(CD3+CD56+CIK)是CIK中主要的效应细胞,也称为自然杀伤细胞型淋巴细胞,既具有T淋巴细胞抗肿瘤活性,又具有NK细胞的非MHC限制性杀瘤特点[5-6]。因此,很多研究中常检测CD3+CD56+CIK以检验体外培养是否成功。本研究发现,随着CIK培养时间的延长,CD3+CD56+CIK细胞的比例逐渐提高,在第1天时平均仅占3.47%,而在第7天与DC细胞共培养前为20.19%,而共培养7 d则平均高达40.74%,显示培养成功,也提示与DC细胞共培养能够刺激CIK中有效杀伤细胞的比例。这与其他研究的结果是一致的[6-7]。
CTL为抗原特异性细胞毒性杀伤细胞,其中CD8+CTL是主要的杀伤细胞[8]。DC细胞通过MHC-抗原肽复合体与T细胞受体识别,并通过DC细胞表面的共刺激分子如CD80、CD83、CD86等与T细胞表面的配体结合,从而激活T细胞转变为具有抗原特异性的细胞毒性杀伤细胞,对于表达该抗原的靶细胞起到有效的杀伤作用。本研究体外扩增T细胞并与转染后表达MGBA的DC细胞共培养,刺激制备MGBA抗原特异性CD8+CTL,用磁珠分选法提高纯度。
那么抗原特异性CD8+CTL和同样与DC细胞共培养的CIK细胞,哪一种杀瘤更强呢?本研究中乳腺癌MDA-MB-415细胞表达该蛋白,而MDA-MB-231细胞不表达该蛋白[8]。CIK和CD8+CTL对MDA-MB-415细胞杀伤实验显示,CD8+CTL的杀伤率达到63.07%,远高于CIK细胞的48.35%,说明CD8+CTL细胞的针对性和特异性更强。而对不表达MGBA的乳腺癌MDA-MB-231细胞,CIK细胞的杀伤率达到29.29%,远高于CD8+CTL的14.62%,说明CIK细胞的杀瘤谱广,对于抗原不明确的肿瘤,CIK的杀伤效果要高于CD8+CTL。CIK对MDA-MB-415细胞的杀伤力高于MDA-MB-231细胞,说明DC细胞对CIK细胞同样的重要性,在培养过程中也产生了抗原特异性杀伤细胞,其中就包括CD8+T细胞。MGBA抗原特异性CD8+CTL对不表达MGBA的MDA-MB-231细胞杀伤活性很低,进一步说明其针对性和特异性更强。
综上,DC细胞能够在体外培养成熟,腺病毒转染可促进其进一步成熟;CIK细胞也能在体外诱导激活,与DC细胞共培养能够促进CIK活化;表达特异抗原的DC细胞诱导CD8+CTL细胞的抗原特异性杀伤活性;抗原特异性CD8+CTL对于表达该抗原的靶细胞的杀伤活性要高于CIK细胞;而CIK细胞的杀瘤谱广,尤其对于不表达特异抗原的靶细胞,CIK的杀伤活性要高于CD8+CTL。这为对于有无表达特异抗原的肿瘤临床治疗提供了新思路。
