己糖激酶2在卵巢癌组织中的表达及其对卵巢癌细胞增殖的影响
2019-09-10邹余粮裴美丽
李 洁,邹余粮,裴美丽,江 玉
(西安交通大学第一附属医院妇产科,陕西西安 710061)
卵巢癌是死亡率较高的女性生殖系统恶性肿瘤之一,其主要病理类型为上皮性卵巢癌。卵巢癌发病隐匿,且易发生早期转移,就诊时多已发展至晚期[1]。尽管治疗手段在不断发展,但卵巢癌患者的5年生存率仍无明显改善[2]。获得新的早期辅助诊断指标和治疗靶点并研发靶向药物,是目前卵巢癌研究的主要方向[2]。
瓦伯格效应,即有氧糖酵解,是维持肿瘤细胞恶性表型的重要能量代谢特征,它不仅可以为肿瘤细胞快速生长提供大分子合成代谢的前体物质,满足肿瘤细胞存活的能量需求,还能创造适宜的微环境,为肿瘤细胞提供生长优势[3-4]。己糖激酶(hexokinase, HK)可将葡萄糖催化生成6-磷酸葡萄糖,它是糖酵解途径的第1个酶,也是糖酵解途径的限速酶[5]。在哺乳动物的体内,一共有4种亚型的己糖激酶,它们各自有一定的组织特异性。Ⅰ型在脑组织中表达特别高;Ⅱ型是胰岛素敏感型的,主要存在于脂肪及肌组织中;Ⅲ型在肝、肾和肠组织中有微量的表达;Ⅳ型仅在肝和胰中存在,即葡萄糖激酶[6]。在生长迅速的肿瘤细胞中,以HK2高表达为主[7]。本研究探讨HR2在卵巢癌组织中的表达及其对卵巢癌细胞增殖能力的影响。
1 材料与方法
1.1 材料
1.1.1组织标本 收集2017年1月至12月在西安交通大学第一附属医院妇科住院手术切除的27例卵巢癌患者新鲜手术标本,年龄32~68岁(中位数为53岁)。所有患者均行卵巢癌肿瘤细胞减灭术并经术后病理证实为卵巢上皮性癌,术前均未予以放射和化学治疗。另收集正常卵巢组织14例(因子宫肌瘤或子宫腺肌症行全子宫+双附件手术),所有患者均经术后病理证实为正常卵巢组织。
1.1.2细胞 人卵巢癌细胞SKOV3由中国科学院上海细胞库提供。
1.1.3主要试剂及仪器 RPMI 1640培养基和胎牛血清购自美国GIBCO公司,HK2过表达质粒购自美国ADDgene公司,HK2 siRNA购自广州锐博公司,X-treme GENE siRNA转染试剂购自瑞士罗氏公司,CCK8检测试剂盒由日本同仁化学研究所提供,HK2及β-actin抗体购自美国Cell signaling公司,HRP标记的免疫组化二抗试剂盒购自福州迈新生物技术公司。
1.2 方法
1.2.1组织RNA提取 组织中加入液氮研磨成粉后加入1 mL Trizol试剂,室温静置5 min;加入0.2 mL氯仿,充分剧烈振荡后于室温静置2~3 min,室温离心15 min;离心后样品分层,取上清加入0.5 mL异丙醇,轻轻混匀,室温静置10 min后,室温离心10 min后弃去上清;向沉淀中加入1 mL乙醇,轻轻混匀。室温离心5 min后弃上清;将RNA样品晾干(不要彻底干燥),加入适量DEPC水溶解。
1.2.2实时定量PCR检测HK2 mRNA的表达 使用美国Thermo公司的逆转录试剂盒进行RNA逆转录。将引物干粉稀释成10 μmol/L的工作浓度,以逆转录所得cDNA为模板,按下述体系配制实时定量PCR反应液:SYBY Green 10 μL,上游引物0.4 μL,下游引物0.4 μL,cDNA模板2.0 μL,ddH2O 7.2 μL;反应条件为95 ℃ 30 s,(95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s)共40个循环。每次实验均设未加模板的阴性对照组,每个样品设置3个复孔,重复实验3次,采用2-ΔΔCt方法计算RQ值,比较每组之间的基因表达差异。
1.2.3细胞培养 SKOV3细胞使用含100 mL/L胎牛血清的RPMI 1640培养基,于37 ℃、50 mL/L CO2的细胞培养箱中培养。
1.2.4细胞转染 将SKOV3细胞悬液接种于6孔板中,待细胞数目达1×106/孔。配制转染试剂混合液(每孔):转染试剂6 μL+质粒2 μg(siRNA 15μL)+无血清无双抗RPMI 1640 200 μL。冰上静置20 min。逐孔弃去细胞原培养液,加入100 mL/L血清的RPMI 1640培养基1.3 mL及转染试剂混合液200 μL。轻晃混匀后置于37 ℃、50 mL/L CO2培养箱中培养。72 h提取总蛋白备用。
1.2.5CCK8法细胞增殖实验 用含100 mL/L胎牛血清的培养液配成单细胞悬液,接种至96孔板,每孔1 000个细胞,设3个复孔。分别于培养21、45、69、93、117 h后,向每孔加入10 μL CCK8溶液,继续培养3 h,测定各孔吸光度值(A450),绘制细胞生长曲线。
1.2.6Western blot检测HK2蛋白表达 抽提细胞总蛋白,各取30 μg蛋白,SDS-PAGE分离后转膜,50 mL/L脱脂牛奶室温封闭2 h,加入HK2单克隆抗体(1∶500)或β-actin单克隆抗体(1∶1 000),4 ℃孵育过夜,TBST洗膜8 min×5次,加入相应的二抗(1∶2 000),室温孵育2 h,TBST洗膜8 min×5次。加入发光试剂ECL曝光。
1.2.7免疫组化染色观察组织病理改变 将石蜡切片置于二甲苯中脱蜡处理10 min×2次。将切片依次浸泡于下列试剂中:无水乙醇10 min,950 mL/L乙醇5 min,750 mL/L乙醇5 min。将切片置于去离子水中水化处理2 min×3次。采用PBS(pH 7.4)冲洗切片3 min×3次。高压抗原修复:高压锅内倒入2 L柠檬酸(0.01 mol/L),加热至沸腾后将切片放入,继续加热至高压锅喷气时计时高压15 min后自然冷却。滴加过氧化氢到每张切片,室温孵育10 min,阻断内源性过氧化物酶。PBS冲洗切片3 min×3次。滴加一抗孵育后PBS冲洗切片3 min×3次。滴加羊抗兔/鼠IgG抗体-HRP二抗,室温孵育30 min。PBS冲洗切片3 min×3次。滴加新鲜配置的DAB显色液,显微镜下观察3~5 min,当发现有棕黄色颗粒出现时,立即采用去离子水终止反应。PBS冲洗切片3 min×3次。苏木素复染45 s,PBS冲洗切片3 min×3次。梯度乙醇脱水干燥,二甲苯透明处理后中性树胶封片。显微镜下读片,拍照。
1.3 统计学分析所有数据采用均数±标准差表示,运用统计学软件SPSS 22.0(Chicago, IL, USA)进行统计分析。两组之间的差异比较采用独立样本双侧t检验,组间构成比的比较采用χ2检验。P<0.05表示差异有统计学意义。
2 结 果
2.1 卵巢癌组织及正常卵巢组织中HK2的表达水平实时定量PCR检测27例卵巢癌组织及14例正常卵巢组织中HK2的表达水平(图1A),结果提示,卵巢癌组织中HK2的mRNA的表达水平明显高于正常卵巢组织中HK2表达水平。免疫组化结果提示,卵巢癌组织中的HK2表达水平高于正常卵巢组织(图1B)。
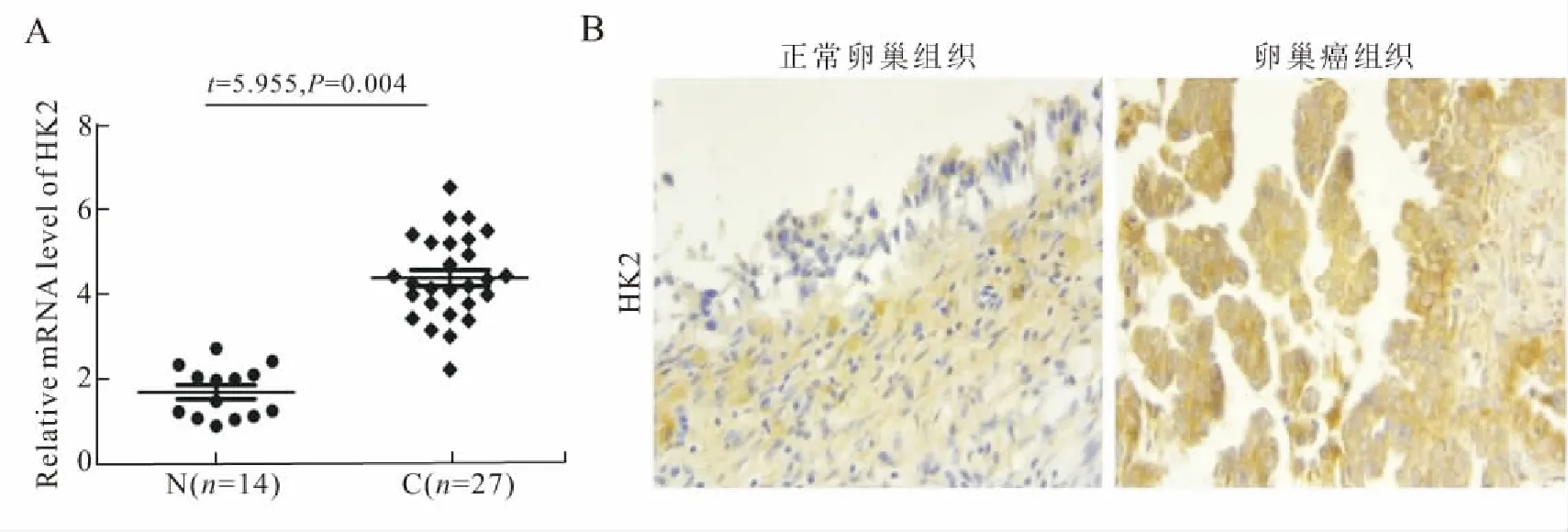
图1 HK2在卵巢癌组织中的表达水平明显高于正常卵巢组织
Fig.1 HK2 level in ovarian cancer tissues was higher than in normal ovarian tissues
A:实时定量PCR结果(N:正常卵巢组织;C:卵巢癌组织);B:免疫组化结果(×200)。
2.2 HK2的表达与临床分期及病理分级关系实时定量PCR结果提示,卵巢癌组织中的HK2表达水平与肿瘤的临床分期、病理分级及远处转移相关,临床分期越晚(图2A),病理级别越高(图2B),伴随远处转移(图2C)的卵巢癌组织中HK2的表达水平更高。
相应的,免疫组化结果和实时定量结果一致,HK2在卵巢癌组织中的表达水平和临床期别,病理级别及远处转移有相关性(表1)。
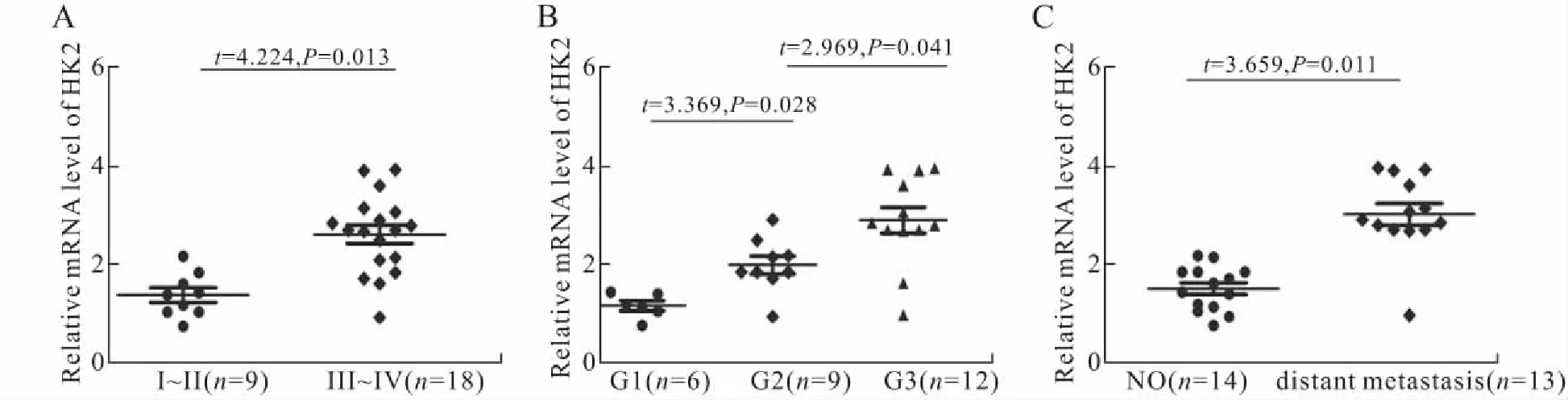
图2 实时定量PCR检测卵巢癌组织中HK2表达与临床分期(A)、病理分级(B)及远处转移(C)的关系
Fig.2 Correlation of HK2 expression with clinicopathological (A), pathological grade (B) and distant metastasis (C) of ovarian cancer tissues by qRT-PCR
2.3 HK2促进卵巢癌细胞的增殖能力在SKOV3细胞中,转染HK2过表达质粒后,Western blot实验结果表明,HK2蛋白水平明显上升(图3A),CCK8实验结果证实过表达HK2后SKOV3的增殖能力上升(图3B)。在SKOV3细胞中转染HK2 siRNA敲低HK2后,Western blot实验结果表明,HK2蛋白水平明显下降(图4A),CCK8实验结果证实,敲低HK2后SKOV3的增殖能力下降(图4B)。
3 讨 论
尽管当今手术、化疗、放疗等治疗手段已经相对成熟[8-9],卵巢癌的治疗水平逐步提高,但是卵巢癌的预后仍无明显改善[10-11]。近年来,靶向治疗已经明显改善了癌症患者预后[12],但是,在卵巢癌的治疗上,靶向药物的应用还面临着很大的挑战[13]。因此,深入了解卵巢癌的发生机制、明确其进程中的关键分子可能为卵巢癌的精准治疗提供新的靶点。本实验表明HK2在卵巢癌的发生发展中有重要作用,卵巢癌组织中HK2的表达水平明显高于正常卵巢组织,敲低HK2可抑制卵巢癌细胞增殖能力,提示HK2可能作为治疗卵巢癌的靶分子。本研究为卵巢癌的靶向治疗提供新的“候选”分子。
表1 卵巢癌组织中HK2的表达与临床分期及病理分级的关系
Tab.1 Correlation of HK2 expression with clinicopathological and pathological grade of ovarian cancer tissues by IHC

病理学特征n阳性率[n(%)]χ2P病理分级 G164(66.7) G298(88.9) G31212(100.0)6.3620.029∗临床分期 Ⅰ~Ⅱ95(55.6) Ⅲ~Ⅳ1817(94.4)6.0140.030∗远处转移 无148(57.1) 有1313(100.0)7.1630.016∗

图3 过表达HK2促进卵巢癌SKOV3细胞增殖能力
Fig.3 The growth of SKOV3 cells was significantly promoted by overexpression of HK2
A:Western blot检测结果;B:CCK8实验检测SKOV3细胞增殖能力。

图4 敲低HK2抑制卵巢癌SKOV3细胞增殖能力
Fig.4 The growth of SKOV3 cells was significantly inhibited by downexpression of HK2
A:Western blot检测结果;B:CCK8实验检测SKOV3细胞增殖能力。
肿瘤细胞即使在有氧条件下,也倾向于通过糖酵解而不是产能效率更高的氧化磷酸化途径代谢葡萄糖,为细胞生长供能,这种现象称为有氧糖酵解,即瓦伯格效应[4,14]。瓦伯格效应在肿瘤的发生发展中扮演着重要的角色,靶向瓦伯格效应中关键分子可能是癌症治疗的有效策略[13,15-17]。己糖激酶(HKs)是催化糖酵解的第一限速酶,它使用ATP作为磷酸盐,供体催化葡萄糖磷酸化产生6-磷酸葡萄糖[4]。HK2是有氧糖酵解中的限速酶,它与线粒体的结合是瓦伯格效应所必需的。HK2作为瓦伯格效应的关键酶,在多种肿瘤细胞中高表达,促进肿瘤生长[18]。有研究者通过基因分析发现,在人肺癌细胞系NCI-H661和NCI-H460中,分别有61%和40%的HK2激活,而在人正常支气管上皮细胞中只有0.9%激活[19]。本研究表明,HK2在卵巢癌组织中的表达明显高于正常卵巢组织中的表达,这与之前的研究报道一致。
本研究表明,HK2在卵巢癌中表达明显增高,细胞水平实验提示,抑制HK2的表达可以有效抑制卵巢癌细胞的增殖,提示HK2可以作为治疗卵巢癌的靶分子。系统靶向HK2可阻断肿瘤生长且不伴随严重的不良反应[20]。目前有多种用于抑制HK2功能的药物,例如,葡萄糖类似物2-脱氧葡萄糖(2-deoxyglucose, 2-DG)通过负反馈机制抑制HK2活性,阻断糖酵解途径,从而增加肿瘤细胞对放化疗的敏感性[21]。Lonidamne作为靶向HK2的治疗药物,目前已经完成了乳腺癌和肺癌的Ⅲ期临床试验,并且与化疗联合时观察到了更高的肿瘤反应和更好的预后特性[22]。但是,在卵巢癌的治疗中,靶向于瓦伯格关键分子的药物研究尚未见报道。本研究结果证实,HK2在卵巢癌组织中的表达水平高于正常卵巢组织,临床分期越晚,病理分级越高,有远处转移者HK2的表达水平越高。这与之前的报道是一致的[23]。此外,我们在细胞水平上进行验证,结果证实,HK2可促进卵巢癌细胞增殖能力。本研究为靶向HK2治疗卵巢癌提供了实验依据。
综上所述,HK2在卵巢癌组织中的表达水平明显高于正常卵巢组织,其具有促进卵巢癌细胞增殖的作用,但是具体的作用机制仍需后续研究进一步阐明。
