早期肠内营养治疗对ICU心脏术后患者预后的影响
2019-09-09梁微波潘洁仪余裕恒何为群
梁微波, 潘洁仪, 余裕恒, 何为群
广州医科大学附属第一医院、广州呼吸健康研究院重症医学科(广东广州 510120)
目前,心内直视手术仍是治疗心脏疾病的主要手段,手术治疗的心脏疾病主要包括心脏瓣膜病、风湿性心脏病、冠心病、先天性心脏病等[1]。研究表明,心脏手术患者都有不同程度的肺功能下降及胃肠道功能损伤等并发症,重症患者可发展为急性呼吸衰竭、消化道大出血、肝功能衰竭[2]。心脏手术后患者静息耗氧量增加,对糖的利用率下降,蛋白质分解增加,尿氮排出增加,出现负氮支持平衡,研究表明,治疗重症患者的过程改善机体营养状态至关重要,早期营养治疗在该类患者治疗中的重要性已越来越突出[3]。肠内营养治疗是ICU常用辅助治疗手段,早期营养治疗可有效维持细胞代谢功能,促进机体稳态,并降低了并发症发生率,有效改善重症心脏手术患者术后肠内营养状态[4-5]。同时,早期营养支持可为机体提供必要的营养物质,增加机体免疫力,加快患者的术后恢复,减少住院时长并节省医疗费用[6-7]。但目前对于心脏手术后何时开始进行肠内营养,临床尚有争议。因此,本研究以96例重症心脏手术患者为研究对象,探讨早期肠内营养支持对ICU重症心脏患者术后营养指标及预后的影响,为重症心脏手术后早期营养支持治疗提供理论与临床数据。
1 资料与方法
1.1 一般资料 选择2017年1月至2018年12月本院诊治的重症心脏患者96例进行前瞻性观察研究。入组标准:(1)年龄18岁;(2)接受心脏手术治疗后新入ICU的患者;(3)有营养风险且预计3 d以上不能经口进食;(4)预计在ICU内的治疗时间超过7 d;(5)签署知情同意书。排除标准:(1)患者术后病情无法逆转或临终状态的患者;(2)长期使用激素或免疫抑制药物的患者;(3)恶性肿瘤正在行放化疗或特殊治疗的患者;(4)患者及家属未签署知情同意书。采用随机数字表法将重症心脏患者随机分为对照组与观察组,每组48例。对照组年龄28~72岁;观察组年龄32~76岁;两组患者在年龄、入院诊断、性别以及入院时APACHEⅡ、SOFA评分上差异均无统计学意义(P>0.05),见表1。
1.2 治疗方法 观察组(早期肠内营养组)术后24 h内即通过14号鼻胃管进行24 h持续泵输注肠内营养混悬液,对照组(延迟肠内营养组)术后24~72 h内通过14号鼻胃管进行24 h持续泵注整蛋白(1 mL∶1 kcal)肠内营养混悬液。两组患者初始泵注速度为20 mL/h,保证肠内营养混悬液温度在37~42℃之间,24 h后泵注速度调至40 mL/h。保持床头抬高20°,根据胃内余量调整泵速,每泵注4~6 h行胃内余量监测1次,及时清除气道分泌物,以防患者反流、误吸。每8 h对患者进行肠内营养耐受性评分,如果患者出现不耐受情况,立即减慢滴速,稀释肠内营养乳剂或遵医嘱按时给患者服用莫沙必利或肠内双歧杆菌等。保持营养液的相对无菌,避免污染,若患者出现频繁腹泻、呕吐、肠梗阻、消化道出血等不良反应时,需及时停止泵注肠内营养混悬液,待患者症状缓解后再逐步恢复肠内营养。
表1 两组患者一般资料比较
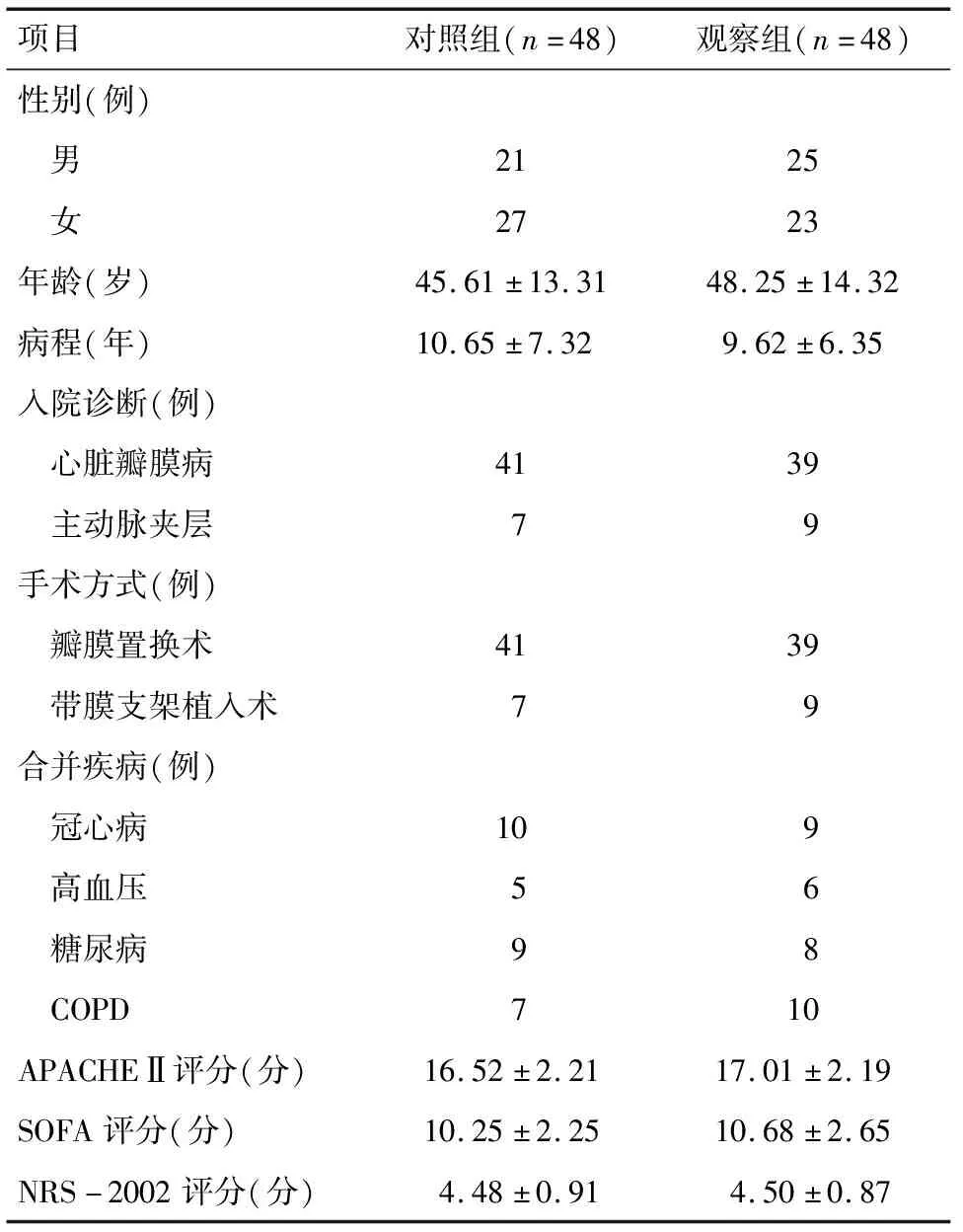
表1 两组患者一般资料比较
项目对照组(n=48)观察组(n=48)性别(例) 男2125 女2723年龄(岁)45.61±13.3148.25±14.32病程(年)10.65±7.329.62±6.35入院诊断(例) 心脏瓣膜病4139 主动脉夹层79手术方式(例) 瓣膜置换术4139 带膜支架植入术79合并疾病(例) 冠心病109 高血压56 糖尿病98 COPD710APACHEⅡ评分(分)16.52±2.2117.01±2.19SOFA评分(分)10.25±2.2510.68±2.65NRS-2002评分(分)4.48±0.914.50±0.87
1.3 观察指标 分别记录两组患者入住ICU时营养风险评分NRS-2002评分,及肠内营养开始后7、10、14 d的营养状况指标如白蛋白(Alb)、前白蛋白(PAB)、血红蛋白(Hb)、转铁蛋白(TF)、三酰甘油(TG)水平,炎性反应指标白细胞介素-6(IL-6)水平、降钙素原(PCT)、B型脑钠尿肽(BNP)以及预后指标(病死率、ICU住院时长、住院总时长、并发症发生情况),并对两组患者治疗前后进行APACHEⅡ、SOFA评分。

2 结果
2.1 两组患者营养状况的比较 在肠内营养开始前,观察组与对照组患者NRS-2002评分(4.48±0.91、4.50±0.87),血清Alb、PAB、Hb、TF、TG水平均无明显差别,给予肠内营养治疗7、10、14 d后,观察组患者Alb、PAB、Hb水平较对照组患者显著升高(P<0.05,P<0.01)。见表2。
表2 两组患者各时间点的营养指标水平比较
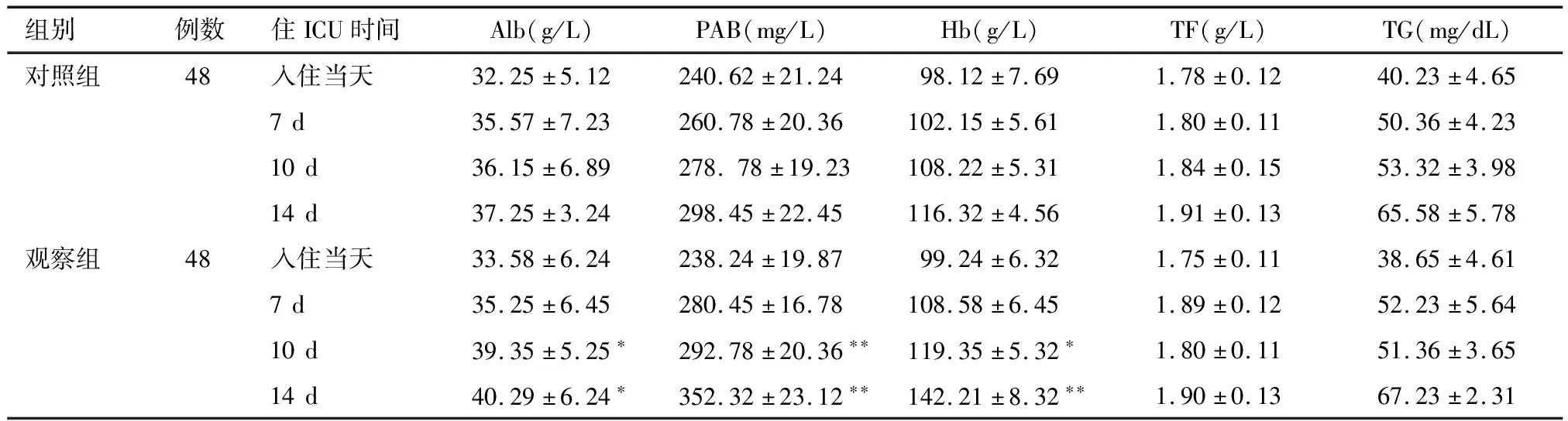
表2 两组患者各时间点的营养指标水平比较
组别例数住ICU时间Alb(g/L)PAB(mg/L)Hb(g/L)TF(g/L)TG(mg/dL)对照组48入住当天32.25±5.12240.62±21.2498.12±7.691.78±0.1240.23±4.657d35.57±7.23260.78±20.36102.15±5.611.80±0.1150.36±4.2310d36.15±6.89278.78±19.23108.22±5.311.84±0.1553.32±3.9814d37.25±3.24298.45±22.45116.32±4.561.91±0.1365.58±5.78观察组48入住当天33.58±6.24238.24±19.8799.24±6.321.75±0.1138.65±4.617d35.25±6.45280.45±16.78108.58±6.451.89±0.1252.23±5.6410d39.35±5.25∗292.78±20.36∗∗119.35±5.32∗1.80±0.1151.36±3.6514d40.29±6.24∗352.32±23.12∗∗142.21±8.32∗∗1.90±0.1367.23±2.31
与对照组比较*P<0.05,**P<0.01
2.2 两组患者IL-6、PCT、BNP水平比较 在肠内营养开始前,观察组与对照组患者血清IL-6、PCT、BNP含量均无明显差别,给予肠内营养治疗10 d后,观察组患者IL-6含量较对照组患者显著降低,给予肠内营养治疗14 d后,观察组患者IL-6、PCT、BNP水平较对照组患者均显著降低(P<0.05,P<0.01)。见表3。
2.3 两组患者并发症发生情况比较 相对于对照组,观察组患者肺部感染、腹泻、呕吐并发症的发现率显著降低,差异有统计学意义(P<0.05,P<0.01)。见表4。
2.4 两组患者病死率、ICU住院时长、住院总时长比较 与对照组比较,观察组病死率明显降低。与对照组相比,观察组ICU住院时长、住院总时长均显著减少(P<0.05)。见表5。
表3 两组患者各时间点IL-6、PCT、BNP水平比较

表3 两组患者各时间点IL-6、PCT、BNP水平比较
组别 例数住ICU时间IL-6(pg/L)PCT(ng/mL)BNP(ng/L)对照组48入住当天160.52±10.252.85±1.32160.3±15.247d142.3±9.881.33±0.7599.25±9.5810d135.21±6.871.11±0.6581.24±8.2114d125.69±8.690.89±0.1261.23±7.69观察组48入住当天155.68±12.243.01±1.24101.50±6.457d130.54±8.553.65±1.8780.12±5.5610d128.21±7.68∗0.92±0.0970.65±6.3214d99.58±7.36∗∗0.45±0.15∗35.66±4.58∗∗
与对照组比较*P<0.05,**P<0.01
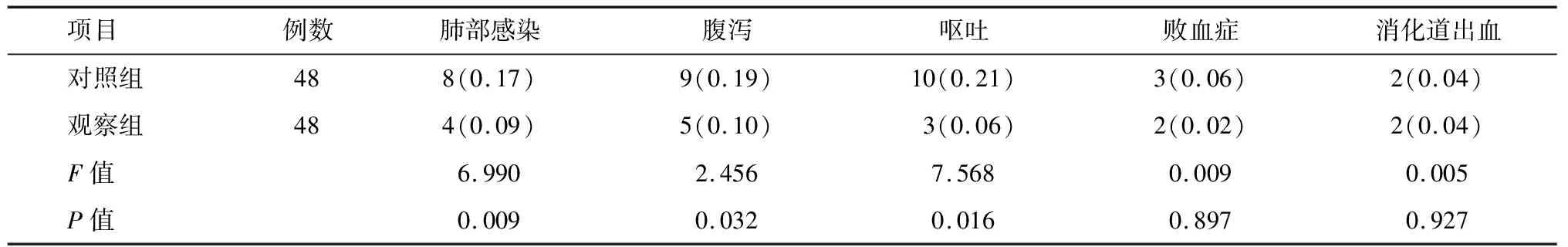
表4 两组患者术后并发症发生率比较 例(%)
表5 两组患者病死率、ICU住院时长、住院总时长比较
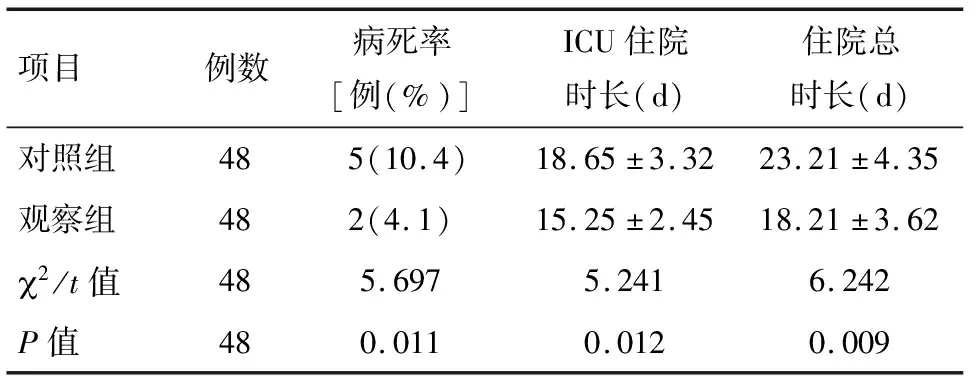
表5 两组患者病死率、ICU住院时长、住院总时长比较
项目例数病死率[例(%)]ICU住院时长(d)住院总时长(d)对照组485(10.4)18.65±3.3223.21±4.35观察组482(4.1)15.25±2.4518.21±3.622/t值485.6975.2416.242P值480.0110.0120.009
2.5 两组患者APACHEⅡ、SOFA评分比较 治疗前两组APACHE Ⅱ、SOFA评分比较差异无统计学意义(P>0.05);营养支持7、14 d后,观察组APACHEⅡ评分显著低于对照组(P<0.01)。观察组SOFA评分显著低于对照组(P<0.01)。见表6。
表6 两组患者术后APACHEⅡ、SOFA评分比较
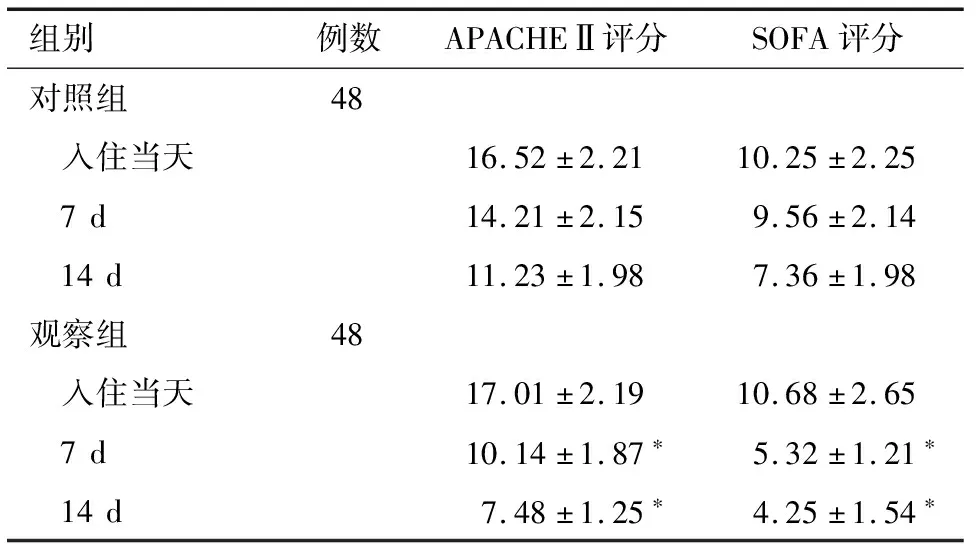
表6 两组患者术后APACHEⅡ、SOFA评分比较
组别 例数APACHEⅡ评分SOFA评分对照组48 入住当天16.52±2.2110.25±2.25 7d14.21±2.159.56±2.14 14d11.23±1.987.36±1.98观察组48 入住当天17.01±2.1910.68±2.65 7d10.14±1.87∗5.32±1.21∗ 14d7.48±1.25∗4.25±1.54∗
*与对照组比较P<0.01
3 讨论
心脏手术涉及器官特殊、手术创伤大、手术环节复杂、对操作中手术技术的要求高,患者围手术期病死率较高[8]。研究表明,心脏手术后患者多伴有不同程度的心功能受损,患者术后静息耗氧量增加,对糖的利用率下降,蛋白质分解增加,尿氮排出增加,出现负氮平衡,因此,心脏手术后的辅助营养治疗对患者的术后恢复尤为重要[9]。近年来,临床上越来越重视营养治疗的作用,营养治疗是指在患者饮食不能获取或摄入不足的情况下,通过外界途径向患者提供维持机体运转的各种营养素的辅助治疗手段,目前临床常见的营养治疗途径主要包括肠内营养和肠外营养[10-11]。肠外营养技术临床上已应用多年,可快速蛋白质等营养物质,纠正机体营养,可调节补液配方,应用较为方便。国内外对心脏术后患者营养治疗的时机以及营养治疗对预后的影响研究尚不多。对于严重心功能不全患者,肠外较易引发电解质、糖、脂肪代谢紊乱,且不易于肠道正常生理功能的恢复[12]。近年来,肠内营养开始越来越受到临床的重视,肠内营养在维持肠道内的免疫平衡的同时,还可恢复机体的正常代谢,更有利于患者的术后康复[13]。研究表明,肠黏膜的屏障功能受到损害后,可分泌大量炎性细胞因子,如IL-6、PCT等,导致人体出现多器官功能障碍综合征(multiple organdysfunction syndrome)和全身炎性反应综合征(systemic inflammatory responsesyndrome)[14]。而肠内营养在有效保护肠黏膜完整性的同时,还可促进免疫球蛋白、消化酶以及相关抗体的分泌,加快胃肠蠕动,促进血液循环,恢复机体正常稳态[15]。肠内营养在维持机体氮平衡的同时,还可降低患者术后并发症的发病率,且费用较肠外营养更低。近年来,国内外重症患者营养支持指南中着重强调了肠内营养的重要性,提倡条件允许的情况下进行肠内营养是首要选择[16]。一般肠内营养多在患者术后48 h 进行,但也有研究者认为,机体长时间维持在负氮平衡影响患者康复,应尽早对患者实行肠内营养。目前研究发现,危重症患者小肠蠕动在术后2 h就已基本恢复正常[17]。因此,患者术后24 h肠道即具备了营养吸收功能。本研究从肠内营养实施时机的角度,探讨了早期肠内营养与常规肠内营养对心脏手术术后相关指标及机体康复的影响。
本研究表明,患者在24 h内接受肠内营养更有利于患者的康复,患者血清Alb、PAB、Hb、TF、TP水平均高于对照组,且患者血清IL-6、PCT、BNP 水平较对照组患者明显降低,表明早期肠内营养可更有效改善患者营养状态,减轻机体的过度炎症反应、降低心力衰竭风险,同时,早期肠内营养还可降低患者的APACHEⅡ、SOFA评分、病死率、住院时间,并发症发生率也较对照组更低。因此,早期肠内营养能够有效及时改善ICU心脏手术患者的营养状况,纠正患者低蛋白血症,减轻机体炎症反应,降低病死率、住院时间、并发症发生率,并改善患者预后,具有广泛的临床推广价值。这与国内一些非胃肠道手术术后患者早期肠内营养改善预后,对胃肠道修复有帮助的研究是一致的[18]。但本研究例数偏少,对患者营养治疗过程中对心脏术后患者炎症反应影响的甄别存在不足,以及对患者心功能的干预影响仍需要更大的临床数据支持,这也是未来营养治疗对心脏功能异常患者研究作用的方向。
