促性腺激素释放激素激动剂对保守性腹腔镜手术后卵巢子宫内膜异位症患者疼痛及生殖激素水平的影响
2019-09-07张译心王秀美薛晓玲
张译心,王秀美,薛晓玲
(海安市人民医院妇产科,江苏 海安 226600)
子宫内膜异位症是指正常的子宫内膜由于某种因素出现于子宫体以外的其他部位,该病具有种植、复发、转移等类似于恶性肿瘤生长的特点,属于良性疾病,具有一定的难治性[1]。卵巢子宫内膜异位症患者常以顽固性疼痛和不孕为主要临床表现,当病灶累及骶韧带、输尿管、膀胱、肠管等组织时,可引起患者性交痛、慢性盆腔痛、进行性加重的痛经等不适症状[2]。卵巢子宫内膜异位症的治疗方法主要有手术治疗和药物治疗。手术治疗以保守性手术方式为主,主要是切除异位的病灶,分离粘连,恢复正常的解剖结构,保留子宫及双侧附件。保守性手术治疗对于年轻女性来说尤为重要,多数年轻患者有强烈的保留生殖器官的意愿,因此,腹腔镜保守手术治疗已成为主流方式。然而,手术难以一次性完整切除病灶,且术后复发率高,故术后常辅以药物治疗来预防或降低复发[3]。临床治疗卵巢子宫内膜异位症常用的药物包括避孕药、高效孕激素、达那唑等。有研究显示,子宫内膜异位病灶具有一定的激素依赖性,长期使用促性腺激素释放激素激动剂(gonadotropin releasing hormone agonist,GnRH-α)能够达到缩小病灶的效果[4]。本研究旨在探讨GnRH-α对保守性腹腔镜手术后卵巢子宫内膜异位症患者疼痛及生殖激素水平的影响。
1 资料与方法
1.1 一般资料选择2014年6月至2017年9月海安市人民医院妇产科收治的卵巢子宫内膜子宫内膜异位症患者作为观察对象,纳入标准:(1)经影像学及术后病理诊断证实为子宫内膜异位症;(2)有典型的临床症状,如:性交痛、盆腔痛、进行性痛经等;(3)年龄18~45岁,且排卵正常者。排除标准:(1)有严重基础疾病,不能耐受手术者;(2)腹腔镜手术治疗后复发者;(3)并发慢性盆腔炎、子宫及附件炎症者;(4)术前6个月内使用过激素治疗者;(5)有精神疾病,不能配合治疗者;(6)有GnRH-α或孕三烯酮使用禁忌证者。本研究共纳入卵巢子宫内膜异位症患者70例,均行保守性腹腔镜手术治疗,根据患者术后药物治疗方法分为观察组和对照组,每组35例。对照组:患者年龄23~48(35.6±5.8)岁,体质量48~63(50.6±5.2)kg,子宫内膜异位症美国生殖医学协会分期(revise-American Fertility Society,r-AFS)评分36~43(38.8±2.6)分,视觉模拟评分法(visual analogue scales,VAS)评分4~6(5.1±0.4)分。观察组:患者年龄21~47(35.8±5.9)岁,体质量49~62(51.1±5.3)kg,r-AFS 评分37~44(39.2±3.7)分,VAS评分4~6(5.3±0.6)分。2组患者的年龄、体质量、r-AFS评分及VAS评分比较均差异无统计学意义(P>0.05),具有可比性。本研究通过医院医学伦理委员会审核批准,所有患者签署知情同意书。
1.2 治疗方法
1.2.1 腹腔镜手术2组患者均行保守性腹腔镜手术治疗,患者全身麻醉,麻醉满意后取平卧位,依次置入穿刺器械、镜头及操作器械,全面探查腹盆腔,依据r-AFS评分法进行分期;行腹腔、盆腔粘连索带游离、松解,充分暴露视野,恢复其正常解剖形态;通过电切或电灼术切除异位病灶,伴有卵巢囊肿的一并予以剔除,去除的病灶组织送病理检查。
1.2.2 术后药物治疗对照组患者术后给予孕三烯酮(华润紫竹药业有限公司,国药准字H19980020)治疗,术后月经来潮第1天口服,每次2.5 mg,每周2次,共治疗6个月。观察组患者术后给予GnRH-α(注射用醋酸亮丙瑞林微球,上海丽珠制药有限公司,国药准字H20093852)治疗,术后月经来潮第1天皮下注射3.75 mg,每月1次,共6次。
1.3 观察指标
1.3.1 不良反应观察2组患者治疗期间出现的不良反应,如:潮热、盗汗、阴道出血、阴道干涩、体质量增加、头晕、乏力、肝功能受损等。
1.3.2 疼痛缓解情况治疗后观察2组患者性交痛、痛经及盆腔痛缓解情况,疼痛缓解是指疼痛症状完全消失或疼痛程度明显减轻。
1.3.3 血清生殖激素水平分别于治疗前及治疗后患者第1个月经周期后3~5 d抽取清晨空腹肘静脉血5 mL,采用电化学发光法测定血清促卵泡激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、雌二醇(estradiol,E2)及催乳素(prolactin,PRL)水平。
1.3.4 临床疗效治疗后1 a根据患者症状改善情况及超声检查结果评定临床疗效。痊愈:临床症状完全消失,超声检查未见肿块;有效:临床症状明显改善,无明显阳性体征,超声检查未见肿块;无效:临床症状未见好转,超声检查未见肿块;复发:临床症状未见缓解或加重,超声检查可见盆腔内有包块出现[5]。总有效率=痊愈率+有效率。
2 结果
2.1 2组患者治疗期间不良反应比较治疗期间,观察组患者出现潮热、盗汗6例,阴道出血2例,阴道干涩1例,体质量增加1例,不良反应发生率为28.6%(10/35);对照组患者出现潮热、盗汗7例,阴道出血2例,阴道干涩1例,体质量增加2例,不良反应发生率为34.3%(12/35);2组患者不良反应发生率比较差异无统计学意义(χ2=0.265,P>0.05)。2组患者停药后不良反应逐渐消失,未对患者产生严重影响。
2.2 2组患者疼痛缓解情况治疗后,观察组患者性交痛缓解率、痛经缓解率、盆腔痛缓解率分别为100.0%(4/4)、96.2%(25/26)、97.1%(33/34),对照组患者性交痛缓解率、痛经缓解率、盆腔痛缓解率分别为66.7%(2/3)、61.5%(16/26)、56.3%(9/16);观察组患者痛经缓解率、盆腔痛缓解率显著高于对照组,差异有统计学意义(χ2=9.339、13.482,P<0.05);2组患者性交痛缓解率比较差异无统计学意义(χ2=1.556,P>0.05)。
2.3 2组患者血清生殖激素水平比较结果见表1。治疗前2组患者血清E2、FSH、PRL及LH水平比较差异均无统计学意义(P>0.05);2组患者治疗后血清E2、FSH、PRL及LH水平低于治疗前,差异有统计学意义(P<0.05);治疗后,观察组患者血清E2、FSH、PRL及LH水平低于对照组,差异有统计学意义(P<0.05)。
表1 2组患者血清生殖激素水平比较
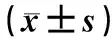
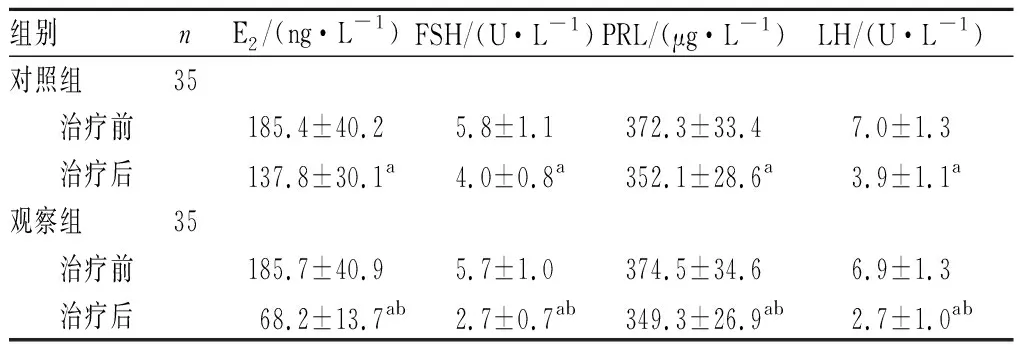
组别nE2/(ng·L-1)FSH/(U·L-1)PRL/(μg·L-1)LH/(U·L-1)对照组35 治疗前185.4±40.25.8±1.1372.3±33.47.0±1.3 治疗后137.8±30.1a4.0±0.8a352.1±28.6a3.9±1.1a观察组35 治疗前185.7±40.95.7±1.0374.5±34.66.9±1.3 治疗后68.2±13.7ab2.7±0.7ab349.3±26.9ab2.7±1.0ab
注:与治疗前比较aP<0.05;与对照组比较bP<0.05。
2.4 2组患者临床疗效比较观察组患者治疗后痊愈18例(51.4%),有效13例(37.1%),无效2例(5.7%),复发2例(5.7%),总有效率为88.6%(31/35);对照组患者治疗后痊愈9例(25.7%),有效17例(48.6%),无效4例(11.4%),复发5例(14.3%),总有效率为74.3%(26/35);观察组患者痊愈率高于对照组,差异有统计学意义(χ2=4.883,P<0.05);2组患者有效率、无效率、复发率及总有效率比较差异无统计学意义(χ2=0.933、0.729、1.428,P>0.05)。
3 结论
子宫内膜异位症属于妇科常见病,好发于育龄期女性,其发病机制目前尚未完全清楚,可能与血管因素、遗传因素、雌激素及其受体因素相关[6]。临床上患者多表现为不同程度的疼痛,包括继发性或进行性加重的痛经、慢性盆腔痛及性交痛等,但病情严重程度与症状之间无明显关联,少数患者无任何典型的临床症状[7]。子宫内膜异位症属于雌激素依赖性疾病,一旦发生异位内膜细胞存活并有激素维持的情况,极有可能导致子宫内膜异位症的复发,因此,完整剥除异位病灶是提高治疗效果、降低术后复发率的关键[8]。
近年来,随着微创技术的不断发展与普及,腹腔镜手术已成为子宫内膜异位症的首选手术方式,其通过放大视野明确病灶的具体位置及范围,分离粘连组织,完整地剥除病灶,恢复盆腔正常解剖结构,减少术后盆腔组织粘连,改善患者盆腔疼痛[9]。亓文博等[10]研究显示,通过腹腔镜手术治疗子宫内膜异位症,术中可清晰显示腹腔及盆腔渗液情况,有助于清除有毒性作用的炎性因子、巨细胞及自由基等,改善患者术后妊娠情况。然而,单纯的手术治疗有一定的局限性,尤其是育龄期女性对保留生育功能有强烈意愿,使得部分患者手术不够彻底,如腹膜后位或浸润程度较为严重的病灶难以被完整地切除,甚至会因手术操作造成医源性病灶扩散、种植或转移,导致疾病复发[11]。近年来,腹腔镜手术后联合使用GnRH-α治疗子宫内膜异位症取得了良好的效果。李燕飞[12]研究显示,腹腔镜术后给予GnRH-α或孕三烯酮辅助治疗,能够显著改善子宫内膜异位症患者的盆腔疼痛症状,提高患者妊娠率,降低术后复发率,尤其是对于中重度患者,术后辅助用药抑制异位内膜病灶生长,能够帮助清除残留病灶,延缓或降低术后复发。GnRH-α属于人工合成的十肽类药物,与天然GnRH具有相同的功能,通过激发垂体,促进其产生FSH和LH;GnRH-α与垂体表面的GnRH受体具有极强的亲和性,对肽酶分解敏感性降低,故其活性远高于天然GnRH,长期使用可引起垂体GnRH受体耗竭,进而导致FSH和LH水平显著降低,最终导致卵巢分泌的雌激素水平大幅降低[13]。GnRH-α还能够使患者体内E2水平下降,导致子宫内膜异位病灶的雌激素水平难以维持,进而达到药物性切除卵巢的效果,使得肉眼不可见或浸润较深的异位病灶发生萎缩,降低术后复发率[14]。陈韦君等[15]报道,长期使用GnRH-α可引起暂时性闭经。杨波[16]研究显示,GnRH-α是目前临床治疗子宫内膜异位症效果最为确切的药物之一,术后给予GnRH-α辅助治疗3~6个月,能够显著缓解患者的疼痛症状,提高其治疗效果。本研究结果显示,观察组患者痊愈率高于对照组,但2组患者治疗有效率、无效率、复发率及总有效率比较差异无统计学意义;这可能与本研究样本量较少相关。本研究结果显示,观察组患者痛经缓解率、盆腔痛缓解率显著高于对照组;表明腹腔镜手术后辅助GnRH-α药物治疗能够明显缓解和改善患者的症状和体征。本研究还发现,2组患者治疗后血清E2、FSH、PRL及LH水平低于治疗前,且治疗后观察组患者血清E2、FSH、PRL及LH水平低于对照组;表明腹腔镜手术后辅助使用GnRH-α治疗3个月能够使异位的子宫内膜显著退化,从根本上减轻子宫内膜异位症的症状,达到药物性切除卵巢的作用。腹腔镜手术尽管具有放大视野的效果,但对于肉眼不可见或浸润程度较深的病灶,手术易忽略或难以彻底清除,导致病灶残留[17];GnRH-α能够特异性地结合GnRH受体,使GnRH受体耗竭,FSH和LH水平大幅降低及雌激素水平下降,导致异位内膜显著退化[18]。在用药安全性比较中,2组患者治疗期间均有不同程度的不良反应发生,2组患者不良反应发生率比较差异无统计学意义,且停药后患者的不良反应逐渐消失,未对患者产生严重影响。
综上所述,卵巢子宫内膜异位症腹腔镜手术后给予GnRH-α治疗,能够改善患者疼痛及生殖激素水平,降低复发率,提高临床疗效,且安全性好。
