Ⅰ期肾穿刺造瘘后Ⅱ期经皮肾镜碎石术联合输尿管软镜碎石术治疗复杂性肾结石疗效观察
2019-09-07陈帅奇侯国栋范毛川张新君张会清
朱 峰,陈帅奇,侯国栋,范毛川,张新君,张会清
(新乡医学院第一附属医院泌尿外科,河南 卫辉 453100)
复杂性肾结石通常是指结石直径≥2.5 cm的肾结石,包括多发性肾结石、铸型或鹿角状结石、孤立肾结石、马蹄肾结石、海绵肾结石等[1-3]。经皮肾镜碎石(percutaneous nephrolithotomy,PCNL)一直是治疗复杂性肾结石的首选治疗方案,在临床治疗过程中,单通道有时无法清除所有结石,往往需要多个通道操作以提高结石清除率,但多通道的PCNL会引起术中、术后诸多并发症,比如肾实质损伤、出血、残石等[4]。如何更加有效地治疗复杂性肾结石、提高结石清除率、减少并发症、最大限度保护肾功能是临床医生研究的重点。本研究回顾性分析Ⅰ期行肾穿刺微造瘘、Ⅱ期PCNL联合输尿管软镜碎石(flexible ureteroscopic lithotripsy,FURL)治疗复杂性肾结石患者的临床资料,并与同期行标准通道PCNL治疗患者的临床资料进行对比,探讨Ⅰ期行肾穿刺微造瘘、Ⅱ期PCNL联合FURL治疗复杂性肾结石的疗效及安全性,现报道如下。
1 资料与方法
1.1 一般资料选择2016年10月至2018年7月新乡医学院第一附属医院收治的复杂性肾结石患者57例为研究对象。其中行Ⅰ期肾穿刺微造瘘、Ⅱ期双镜联合碎石治疗26例(观察组),行标准通道PCNL治疗31例(对照组)。观察组:男17例,女9例,年龄29~61(43.6±9.7)岁;结石直径2.9~6.1(4.3±1.7)cm,结石CT值459~1 253(927±323)Hu;左侧11例,右侧15例;合并肾积水9例,严重泌尿系感染4例。对照组:男20例,女11例,年龄为27~53(41.6±9.7)岁;结石直径2.7~5.9(3.9±1.8)cm,结石CT值 573~1 197(871±265)Hu;左侧14例,右侧17例;合并肾积水13例,泌尿系感染7例。所有患者行泌尿系超声、腹部平片、CT泌尿系成像等影像学检查诊断为复杂性肾结石,术前均完善血常规、凝血六项、肝肾功能、肺功能、心脏功能等实验室检查,排除严重脏器疾病及不能手术患者;2组患者性别、年龄、结石直径、结石CT值、结石部位及并发症比较差异无统计学意义,具有可比性(P>0.05)。
1.2 方法
1.2.1 仪器设备韩国库利艾特公司经皮肾穿刺套件(F6-20),德国Storz公司FLEX-XC电子输尿管软镜、二件套叠式肾穿刺套件扩张装置,德国Wolf公司经皮肾镜、F8/9.8输尿管硬镜和取石钳,美国科医人双子星钬激光碎石系统,美国Cyberwand 超声清石系统,美国莱凯公司0.038英寸斑马导丝,美国Boston Scientific 公司超滑导丝、套石篮、F(11-13,12-14)输尿管扩张鞘,德国Storz公司摄像监视系统,江苏德朗液压灌注泵,深圳迈瑞DP-20手提式全数字超声。
1.2.2 手术方法所有患者术前行尿常规、尿路细菌学培养,如有异常给予敏感抗生素治疗,且复查细菌学培养呈阴性,观察组患者术前均留置支架管 5~7 d。观察组患者给予20 g·L-1利多卡因局部浸润麻醉后,21例患者在B超引导下穿刺11肋间、12肋下腋后线至肩胛中线之间的区域,5例因B超引导穿刺位置不佳遂辅助X线下造影穿刺,分别以18G穿刺针穿刺中后组肾盏或积水明显肾盏(肾脏上盏穿刺11例,下盏14例,中盏1例),置入0.038英寸斑马导丝并在其引导下使用Storz公司二件叠套式肾穿刺套件扩张放置F9硅胶管,引流尿液行细菌学培养和药物敏感试验,留置造瘘管5~7 d后行Ⅱ期PCNL联合FURL治疗,所有患者均采用全身麻醉,取过伸截石位,穿刺造瘘侧呈60°抬高暴露(即“斜跨位或骑马射箭位”),在保持患肾造瘘管通畅情况下顺利进镜至膀胱,拔出患侧内预留输尿管内支架管,放置超滑导丝,沿导丝置入输尿管扩张鞘,人工低压注水置入电子输尿管镜,观察输尿管上段即部分肾盂情况及肾造瘘管位置,沿原肾造瘘管放置斑马导丝入患肾集合系统后拔出造瘘管(9例直视下可见,17例无法直视),在斑马导丝引导下依次扩张经皮肾通道至F20并应用拉杆金属扩张器置入F22金属扩张鞘,Wolf经皮肾镜顺利进镜至肾内观察结石,用钬激光或超声碎石系统碎石,肾镜无法到达肾盏结石位置者,较大的可应用输尿管软镜抓篮进行移位后肾镜碎石,较小残留肾盏结石可直接输尿管软镜钬激光碎石后冲出,操作过程中始终从肾造瘘通道灌注泵持续低压注水,反复检查各盏无明显残余结石后留置肾造瘘管及输尿管内支架管,结束手术。
对照组患者均给予全身麻醉,先采用截石位,常规消毒铺巾,连接输尿管进镜后于患侧输尿管内置入斑马导丝后,沿导丝顺利置入F5-6输尿管导管,留置尿管后妥善固定;患者改俯卧位,再次消毒手术部位,B超引导下穿刺11肋间、12肋下腋后线至肩胛中线之间的区域,分别以18G穿刺针穿刺中后组肾盏或积水明显肾盏(其中单通道22例,双通道9例;肾脏上盏穿刺17例,下盏穿刺10例,中盏穿刺4例),应用库利艾特J型导丝置入后并在其引导下依次扩张经皮肾通道至F20并应用拉杆金属扩张器置入F22金属扩张鞘,Wolf经皮肾镜顺利进镜至肾内观察结石,用钬激光或超声弹道清石碎石系统碎石。
1.3 观察指标2组患者手术时间、术中出血量、术后留置肾造瘘管时间、术后住院时间、拔除肾造瘘管后1~2 d并发症发生情况(继发性出血、发热、疼痛、感染等);术中出血量=(术前红细胞比容-术后红细胞比容)/(术前红细胞比容)×体质量(kg)×7%。术后1周行腹部平片检查了解Ⅰ期结石清除率,术后随访3个月。
2 结果
2.1 2组患者完成手术情况观察组患者均顺利完成Ⅰ期肾穿刺微造瘘、Ⅱ期双镜联合碎石手术;对照组患者30例手术顺利完成,穿刺出血1例,术中出血1例,其中1例因出血严重给予留置造瘘,术后1月行二次PCNL手术。
2.2 2组患者手术一般情况比较结果见表1。观察组患者手术时间、术中出血量、术后留置肾造瘘管时间均短于对照组,Ⅰ期结石清除率高于对照组,差异有统计学意义(P<0.05)。2组患者住院时间比较差异无统计学意义(P>0.05)。
表1 2组患者手术一般情况比较
Tab.1 Comparison of general operation conditions between the two groups
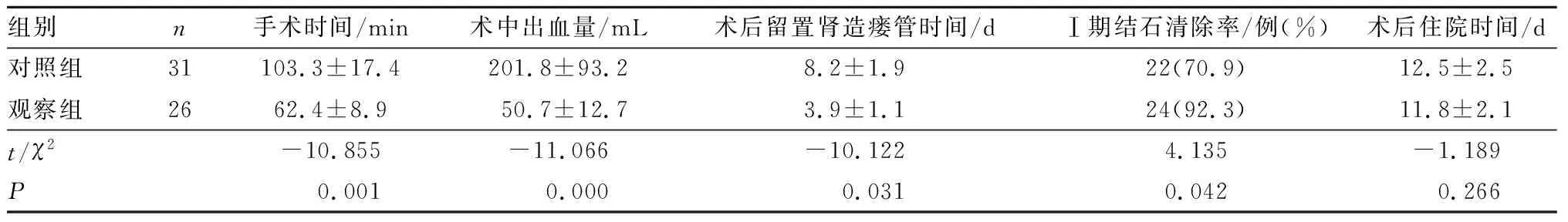
组别n 手术时间/min术中出血量/mL术后留置肾造瘘管时间/dⅠ期结石清除率/例(%) 术后住院时间/d对照组31103.3±17.4 201.8±93.2 8.2±1.922(70.9)12.5±2.5观察组2662.4±8.9 50.7±12.7 3.9±1.124(92.3) 11.8±2.1t/χ2-10.855 -11.066-10.1224.135-1.189P 0.001 0.000 0.0310.0420.266
2.3 2组患者术后不良反应发生情况对照组患者术后发生出血2例,胸腔积液1例,发热2例,术后并发症发生率为16.1%(5/31);观察组患者无并发症发生(0.0%,0/26);观察组患者术后并发症发生率低于对照组,差异有统计学意义(χ2=4.258,P<0.05)。所有患者术后随访3个月,观察组患者1例术后4周行体外冲击波碎石(extracorporeal shock wave lithotripsy,ESWL) 1次,1例行二次FURL治疗,术后3个月结石均顺利排出;对照组患者术后二期行PCNL 2例,FURL 5例,行ESWL 2例,3个月结石清除率为93.5%(29/31),2组患者3月结石清除率比较差异无统计学意义(χ2=1.738,P>0.05)。
3 讨论
尿石症是泌尿外科最常见的疾病之一。随着泌尿外科医疗设备和医疗技术的不断发展进步,腔道微创手术已成为目前治疗泌尿系结石的主要手段,尤其是经皮肾镜结合经尿道输尿管硬镜、软镜几乎可完成全尿路结石的手术治疗[5]。目前,PCNL仍是治疗肾结石的首选治疗手段[6],但复杂性肾结石因结石在肾内的分布、大小、形态、结石成分、肾功能状况等多种原因,导致治疗方法的选择或治疗效果都有许多不足之处,其治疗方案仍未达成共识[7]。大量研究表明,PCNL在术中失血、住院时间、结石清除率及肾功能远期影响等方面相对于开放取石术、ESWL具有优越性[8-11],但PCNL也存在出血、感染等多种并发症[12],单纯的标准通道经PCNL治疗复杂性肾结石存在结石清除率低、残石率高等缺点[13]。HE等[14]研究发现,PCNL联合ESWL可以在一定程度上提高结石清除率,但残石率仍较高;因此,为了提高结石清除率,减少残石,往往采用多通道PCNL,但多通道PCNL会增加术中、术后诸多并发症[15]。近年来,双镜联合手术正逐步应用于临床,其中包括腹腔镜联合膀胱软镜[16-17]、机器人联合腔镜[18]、输尿管软镜联合经皮肾镜等;随着输尿管软镜技术和设备的不断进步发展,输尿管软镜联合肾镜治疗复杂性肾结石越来越受到广大泌尿外科医生的重视,已有大量文献研究表明PCNL联合FURL治疗复杂性肾结石尤其是鹿角样结石具有不可替代的优势[19-21];但目前国内外对于双镜联合治疗复杂性肾结石的手术方案及手术时机仍没有统一共识,国内大部分学者仍主张Ⅰ期行PCNL治疗,Ⅱ期行FURL处理肾脏残石,其原因主要是Ⅰ期FURL可有效避免Ⅱ期PCNL出血导致视野不清无法行软镜碎石取石的风险[22-24];也有学者主张I 期行PCNL联合FURL治疗复杂性肾结石[25],Ⅰ期PCNL联合FURL往往要求临床医生具有较高的穿刺技巧和丰富的手术经验,否则可能导致双镜联合碎石手术失败。
作者结合临床工作实际,将Ⅰ期经皮肾穿刺造瘘在B超引导、局部麻醉下提前完成。国外研究表明,对于复杂性肾结石穿刺上盏、下盏均为安全且有较高结石清石率[26-27]。本研究中,观察组穿刺选择上盏和下盏通道分别为14例和10例,中盏2例,穿刺均顺利无出血,II 期手术均顺利完成,且观察组患者手术时间、术中出血量、术后留置肾造瘘管时间短于对照组,I 期结石清除率高于对照组,原因可能为I 期B超引导下穿刺可选择性强,可有效保证经皮肾穿刺造瘘的准确性,且复杂性肾结石往往合并肾积水,多为感染性结石,肾穿刺造瘘能明显减少术中、术后感染风险,这与国内相关研究[28]结论一致;对照组患者术中出血2例,1例留置肾造瘘管,术后1月行二次PCNL治疗,1例保守治疗后痊愈。观察组患者Ⅱ期穿刺扩张及术中、术后均无出血,部分患者可在软镜直视下穿刺,避免了穿刺的盲目性,尤其是避免穿刺过深风险,其次留置肾造瘘管 5~7 d,造瘘通道成熟,II 期治疗有效避免了穿刺扩张出血风险,从而保证了双镜联合手术中的视野清晰,提高了软镜操作的精确和有效性,降低了手术失败及并发症发生的风险,大大提高了结石清除率,这是本研究I 期术后结石清除率明显高于经皮肾镜碎石取石的主要原因之一。
总之,复杂性肾结石治疗存在挑战,PCNL仍是主要治疗手段,而PCNL联合FURL作为有效的辅助治疗手段正受到越来越多的泌尿外科医生的重视,本研究将Ⅰ期双镜联合碎石取石术分两步进行,不但保留了双镜联合碎石取石的优势,而且做到了穿刺的精准性,且有效降低了术中穿刺扩张、术后出血风险,提高了双镜联合碎石取石的有效性,同时减少了术中感染及术后发热的概率,可作为复杂性肾结石尤其是合并积水感染结石患者的可选择治疗手段,尤其是对于基层医院及医院技术设备尚不完备者更加有应用价值;但其与Ⅰ期双镜联合碎石取石治疗比较是否有明显优势,仍需进一步的临床对照研究。
