TRM43355放线菌中蛋白对白色念珠菌生物膜形成的影响
2019-09-04袁琳琳赵小亮
袁琳琳 赵小亮 曾 红*
(1新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室,新疆阿拉尔843300)(2塔里木大学生命科学学院,新疆阿拉尔843300)
白色念珠菌(Canidia albicans)一种条件治病真菌,当机体免疫功能下降时,白色念珠菌将大量繁殖入侵机体细胞导致疾病发生[1]。菌群与上皮细胞表面的受体结合并分泌出胞外多糖或蛋白,形成的膜状物,即生物膜。与浮游细胞相比,生物膜将自身包裹在自发粘附的多糖和蛋白质层中,使白色念珠菌粘附到表面,可防治药物的杀菌作用[2],具有抵抗更高水平的抗真菌剂的能力,并且可以产生对常用治疗的耐受性[3]。生物膜的形成是白色念珠菌产生耐药性的主要原因之一[4]。因此,筛选生物膜抑制剂的研究方向具有很大意义。
目前,治疗白色念珠菌感染的药物主要包括多烯,唑类,棘白菌素几类[5-7],其中每一类通过特定的方式达到相应的抗菌效果。但是每一类都有相应的缺点,不能完全根治。为了克服病原菌的耐药性从微生物源次生代谢产物中寻找能抑制白色念珠菌生物膜形成的活性物质显得尤为重要。
放线菌能够产生丰富的代谢产物,是挖掘生物活性物质的天然宝库。但是放线菌次生代谢产物的开发与利用只占总体的1%,还有99%未开发利用,对我们来说是很大的资源,尤其是链霉菌,受到特别关注。在这耐药性增加的时代,微生物源代谢产物抑制生物膜的生长,而不杀死宿主细胞,可能为新药的研发候选材料。基于前期预实验发现放线菌TRM43355发酵液对白色念珠菌ATCC 64550的生物膜具有较好抑制作用,于是针对菌株TRM43355次级代谢产物进行深入研究。本实验以白色念珠菌为靶标病原菌,以放线菌TRM43355为研究材料,放线菌TRM43355发酵液中粗蛋白通过硫酸铵盐析法获得粗蛋白,采用微孔板半定量法检测活性物质对白色念珠菌生物膜形成的影响,确定其抑制白色念珠菌生物膜形成的活性物质。初步探索活性蛋白抑制白色念珠菌生物膜形成的最小生物膜清除浓度(MBEC)并研究不同理化因素(pH、温度、金属离子、有机溶剂)对蛋白活性的影响。
综上所述,白色念珠菌作为目前比较常见的致病菌,对抑制其生物膜形成的物质研究较广,本实验从放线菌次级代谢产物中提取抑制白色念珠菌生物膜的蛋白并探索其环境条件,为抗真菌药物的治疗和抗膜剂新药的研发奠定了理论基础。
1 材料与方法
1.1 材料
1.1.1 实验仪器
高速冷冻离心机,高压灭菌锅,电子天平,96孔板,恒温振荡仪,酶标仪
1.1.2 菌株来源
致病菌株:白色念珠菌ATCC 64550(Canidia albicansATCC 64550),购于美国典型培养物保藏中心ATCC。拮抗菌株:放线菌菌株TRM43355分离于新疆阿拉尔市塔克拉玛干沙漠的流动风沙。
1.1.3 实验培养基及试剂
高氏一号培养基(1 L);AM6培养基(1 L);YPD培养基;SDB培养基,培养见《微生物实验指导》。
试剂:(NH4)2SO3;CuSO4·5H2O;FeSO4·7H2O;Mn-SO4·H2O;ZnSO4·7H2O;CH3OH。
1.2 方法
1.2.1 放线菌TRM43355的分类学鉴定
根据张仁文[8]等报道的用酶解法提取链霉菌基因组总DNA并进行16S rRNA基因的PCR扩增,并委托上海生物工程有限公司测序。使用EzTaxon数据库与来自最密切相关的链霉菌属物种的序列进行多重比对,以及序列相似性的计算。通过MEGA软件中邻接法(Neighbor-Joining,NJ)构建系统发育树[9-10],明确其分类学地位。
1.2.2 菌株TRM43355发酵液的制备
将放线菌菌株TRM43355接种于高氏一号固体培养基于37℃培养5-7 d。将单菌落接种于AM6液体发酵培养基,每瓶150 mL,37℃,180 r/min振荡培养7-10 d。发酵液用纱布过滤,除去大颗粒的菌体,再用50 mL离心管,10000 r/min离心10 min,以备后续使用。
1.2.3 菌株TRM43355发酵液粗提物制备
将发酵液分别通过D-101大孔树脂吸附[8],分别用30%、50%、70%、95%甲醇洗脱,收集不同阶段组分,膏状50℃烘干备用。称取适量浸膏用5%DMSO溶解,过0.22µm无菌微孔滤膜,-20℃待用。
1.2.4 菌株TRM43355发酵液粗蛋白提取
将放线菌菌株TRM43355的发酵液用纱布过滤后,10000 r/min离心10 min,收集上清,再按70%的浓度加入饱和硫酸铵[11],置于搅拌30 min,4℃静置过夜,10000 r/min低温高速离心15 min,收集沉淀。用少量PBS(磷酸盐缓冲液)溶解沉淀,用MW8000-10000的透析袋4℃透析48 h。奈氏试剂检测透析液中的NH4+是否残留。将无残留PBS溶解的粗蛋白溶液冷冻抽干,存放-20℃备用。
1.3 活性检测
1.3.1 不同蛋白浓度对白色念珠菌生物膜形成能力的影响
采用微孔板半定量方法[12]检测蛋白对念珠菌生物膜形成能力的影响。用PBS配制蛋白母液浓度为2 mg/mL,经过0.22µm微孔滤膜过滤,置于96孔板中,进行倍性稀释,获得蛋白浓度为1000~3.91µg/mL[13-14]检测不同蛋白浓度对白色念珠菌生物膜形成能力的影响。
1.3.2 菌株TRM43355发酵液产物和粗蛋白对白色念珠菌生物膜形成能力的影响
取100µL的菌株TRM43355发酵液分段产物溶液(30%、50%、70%、95%不同甲醇相组分浸膏)和100µL的菌液(将培养72 h白色念珠菌菌液按1:10稀释,菌液浓度为1.205×107CFU/mL)加至96孔板中,混匀,4个孔为一组平行实验。37℃培养箱静置培养72 h后用酶标仪检测生物生长量,蒸馏水冲洗三次,洗去未黏附的浮游真菌,60℃烘箱1 h,用0.5%结晶紫染色5 min,用蒸馏水冲洗后室温下自然晾干,用酶标仪测定ATCC 64550白色念珠菌生物膜形成能力,相对生物膜形成能力=(处理组OD490/空白对照OD490)×100。
1.4 粗蛋白经过不同理化因素处理后对白色念珠菌生物膜形成能力的影响
1.4.1 粗蛋白经过不同pH处理后对白色念珠菌生物膜形成能力的影响
为探究不同pH值对蛋白稳定性的影响,分别用pH值为3、5、7、9、11的PBS(磷酸缓冲溶液)溶解样品,配制最终浓度为2 mg/mL的粗蛋白溶液,0.22µm无菌微孔滤膜除菌,微孔板半定量法检测不同pH值处理后的粗蛋白对白色念珠菌生物膜形成能力的影响。
1.4.2 粗蛋白经过不同温度处理后对白色念珠菌生物膜形成能力的影响
为探究温度对蛋白稳定性的影响,配制粗蛋白浓度为2 mg/mL,分别经过不同温度(30℃、40℃、60℃、80℃、100℃)处理30 min,未经水浴处理的-20℃为未处理组。分别过0.22µm微孔滤膜,利用微孔板半定量法检测不同温度处理后的粗蛋白对白色念珠菌生物膜形成能力的影响。
1.4.3 粗蛋白经过不同金属离子处理后对白色念珠菌生物膜形成能力的影响
为进一步探究粗蛋白的稳定性,用不同的金属离子处理粗蛋白,金属离子分别为Fe2+、Zn2+、Mn2+,Cu2+未经金属离子处理的粗蛋白为未处理组。金属离子配置母液浓度为5 mmol/mL,不同金属离子溶液梯度稀释,并加入100µL稀释的菌悬液,混合均匀,37℃培养箱静置培养72 h。利用微孔板半定量法检测不同金属离子处理后的粗蛋白对白色念珠菌生物膜形成能力的影响。
1.4.4 粗蛋白经过不同有机溶剂处理后对白色念珠菌生物膜形成能力的影响
用不同有机溶剂处理粗蛋白,探究蛋白的稳定性,选择的有机溶剂分别为乙酸乙酯、氯仿、石油醚、丙酮。配制浓度为2 mg/mL蛋白溶液,按1:1比例加入有机溶剂(乙酸乙酯、氯仿、石油醚、丙酮)室温下静置2 h,自然风干至粉末。利用微孔板半定量法检测不同有机溶剂处理后的粗蛋白对白色念珠菌生物膜形成能力的影响。
1.5 数据处理与分析
以上实验数据均采用平均值±标准差形式表示以减少结果误差,使用软件Graphpad prism 5进行绘图分析。
2 结果与分析
2.1 菌株TRM43355分类学鉴定
TRM 43355经过16S rRNA基因序列比对分析结果表明此菌株属于链霉菌属,与数据库中Streptomyces barkulensisRC 1831T具有最高相似性,相似度为99.06%。与其它链霉菌属种亲缘关系如图1所示。

图1 菌株TRM43355基于16S rRNA基因序列邻接法系统进化发育树
2.2 发酵液不同组分及粗蛋白对白色念珠菌生物膜形成能力的影响
使用微孔板半定量法检测发酵液的提取物对白色念珠菌ATCC 64550生物膜形成的影响。如图2所示,菌株TRM 43355的粗蛋白对白色念珠菌生物膜形成具有很好的抑制效果,抑制率高达88.12%,其70%、95%甲醇洗脱分子的活性也比较显著。后续实验就放线菌TRM 43355发酵液中的粗蛋白深入研究。
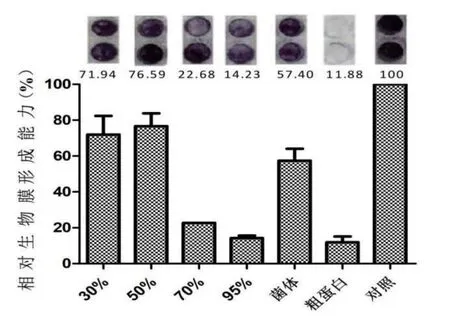
图2 菌株TRM43355发酵液提取物对白色念珠菌生物膜形成能力的影响
2.3 不同浓度粗蛋白对白色念珠菌生物膜形成的影响
为了确定菌株TRM 43355发酵液中蛋白对白色念珠菌生物膜形成的最小抑膜浓度,用不同浓度蛋白,采用微孔板定量法测试活性。如图3所示,粗蛋白浓度为2 mg/mL时对白色念珠菌生物膜形成抑制率为93%。当蛋白浓度0.25 mg/mL、0.5 mg/mL和1 mg/mL时相对生物膜形成能力分别为96.31%、82.98%和86.89%,当蛋白浓度为2 mg/mL、2.5 mg/mL和3 mg/mL时相对生物膜形成能力分别为6.48%、7.71%和7.75%;蛋白浓度为0.25 mg/mL、0.5 mg/mL和1 mg/mL时几乎不能达到抑制生物膜的效果,蛋白浓度为2 mg/mL、2.5 mg/mL和3 mg/mL时抑制生物膜的效果较好,抑制率可达90%以上,因此不同的蛋白浓度对白色念珠菌生物膜形成影响较大,蛋白浓度越高生物膜形成能力越弱,抑制率越强;浓度为2 mg/mL的蛋白浓度为最佳,继而后续活性测试都采用蛋白浓度为2 mg/mL。
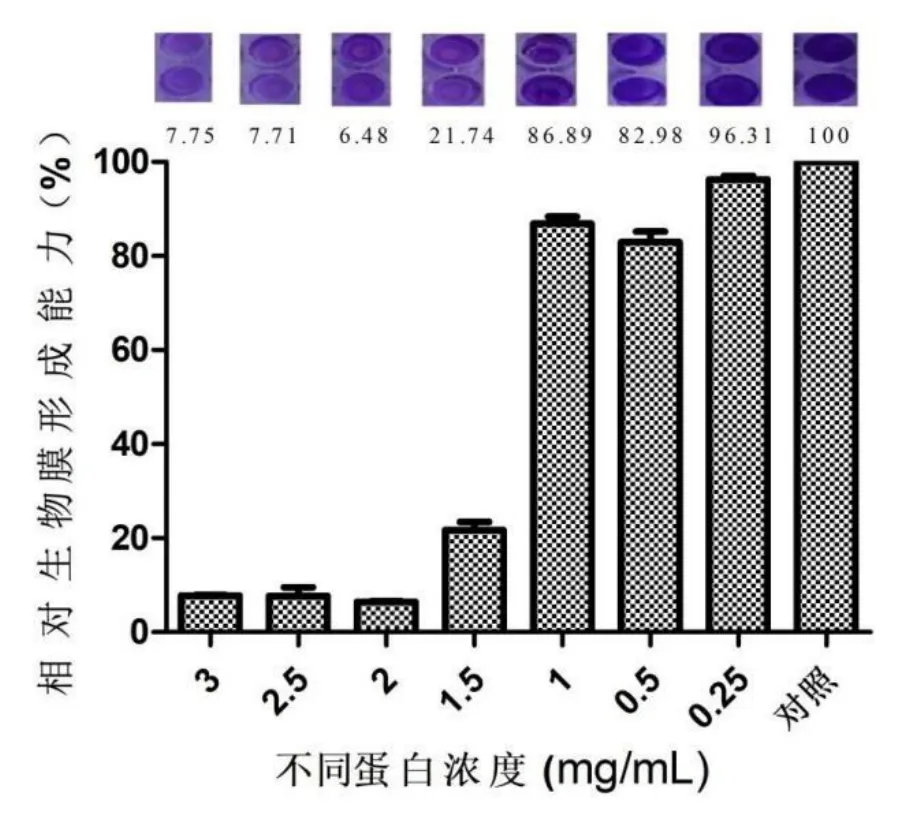
图3 不同浓度粗蛋白对白色念珠菌生物膜形成能力的影响
2.4 粗蛋白经过不同理化因素处理后对白色念珠菌生物膜形成的影响
2.4.1 粗蛋白经不同pH处理后对白色念珠菌生物膜形成的影响
实验为探讨不同pH处理后的蛋白对白色念珠菌生物膜形成的影响,用不同pH处理蛋白,并进行活性检测,pH值为7时处理的蛋白为未处理组,结果如图4所示,当蛋白pH值为3时相对生物膜形成能力为6.57%;当蛋白pH值为5时相对生物膜形成能力为22.9%;当蛋白pH值为7时相对生物膜形成能力为39.79%;当蛋白pH值为9时相对生物膜形成能力为12.74%;当蛋白pH值为11时相对生物膜形成能力为19.58%。实验结果发现,通过不同pH处理的粗蛋白对白色念珠菌生物形成能力的影响并不大,pH值为3时生物膜形成能力最差,其抑制白色念珠菌生物膜的活性最好,pH值为9时次之。
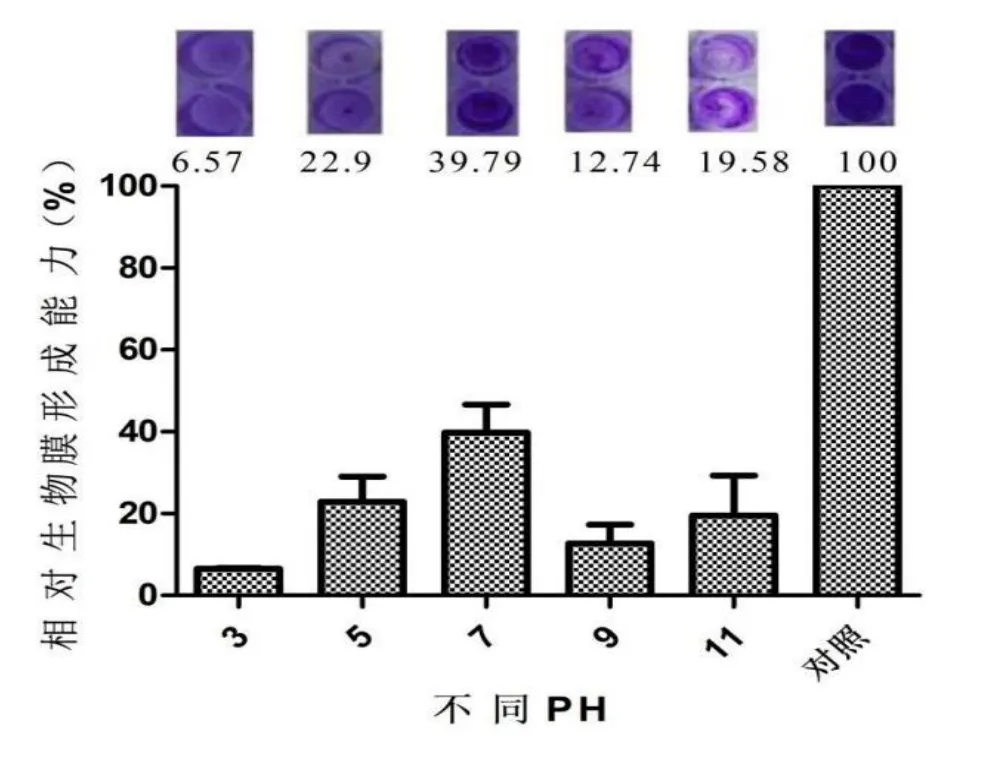
图4 pH对粗蛋白抑制白色念珠菌生物膜形成能力的影响
2.4.2 粗蛋白经不同温度处理后对抑制白色念珠菌生物膜形成的影响
实验为探讨温度对蛋白质活性的影响,把温度-20℃设为未处理组,处理组的温度分别设置为:30℃、40℃、60℃、80℃和100℃,结果如图5所示,当蛋白质经过-20℃处理后相对生物膜形成能力为33.3%,当蛋白质经过30℃处理后相对生物膜形成能力为13.39%,当蛋白质经过40℃处理后相对生物膜形成能力为11.07%,当蛋白质经过60℃处理后相对生物膜形成能力为9.88%,当蛋白质经过80℃处理后相对生物膜形成能力为87.89%,当蛋白质经过100℃处理后相对生物膜形成能力为97.43%。实验结果可知当蛋白质经过80℃以上高温处理后抑制白色念珠菌生物膜形成的活性基本丧失,故此80℃以上的高温环境蛋白失活。
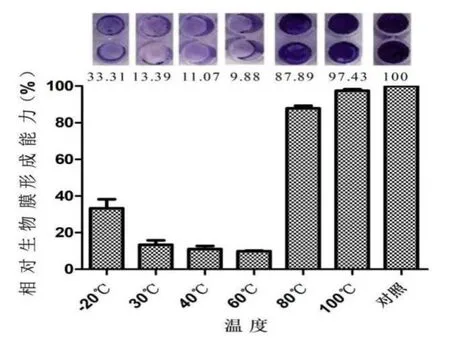
图5 温度对粗蛋白质抑制白色念珠菌生物膜形成能力的影响
2.4.3 粗蛋白经不同金属离子处理后对白色念珠菌生物膜形成的影响
本实验研究金属离子对蛋白质活性的影响,所以需先探索金属离子本身对生物膜的影响,见图6,由图6-a可知,当铁离子浓度0.312 mmol/mL时对生物膜基本没有影响,因此后续实验选择小于或等于0.312 mmol/mL;图6-b,可知当锌离子浓度为0.625 mmol/mL时几乎没有影响生物膜形成,故后续实验选用锌离子浓度小于或等于0.625 mmol/mL;由图6-c可知,锰离子身就对生物膜形成几乎没有影响;实验中还测试铜离子对生物膜形成的影响,但是铜离子无论浓度高低对生物膜形成有巨大影响,因此铜离子不做后续实验,综上所述最终金属离子浓度统一为0.312 mmol/mL。不同金属离子处理的粗蛋白对生物膜形成能力的影响如图6-d所示,粗蛋白经铁离子处理后其白色念珠菌相对生物膜形成能力14.06%;经锰离子处理后其生物膜形成能力为9.85%;经锌离子离子处理后其生物膜形成能力为7.56%;未用金属离子处理组其生物膜形成能力为39.79%。从实验数据明显发现Zn2+处理蛋白后抑制生物膜效果最好,抑制率高可达92.44%。

图6 粗蛋白经不同金属离子处理后对白色念珠菌生物膜形成能力的影响
2.4.4粗蛋白经不同有机溶剂处理后对白色念珠菌生物膜形成能力的影响
实验为探讨不同有机溶剂对蛋白活性的影响,结果如图7所示,当蛋白经乙酸乙酯处理后,其白色念珠菌相对生物膜形成能力为6.75%;当蛋白质经氯仿处理后,其白色念珠菌相对生物膜形成能力为10.86%;当蛋白经石油醚处理后,其白色念珠菌相对生物膜形成能力为7.91%;当蛋白经丙酮处理后,其白色念珠菌相对生物膜形成能力为9.05%;未处理组为39.79%。以上结果表明粗蛋白经过有机溶剂处理过后抑制生物膜的活性都有所提高。
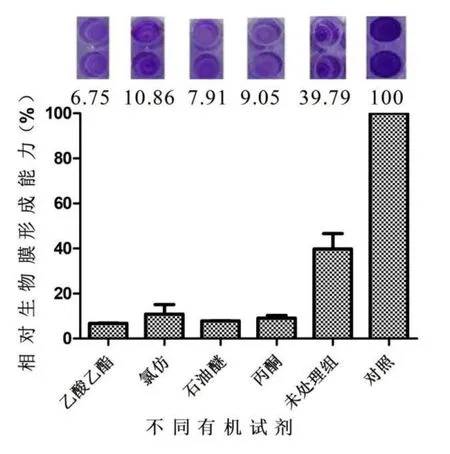
图7 蛋白经不同有机试剂处理后对白色念珠菌生物膜形成能力的影响
3 结果与讨论
生物膜起到屏障保护作用,使药物很难作用菌群,因此生物膜的形成是白色念珠菌产生耐药性主要原因之一。白色念珠菌对大部分抗真菌药物产生多重耐药性,这些使得白色念珠菌感染对人类健康产生更大的威胁。为了发现和开发低毒性和高治疗活性的新型抗真菌剂,专家们试图从天然产物(植物,动物,微生物)中寻找。例如植物来源的姜黄素[15],厚朴酚[16],和厚朴酚[17],柠檬烯[18]等对白色念珠菌生物膜的形成具有较好的抑制作用;动物来源的蛙皮抗菌肽-S1可抑制白色念珠菌生物膜的形成[19];微生物来源的土壤链霉菌菌株98%乙醇提取物[20],冠霉素链霉菌ADP4乙酸乙酯粗提取物[21]、海洋细菌枯草芽孢杆菌的5-羟甲基-2-糠醛(5HM2F)[22]、粪肠球菌细菌素 EntV[23]等对白色念珠菌的生物膜也具有较好的抑制效果。天然衍生的化学抗真菌剂是一种有吸引力的选择,特别是那些微生物衍生的分子,由于它们对机体的刺激性小,毒性小,同时也不易使病原菌发现采取防护措施。目前开发的大部分抗生素都源于放线菌,它被广泛认为是新抗生素产生菌群的重要菌种,是开发价值相当高的一类微生物。
本实验以一株分离于新疆塔克拉玛干沙漠流动风沙的放线菌为研究对象,采用微孔板半定量法检测该菌株发酵液不同组分及粗蛋白对白色念珠菌ATCC 64550生物膜形成的影响,活性最好得部位为粗蛋白,其抑膜率达到88.12%,因此针对菌株TRM 43355发酵液粗蛋白抑制白色念珠菌生物膜形成做如下探究。
对放线菌TRM43355发酵液粗蛋白抑制白色念珠菌生物膜形成的最小抑膜浓度[24]进行初步探索,测得菌株TRM43355代谢产物蛋白对白色念珠菌生物膜的最小抑膜浓度为2 mg/mL。并探究pH、温度、金属离子等不同理化因素对蛋白活性的影响。探究pH对蛋白活性的影响时发现通过不同pH处理后粗蛋白对白色念珠菌生物膜形成能力的影响并不大。pH值为3时处理的粗蛋白生物膜形成能力最低,其抑制膜活性最高,pH值为9时次之。探究温度对蛋白活性的影响时发现当粗蛋白经过60℃水浴处理后生物膜形成能力最低,抑膜率达到90%以上,但是当蛋白质经过80℃以上高温处理后抑膜的作用基本丧失,说明80℃以上的高温环境能使活性蛋白失活,故此可判断该蛋白不耐高温。探究金属离子对蛋白活性的影响时,首先探索金属离子本身对生物膜的影响,发现锰离子本身对生物膜形成没有影响,铁离子和锌离子浓度在小于或等于0.312 mmol/mL时对生物膜基本没有影响,但Cu2+任何浓度对生物膜的形成有影响,经查阅胡学伟等Cu2+对生物膜及其胞外聚合物的影响[25],可知Cu2+会与生物膜上的胞外多糖结合,从而抑制了生物膜生长,与本实验结论相近,因此不讨论铜离子对蛋白的活性影响。经过锌离子处理的蛋白抑制生物膜活性为最佳,锰离子次之,未处理组最差,说三种明金属离子(Fe2+,Zn2+,Mn2+)均能促进蛋白抑膜效果。以上结果和经有机溶剂(乙酸乙酯,氯仿,石油醚,丙酮)处理过的蛋白效果相同,至于为什么加入金属离子和不同有机溶剂能达到促进的效果值得进一步的研究。本论文的研究拓展了菌株TRM43355代谢产物蛋白有较高的抑制白色念珠菌生物膜形成的活性,并初步探索其蛋白质经不同理化因素处理后的活性变化,为寻找抑制白色念珠菌生物膜形成的活性物质提供了更多的方向。
