CDR1as在喉鳞状细胞癌中的作用机制研究
2019-09-03张建中赵耀新胡华勇王燕玲黄海琼蔡刚
张建中,赵耀新,胡华勇,王燕玲,黄海琼,蔡刚
(广州医科大学附属第五医院耳鼻喉科,广东 广州 510700)
喉鳞状细胞癌(laryngeal squamous cell carcinoma,LSCC)是仅次于肺癌的常见呼吸道恶性肿瘤,其发病率逐年增长,2016年约13 430例新发喉癌被确诊、3 620例患者死亡[1]。近年来浸润性LSCC患者5年生存率反而从66%减少至63%,可能与缺乏明确的诊断、术后局部及区域性复发、保喉治疗(包括放化疗)增多及相关的放化疗抵抗有关[2-3],进一步明确LSCC发病潜在的分子机制、寻找更有效的治疗方法成为临床研究的热点。
真核细胞中转录生成的RNA中,95%为非编码RNA,包括短链微RNA、长链非编码RNA和环状RNA[4]。环状RNA是最近在哺乳动物中发现的内源性非编码、高度保守、以共价环存在的RNA分子,具有基因调节作用。小脑变性相关蛋白1反义转录物(cerebellar degeneration-related protein 1 antisense,CDR1as)是最近发现的一种环状RNA,其在胰腺细胞内过表达可显著促进胰岛素合成与分泌[5],动物脑组织中CDR1as表达不足或缺乏可导致感知能力损害[6],CDR1as也被证实在胃癌、结直肠癌和肝癌细胞中过表达[7-9]。我们前期研究发现CDR1as在LSCC细胞中高表达,认为其高表达是判断预后不良的指标之一。本研究探讨上调和敲除CDR1as对LSCC细胞的影响,分析其与微RNA-7(microRNA-7,miR-7)表达的关系及其在LSCC发病中的作用机制,为寻找新的治疗途径和靶点提供参考。
1 材料和方法
1.1 主要实验材料
TRIzol试剂、脂质体2000、RPMI 1640培养基、胎牛血清、CCK-8试剂盒、反转录试剂盒(广州维伯鑫)。人喉鳞状细胞癌细胞株Hep-2和AMC-HN-8均购自中国科技大学细胞库,细胞接种于含10%胎牛血清的RPMI 1640培养基中,置于37 ℃、5%CO2培养箱中培养,隔日换液。
1.2 细胞转染及分组
由广州莱博生物科技有限公司合成miR-7 mimics及CDR1as-shRNA。Hep-2和AMC-HN-8细胞接种于12孔培养板,分别转染空白及携带CDR1as、CDR1as-shRNA、miR-7 mimic脂质体2000,均严格按说明书操作。将细胞分为空白对照组(Ⅰ组)、CDR1as组(Ⅱ组)、空转染对照组(Ⅲ组)、转染CDR1as-shRNA组(Ⅳ组),检测CDR1as对Hep-2和AMC-HN-8细胞的作用。检测CDR1as调节miR-7靶基因及蛋白作用的实验中,细胞分为4组,分别为空白对照组(Ⅰ组)、转染miR-7 mimics组(Ⅱ组)、转染CDR1as组(Ⅲ组)、转染CDR1as+miR-7 mimics组(Ⅳ组)。
1.3 细胞活性检测
转染的细胞系培养成熟后,使用PBS冲洗,按CCK-8试剂盒说明书操作,酶标记法测量450 nm波长吸光度值分析细胞活性。
1.4 克隆形成检测
收获过表达CDR1as或(和)miR-7的细胞系,重悬于含10%胎牛血清的完全培养基中,然后接种于12孔板中培养10 d,0.1%结晶紫染色,甲醇处理15 min,荧光显微镜下观察,记录大于50个细胞的克隆细胞集落。
1.5 细胞凋亡检测
细胞使用碘化丙啶染色,37 ℃避光保存30 min后检测细胞周期。-20 ℃条件下70%乙醇处理细胞2 h后进行细胞凋亡检测。加入10 mg/mL核糖核酸酶,按照说明书操作,用2 μL annexin V和2 μL碘化丙啶染色,流式细胞术进行检测。
1.6 迁徙和侵袭能力检测
采用Transwell实验检测细胞迁徙和侵袭能力。将转染CDR1as或(和)miR-7的细胞加到无被覆Transwell小室的上室中检测细胞侵袭。发生迁徙和侵袭的肿瘤细胞被基底膜基质覆盖,未发生迁移和侵袭的细胞用棉签移除,结晶紫染色,显微镜下随机选择5个视野进行细胞计数。
1.7 免疫印迹
使用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离提取的细胞总蛋白,将蛋白带转移到硝化纤维膜上,室温下TBST液中以5%脱脂牛奶封闭1 h。以GAPDH作为内参照,加入特异性一抗室温孵育过夜,TBST液充分洗膜,加入HRP交联二抗室温孵育1 h,TBST液冲洗,加入ECL发光液显影。
1.8 实时定量PCR
按TRIzol试剂盒说明书提取细胞总RNA,使用反转录试剂盒反转录生成cRNA。以GAPDH为内参照,实时定量PCR检测CDR1as、miR-7、细胞周期蛋白E1(CCNE1)、磷脂酰肌醇-3激酶催化亚基δ(PIK3CD) mRNA表达。引物序列:CDR1as上游引物5′-TAGTACGTCGTGCCCTGA-3′,下游引物5′-CACTTGACGTGCAGCATC-3′; miR-7上游引物5′-CCACGTTGGAAGACTAGTGATTT-3′,下游引物5′-TATGGTTGTTCTGCTCTCTGTCTC-3′; CCNE1上游引物5′-ATGAAGAAGTTGAACCATGCCA-3′,下游引物5′-CCTCCAGAACAGTATTCCATTGC-3′; PIK3CD上游引物5′-AAGGAGGAGAATCAGAGCGTT-3′,下游引物5′-GAAGAGCGGCTCATACTGGG-3′;GAPDH上游引物5′-ACACCCACTCCTCCACCTTT-3′,下游引物5′-TTACTCCTTGGAGGCCATGT-3′。PCR扩增步骤:95 ℃ 10 s,94 ℃ 3 s,60 ℃ 30 s,72 ℃ 30 s,40个循环。实验重复3次,用2-△△Ct法计算目的基因的表达量。
1.9 荧光免疫组织化学
参照文献[10]采用荧光免疫组织化学检测各组细胞CCNE1和PIK3CD蛋白表达,以Ki-67表达为阳性对照。
1.10 统计分析
采用SPSS 16.0软件分析处理数据。两组数据组间比较用t检验或U检验,多组数据组间比较用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 CDR1as mRNA表达检测
实时定量PCR显示,与空白对照组比较,转染CDR1as后Hep-2和AMC-HN-8细胞CDR1as mRNA表达均显著增加,而转染CDR1as-shRNA后CDR1as mRNA表达均显著降低(均P<0.01)。见图1。显示Hep-2和AMC-HN-8细胞过表达和敲除CDR1as基因模型构建成功。
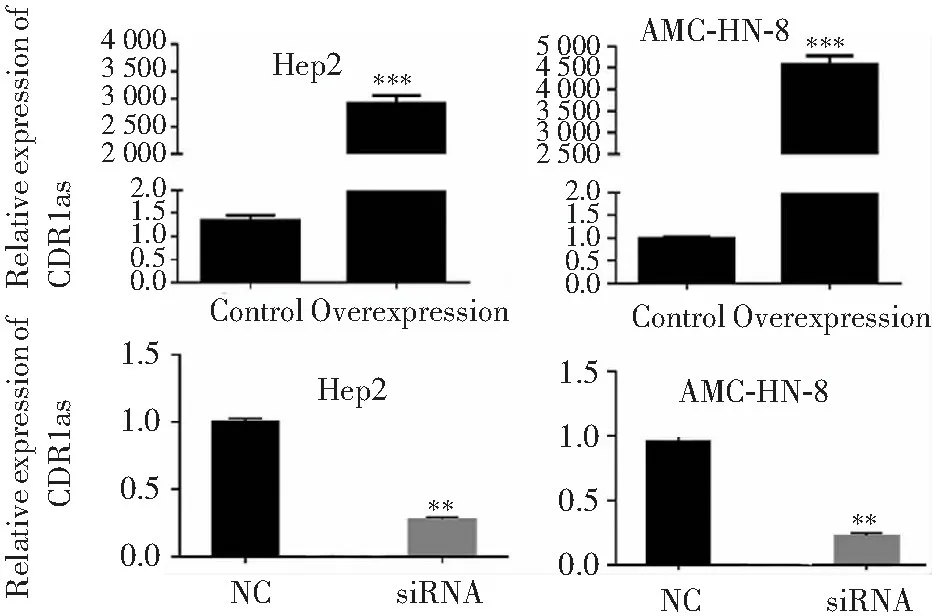
注:组间比较,**P<0.01,***P<0.001
图1 转染CDR1as、CDR1as-shRNA后两种细胞系CDR1as mRNA表达检测(实时定量PCR)
2.2 细胞活性检测
与对照组相比,转染CDR1as后两种细胞系细胞活性均明显增加;与空染组相比,转染CDR1as-shRNA后两种细胞系细胞活性均明显降低(均P<0.05);而空染组与对照组相比细胞活性差异无统计学意义(P>0.05)。见图2。显示过表达CDR1as可增加肿瘤细胞活性,敲除CDR1as后细胞活性明显降低。
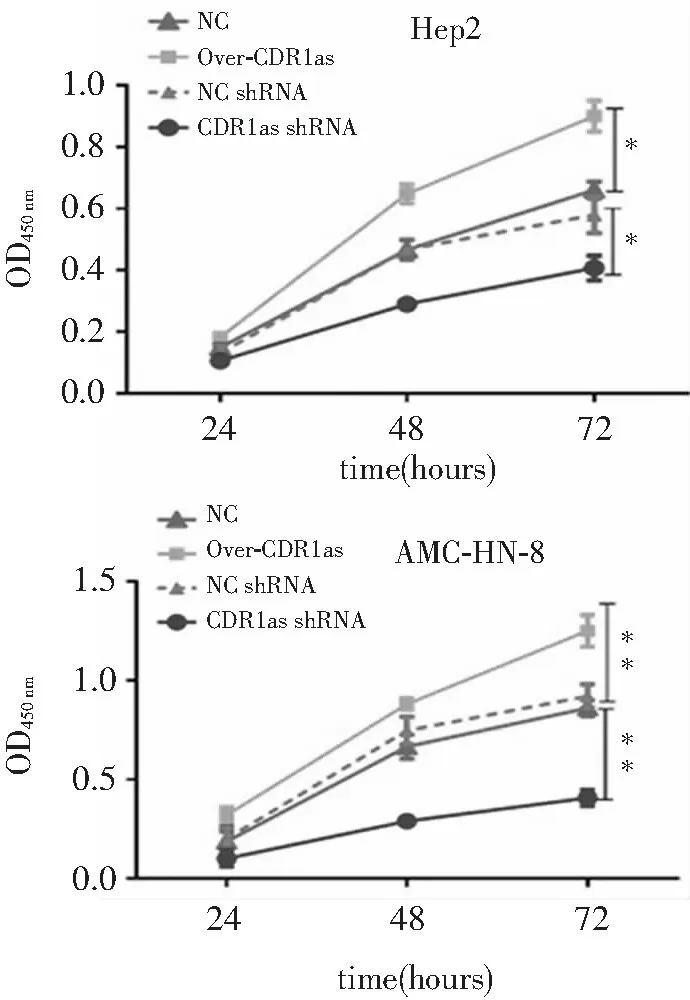
注:组间比较,*P<0.05,**P<0.01
图2 转染CDR1as、NC-shRNA、CDR1as-shRNA后两种细胞系细胞活性检测(CCK-8法)
2.3 细胞分化和细胞集落形成检测
转染CDR1as后两种细胞系细胞分化及细胞集落形成均明显增加,而转染CDR1as-shRNA后细胞分化及细胞集落形成均明显受到抑制(均P<0.01)。见图3,图4。显示过表达CDR1as导致细胞分化增加、细胞集落形成增多,而敲除CDR1as后上述作用被抑制。
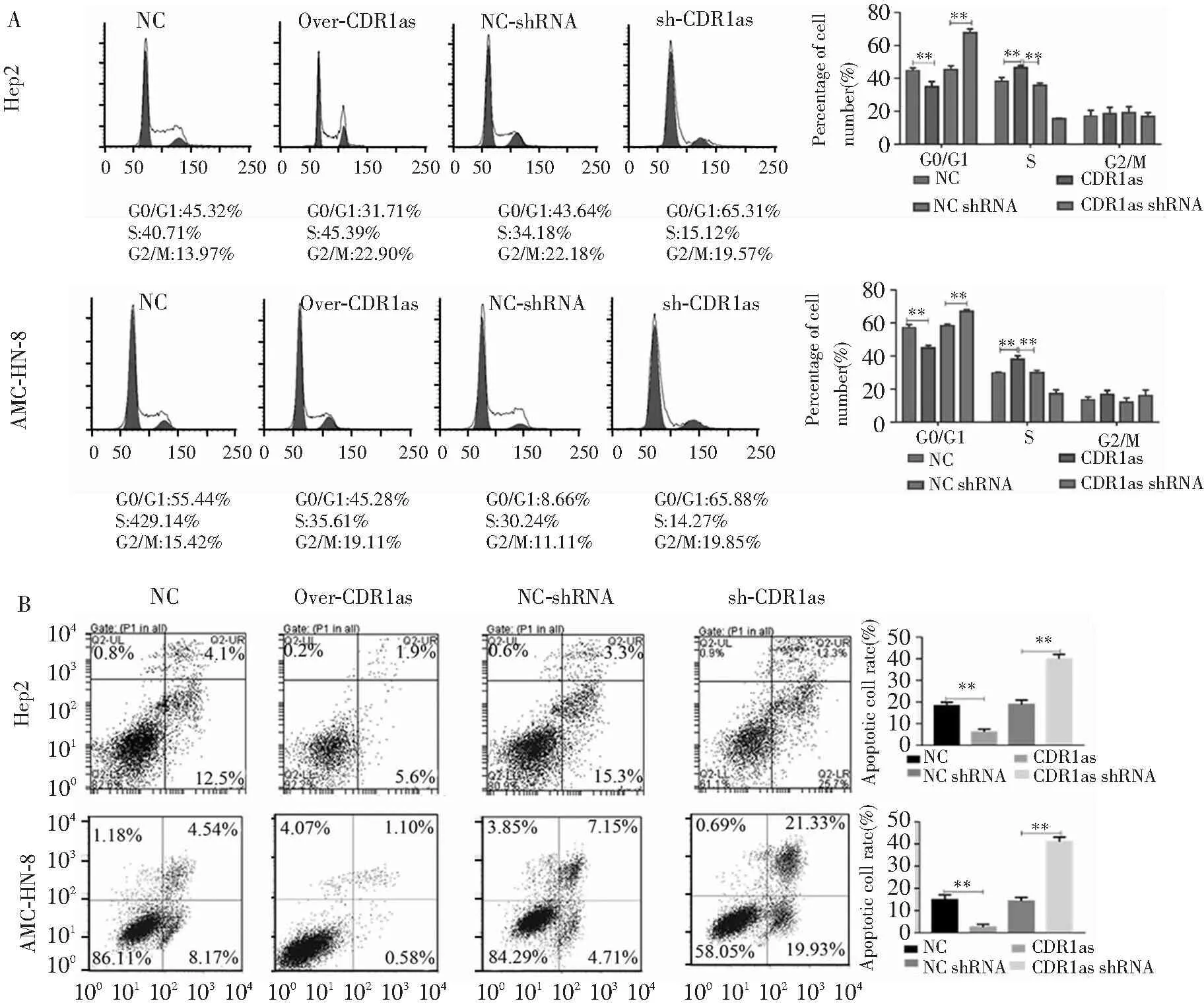
2.4 细胞周期和细胞凋亡检测
转染CDR1as后两种细胞系细胞停留于S期,细胞合成、分裂能力增强;而转染CDR1as-shRNA后细胞停留在G0/G1期,诱导凋亡(均P<0.01)。见图5。显示过表达CDR1as能促进细胞增殖,敲除CDR1as后导致细胞停留在G0/G1期并诱导细胞凋亡。
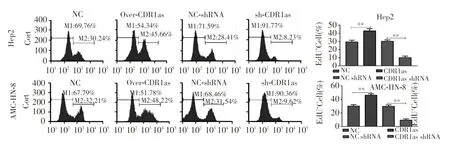
注:组间比较,**P<0.01
图3 转染CDR1as、NC-shRNA、CDR1as-shRNA后两种细胞系细胞分化检测(流式细胞术)
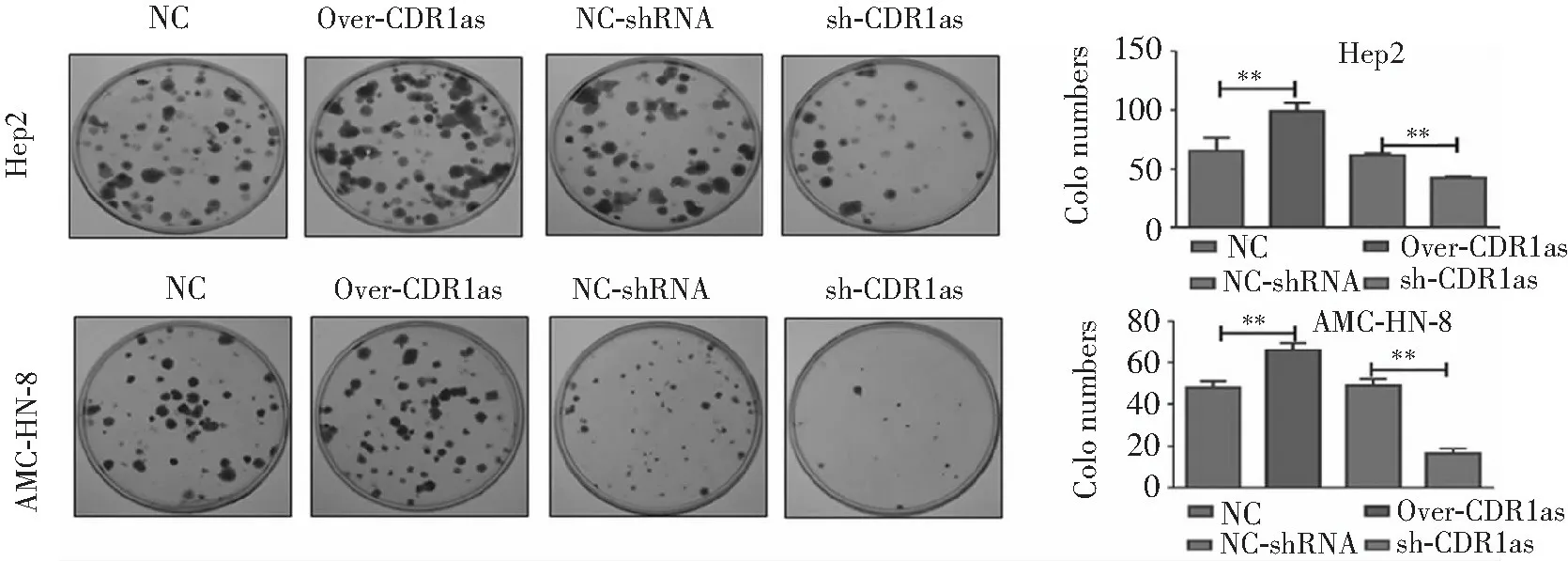
注:组间比较,**P<0.01
图4 转染CDR1as、NC-shRNA、CDR1as-shRNA后两种细胞系细胞集落形成检测
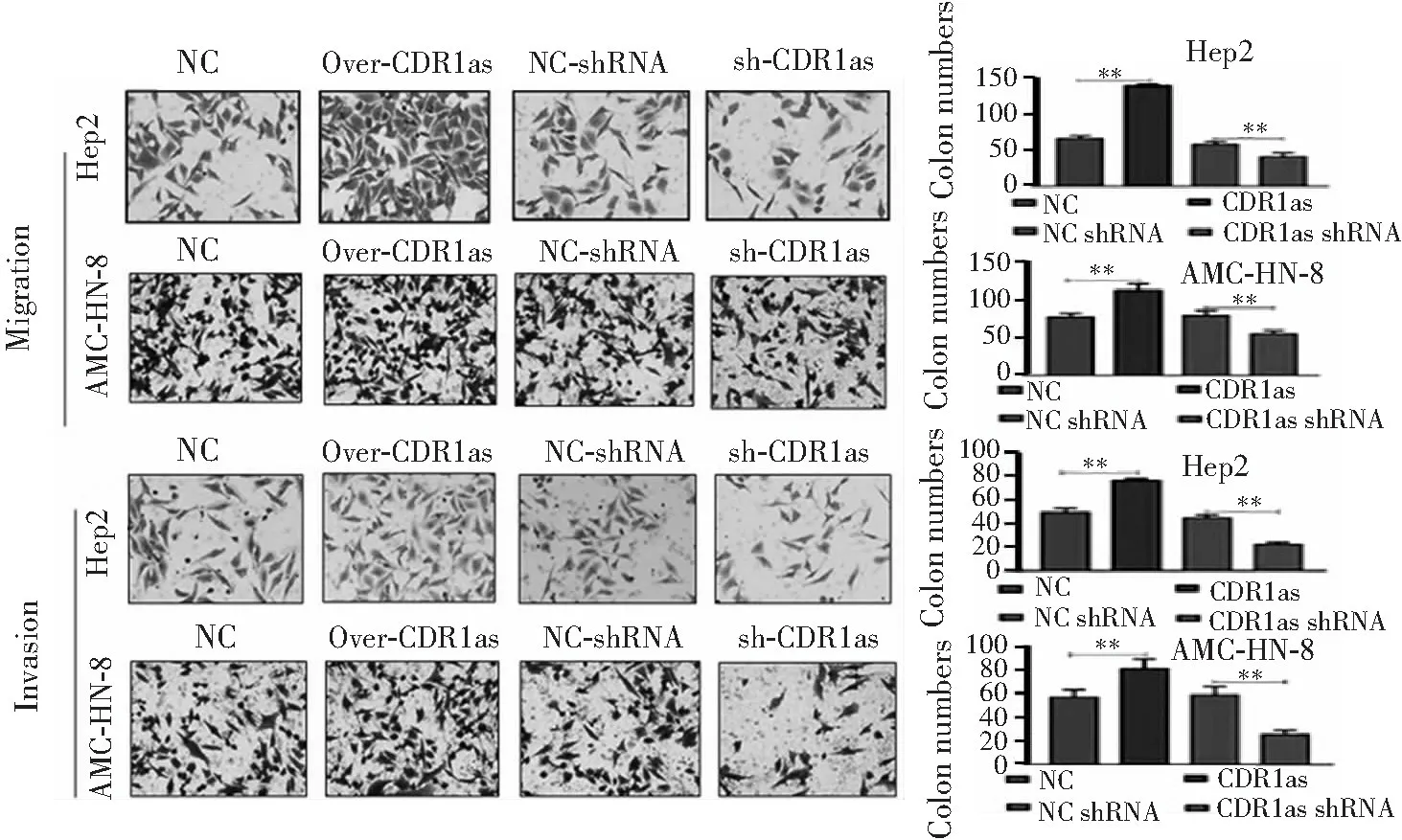
2.5 细胞迁徙和侵袭能力检测
Transwell实验显示,与对照组比较,转染CDR1as后两种细胞系的细胞迁徙和侵袭能力增强,而转染CDR1as-shRNA后细胞迁徙和侵袭能力减弱(均P<0.01)。见图6。即CDR1as过表达能增加细胞迁徙和侵袭能力。
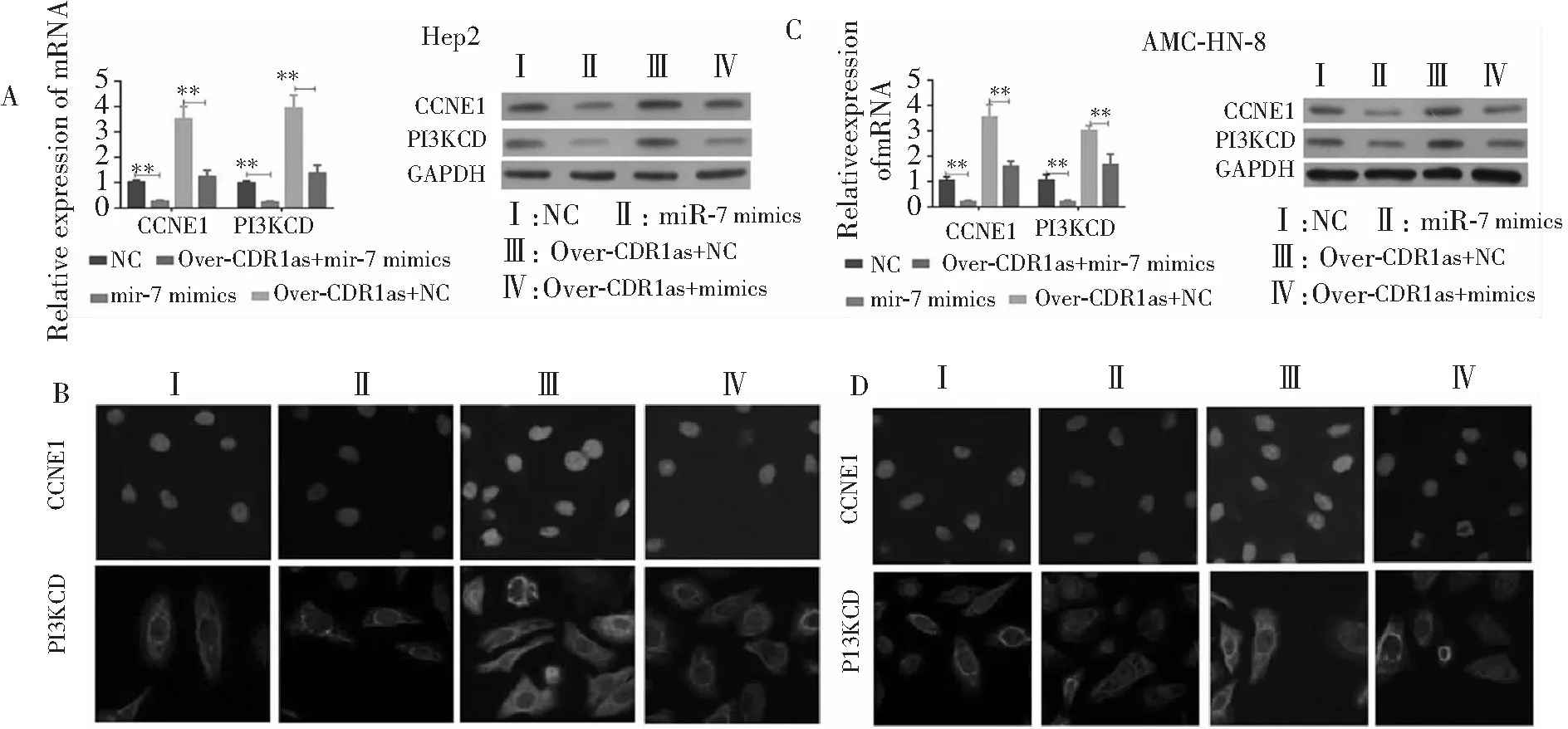
2.6 CDR1as调节miR-7的靶基因及蛋白表达检测
空白对照组CCNE1和PIK3CD基因及蛋白均有表达,转染miR-7 mimics后两者表达显著降低,而转染CDR1as后两者表达显著增加,证实miR-7的靶基因CCNE1和PIK3CD均能被CDR1as调节;而同时转染CDR1as+miR-7 mimics组与转染CDR1as组之间上述两种蛋白表达有显著差异,表明miR-7表达恢复可抵消CDR1as调节LSCC的过程并抑制CCNE1和PIK3CD表达。见图7。说明CDR1as诱导LSCC是通过调节miR-7/CCNE1/PIK3CD轴而发挥作用。
3 讨论
尽管通过手术、放疗及生物免疫治疗等综合手段,LSCC患者特别是晚期患者总体生存率在过去十几年并没有得到显著提高[1],表明LSCC发生的分子机制还有待进一步认识。癌症基因组图谱研究显示在LSCC中存在EGFR、ERBB2、CCND1、TP53、PIK3CD等多个潜在的治疗靶点,在肿瘤形成过程中CDR1as上调可以通过EGFR/RAF1/MAPK或PTEN/PI3K/AKT信号通路而减弱具有肿瘤抑制作用的miR-7的功能而发挥致癌基因作用[10]。
与线性RNA不同,环状RNA的3,和5,端通过共价键连接形成环形结构,这可阻止其被RNA核酸外切酶降解,保证其结构稳定性并使其大量表达于真核细胞质中。环状RNA具有保守性、丰富性及组织特异性,发挥肿瘤调节作用,并作为肿瘤特异性的分子标记物[11]。研究证实环状RNA可竞争内生性微RNA(miRNA)或作为miRNA海绵体在多种生物过程及疾病的发生、发展中发挥基因调节作用。研究显示,环状RNA在LSCC中存在表达失衡现象,其中hsa_circRNA_100855上调最明显、hsa_circRNA_104912下调最显著,表明环状RNA在LSCC发生、发展及预后方面起着重要作用[12]。本研究中培养两种细胞系Hep-2和AMC-HN-8,通过过表达与敲除两个相反的方向给予实验干预,观察细胞活性、生长速度、凋亡、迁徙及侵袭能力,发现CDR1as过表达导致细胞生长旺盛、细胞凋亡减少、迁徙和侵袭能力增强,而敲除CDR1as后细胞上述表现则相反,从而认为CDR1as在LSCC中为促癌基因。
注:A:细胞周期检测;B:细胞凋亡检测;组间比较,**P<0.01
注:组间比较,**P<0.01
注:A:4组Hep-2细胞CCNE1和PIK3CD mRNA表达(PCR);B:4组Hep-2细胞CCNE1和PIK3CD蛋白表达(荧光免疫组织化学);C:4组AMC-HN-8细胞CCNE1和PIK3CD mRNA表达(PCR);D:4组AMC-HN-8细胞CCNE1和PIK3CD蛋白表达(荧光免疫组织化学);组间比较,**P<0.01
图7 CDR1as调节两种细胞系的miR-7靶基因及蛋白表达检测
环状RNA因为其环形结构包含miRNA结合位点,即miRNA反应元件,这些元件发挥着海绵体作用。在高表达CDR1as的肝癌细胞中敲除CDR1as基因后, miR-7表达上调、CCNE1和PIK3CD基因表达下调,其肿瘤分化及侵袭被抑制[13]。结直肠癌的体内实验显示,CDR1as可通过阻止miR-7的肿瘤抑制作用而促进肿瘤生长;敲除CDR1as后结直肠癌细胞的分化及侵袭受到抑制,而转染miR-7抑制剂可恢复CDR1as被敲除的功能[6]。本研究中,我们发现转染miR-7 mimics,可促进肿瘤生长和侵袭的基因CCNE1和PIK3CD低表达,转染CDR1as后两者高表达,同时转染CDR1as+miR-7 mimics导致两者表达降低,表明CDR1as通过调节CCNE1和PIK3CD促进肿瘤生长和侵袭,这种作用可被miR-7所抵消。本研究证实在LSCC细胞中,CDR1as通过miR-7信号通路促进肿瘤发生、增殖、迁延及侵袭。
综上述,本研究发现CDR1as可通过miR-7/CCNE1/PIK3CD信号通路促进LSCC的发生、发展和转移,CDR1as可能成为LSCC的一项新的生物标记物和潜在的治疗靶点。
