利用CRISPR-Cas9敲除Tyr基因制作白化C57BL/6N小鼠
2019-09-03常秋荣刘丽丽王会阳付丽邢凤英李垚陈学进李善刚
常秋荣,刘丽丽,王会阳,付丽,邢凤英,李垚,陈学进*,李善刚,2*
(1. 上海交通大学医学院实验动物科学部,上海 200025; 2. 昆明理工大学灵长类转化医学研究院,昆明 650500)
C57BL/6N小鼠是由Little于1921年建立的近交系之一。该近交系以补体活性高,各种肿瘤自发率比较低为主要特点[1],在国内外得到了广泛应用,C57BL/6J小鼠也是继人类之后第二个完成基因组测序的哺乳动物种类。我们国家被全部授权引进的是C57BL/6N小鼠,可以自主进行基因修饰。由于C57BL/6N的毛色为黑色,单一的毛色品种限制了C57BL/6N在基因敲除和皮肤组织移植等方面研究中的广泛应用。传统的基因敲除小鼠多数具有129的背景,而在大量的医学科学研究中,C57BL/6N小鼠是常用的品系之一。这就产生了一个问题,生产的小鼠需要与C57BL/6N小鼠连续的进行回交7~8代,才能将小鼠变为C57BL/6N背景。为了克服这个困难,国内外有不少的实验室尝试建立了来源于C57BL/6N的胚胎干细胞[2-3],但是这种C57BL/6N来源胚胎干细胞并没有大量的应用。其主要原因是C57BL/6N的毛色为黑色,而嵌合体试验中的受体小鼠分别是毛色为白色的BALB/c和ICR,不同品系的差别降低了嵌合的效率。如果能用拥有白毛色的C57BL/6N作为嵌合受体,将会对提高嵌合率有帮助,也能够节省回交的时间和费用。
经典的基因打靶动物模型制作是建立在基因重组技术和大量细胞筛选的基础上,而最近几年出现的ZFN (zinc-finger nucleases,ZFNs)[4-5]、TALEN (TALE nucleases,TALENs)[6-7]和CRISPR-Cas9(clustered regularly interspaced short palindromic repeats)技术则为广泛的开展基因修饰制作人类重大疾病模型提供了新的选择[8]。CRISPR-Cas9技术通过向导RNA(sgRNA, single guide RNA)与基因组位点之间20 bp碱基的配对,再引导Cas9蛋白实现DNA切割,切断DNA链,然后经过细胞内在的DNA连接修复功能恢复双链,在这个过程中发生不同数目碱基的缺失或者插入,从而造成DNA编码的移码突变。由于sgRNA的设计简便,使得CRISPR-Cas9技术在近几年风靡一时。目前该技术已经在小鼠[9-10]、大鼠[11]、兔[12]和猴[13]等物种上成功获得了突变动物,并且能够实现大片段外源基因敲入[9]和定点突变[14]。如在小鼠上,赵勇等利用CRISPR-Cas9技术成功构建了miRNA-29b1基因敲除小鼠[15]。在大鼠上,马元武等利用CRISPR-Cas9技术敲除胰岛素受体底物1(Irs1)基因,得到稳定遗传的Irs1基因敲除大鼠[16]。
酪氨酸酶(tyrosinase, TYR)是黑色素生成的关键酶,有学者通过实时荧光定量PCR的方法揭示了Tyr基因在黑线仓鼠皮肤组织中的mRNA表达水平是其白化突变系的2.5倍,白化突变系Tyr基因表达量的降低,促使黑色素细胞合成与沉积的黑色素减少,进而导致白化毛色表型[17]。通过破坏Tyr基因可以获得白化的动物。目前已经有日本学者在C57BL/6J小鼠上开展了Tyr基因序列点突变获得白化的C57BL/6J小鼠的研究[18]。为了适应国内大量基于C57BL/6N小鼠的研究应用,本课题基于CRISPR-Cas9基因编辑技术,以C57BL/6N小鼠为研究对象,通过破坏C57BL/6N小鼠Tyr的基因序列,获得白化的C57BL/6N小鼠,然后经过重复回交和自交,形成C57BL/6N白化小鼠近交系。为以C57BL/6N为基础的胚胎干细胞的应用和组织工程提供更加丰富的实验工具。
1 材料与方法
1.1 材料
1.1.1 实验动物
3周龄SPF级雌性C57BL/6N小鼠6只,饲养一周后使用;雄性C57BL/6N小鼠6只,在8~20周龄使用;ICR雄鼠10只,结扎两周后使用;ICR雌鼠10只体重在25~35 g之间用做胚胎移植受体。实验小鼠均购自上海斯莱克实验动物有限公司【SCXK(沪)2012-0002】。上述小鼠及后代饲养在上海交通大学医学院实验动物科学部屏障环境内【SYXK(沪)2013-0050】。小鼠的麻醉、结扎、胚胎移植和取样检测均按照上海交通大学医学院实验验动物管理委员会批准程序进行(IACUC No. A-2015-002)。
1.1.2 实验试剂
胚胎操作液M2(Sigma,美国);透明质酸酶(Sigma,美国);胚胎培养基KSOM(Millipore,德国);孕马血清(PMSG)和绒毛膜促性腺激素(HCG)购自宁波三生药业,分别溶于4℃生理盐水,-20℃保存;小鼠麻醉剂由8 mL生理盐水添加2 mL 0.05 g/mL氯胺酮(福建古田药业,批号1507294)和16 mg xylazine(Sigma,美国)组成;石蜡油(Sigma,美国);pT7-cas9 vector和pCD-CAS购自百奥生物技术有限公司;Cas9-mRNA体外转录试剂盒mMESSAGE mMACHINE T7 Ultra Transcription Kit和sgRNA合成试剂盒MEGAshortscript T7 high yield Transcription Kit购自Invitrogen公司;限制性核酸内切酶XbaⅠ,Premix Taq Hot start购自Takara生物公司;引物合成由Invitrogen公司合成;DNA测序由上海铂尚生物公司完成。
1.2 方法
1.2.1 Cas9-mRNA的体外合成
利用pT7-cas9质粒中cas9基因后存在的XbaⅠ单一酶切位点,酶切使其线性化,在50 μL的酶切反应体系加入5 μL 10×T Buffer (Takara),5 μL 10× BSA,2.5 μLXbaⅠ,10 μg pT7-cas9质粒。37℃水浴反应3 h后,通过异丙醇沉淀方法回收线性化的pT7-cas9质粒,经生物分光光度计测定浓度,调整浓度范围在500~1000 ng/μL为宜,取出2 μg用于体外合成。
参照mMESSAGE mMACHINE T7 Ultra Transcription Kit的使用说明,在体外转录合成Cas9-mRNA,在室温下配置反应体系混匀后,在PCR仪中37℃反应2 h。向反应体系中加入1 μL TURBO DNase,37℃反应15 min 以去除DNA模板。然后对Cas9-mRNA添加Poly(A)尾,在PCR仪中37℃反应45 min,反应结束后将产物放置在冰上。采用LiCl沉淀法,回收Cas9-mRNA,加入40 μL RNase-free H2O稀释,按照1 μg/管分装至RNase-free的PCR管中,放入-80℃保存备用。
1.2.2 sgRNA的体外合成
利用从Invitrogen公司合成的引物P-sgF0F和T7R1,以pCD-CAS质粒为模板,经PCR反应合成sgF0。PCR程序为60℃退火30 s,53℃退火30 s,产物经异丙醇回收后获得sgF0模板序列。根据张锋实验室在线设计程序,针对Tyr基因的Exon1和Exon2的序列,设计两对sgRNA(sgTYR1F/ sgTYR1R/sgTYR2F/sgTYR2R)(见表1),将设计好的Tyr基因sgRNA的四个引物分别与反向引物T7R1混合,以sgF0为模板进行一次PCR反应(60℃退火30 s),再以该产物为模板,以引物T7primer和T7R1进行二次PCR反应(61℃退火30 s,45℃退火30 s),采用异丙醇回收DNA的方法纯化二次PCR产物,用做体外转录sgRNA的模板。将一次PCR和二次PCR扩增产物取出5 μL进行2%琼脂糖凝胶电泳分析,预计长度为120 bp左右。该产物用于sgRNA的体外合成。
按照Invitrogen公司MEGAshortscript T7 high yield Transcription Kit说明书的操作,进行体外sgRNA合成,在PCR仪中,37℃反应16 h。根据MEGAclear-96 Purification of Transcription Reactions in 96 well format试剂盒的操作指导,完成sgRNA回收,回收产物加入RNase-free的PCR管中,使用生物分光光度计测定浓度后,按照1 μg/管的使用标准将其分装至RNase-free的PCR管中,放入-80℃保存。

表1 sgRNA合成相关引物及基因型鉴定引物Table 1 Primers related to sgRNA synthesis and genotype identification
1.2.3 小鼠受精卵的获得
每只C57BL/6N雌小鼠腹腔注射5 U的PMSG(下午1~2点),46~48 h后注射10 U的HCG,与雄小鼠合笼,第2天将有阴道栓的小鼠颈椎脱臼法处死,取出输卵管。在体式显微镜下用1 mL注射器针尖划破输卵管壶腹部,释放细胞团,放入含有0.3%透明质酸酶的M2培养液中,3 min后用玻璃吸管收集原核明显和有第二极体的受精卵,移到覆盖石蜡油的KSOM培养液滴中。
1.2.4 小鼠受精卵的显微注射
将Cas9-mRNA和四种sgRNA按照20 ng/μL和40 ng/μL的使用浓度进行混合,混匀后在10 cm培养皿盖子上做成微滴,同时用添加0.2% PVA的M2做成30 μL的操作滴。用P97(Sutter,美国)拉针仪拉制注射针,在锻针仪上断成约2 μm粗细大小的开口,向注射针中注入0.5 cm左右的水银,然后装在配有Piezo的显微操作仪上,吸入Cas9-mRNA和sgRNA混合液。用持卵针将受精卵固定住,用注射针打破透明带,沿赤道面水平插入细胞质2/3的位置,使用低的脉冲打破细胞膜,轻微旋动注射针手柄,使大约5 pL的Cas9-mRNA和sgRNA的混合液进入到受精卵胞质中。注射后的胚胎移入KSOM培养基,在37℃,5% CO2饱和湿度细胞培养箱中培养过夜。
1.2.5 注射后受精卵的胚胎移植
选自然发情的ICR雌鼠与结扎公鼠交配,以见到阴道栓的作为受体鼠,麻醉后进行胚胎移植。受精卵注射后24 h,选择发育到2细胞的胚胎进行胚胎移植。将内径130 μm,经过抛光的移胚针装在显微注射器的针杆前端,拧动螺旋,按照顺序吸入第一个气泡,胚胎和第二个气泡,然后在输卵管上用1 mL注射器针尖扎一个小口,将移胚针自小口处插入输卵管,拧动螺旋将玻璃管中的胚胎和气泡注入输卵管膨大部,以在膨大部看到气泡为移植成功。
1.2.6 新生小鼠和F1代小鼠的基因型鉴定
对所有新生的小鼠在一周时进行剪脚趾编号,剪下的脚趾作为样品分别放入离心管,加入100 μL的50 mmol/L NaOH溶液,98℃加热30 min,然后加入10 μL浓度为1 mol/L的Tris-HCl(pH=7.5),混匀后作为DNA模板。根据靶基因所在位点向上下延伸200 bp左右,利用Premier 5分别设计出两对鉴定引物JDTYR1F/JDTYR1R和JDTYR 2F/JDTYR2R(见表1)。小鼠基因组DNA为模板,进行PCR反应扩增目的条带。针对Exon1的鉴定引物是JDTYR1F/JDTYR1R(60.1℃退火30 s,54.5℃退火30 s),目的片段201 bp;针对Exon2的鉴定引物是JDTYR2F/JDTYR2R(52.5℃退火30 s),目的片段258 bp。跨内含子PCR扩增引物是JDTYR1F/ JDTYR2R(54.5℃退火30 s)。
将扩增产物取5 μL进行2%琼脂糖凝胶电泳分析,部分产物送上海铂尚测序公司进行测序分析。
1.2.7 白化C57BL/6N小鼠的繁殖和种系维持
将F0代小鼠与野生型C57BL/6N交配获得F1代小鼠;对F1代的小鼠采取自交的方法,获得F2代小鼠。F2代小鼠有黑色和白色(Tyr-/-)两种,只将白的小鼠留种,与野生型的C57BL/6N进行交配获得F3代杂合子。F3代的黑鼠进行自交获得F4代,F4代的黑鼠继续与野生型的C57BL/6N回交。如此周而复始直至回交4次后,采用白色C57BL/6N进行自交繁殖以维持种系。
1.2.8 白化C57BL/6N小鼠的下颌骨测定
取3只白化C57BL/6N小鼠和4只野生型C57BL/6N小鼠,分别颈椎脱臼法处死,剪开皮肤取头骨至沸水中煮2~3 min后剃下右侧下颌骨,用2% NaOH加热至80~90℃持续10 min以去除下颌骨残肉并拔掉门齿,洗净并室温干燥后[19],用扫描仪(Epson,日本)进行扫描。对扫描图像进行重合(Merge)分析。
2 结果
2.1 Cas9 mRNA和 sgRNA的合成
pT7-Cas9质粒经过XbaⅠ单酶切后(见图1A),将该质粒进行转录,获得Cas9 mRNA,并测定其浓度为1479 ng/μL。利用异丙醇回收的sgF0片段为模板,经过两步PCR反应后获得sgRNA的转录模板,经2%琼脂糖凝胶电泳分析后,得到长度约为120 bp的单一条带(见图1B),用作sgRNA的转录模板。经过转录后,获得浓度分别为3234、3225、3793、4455 ng/μL的四个sgRNA。
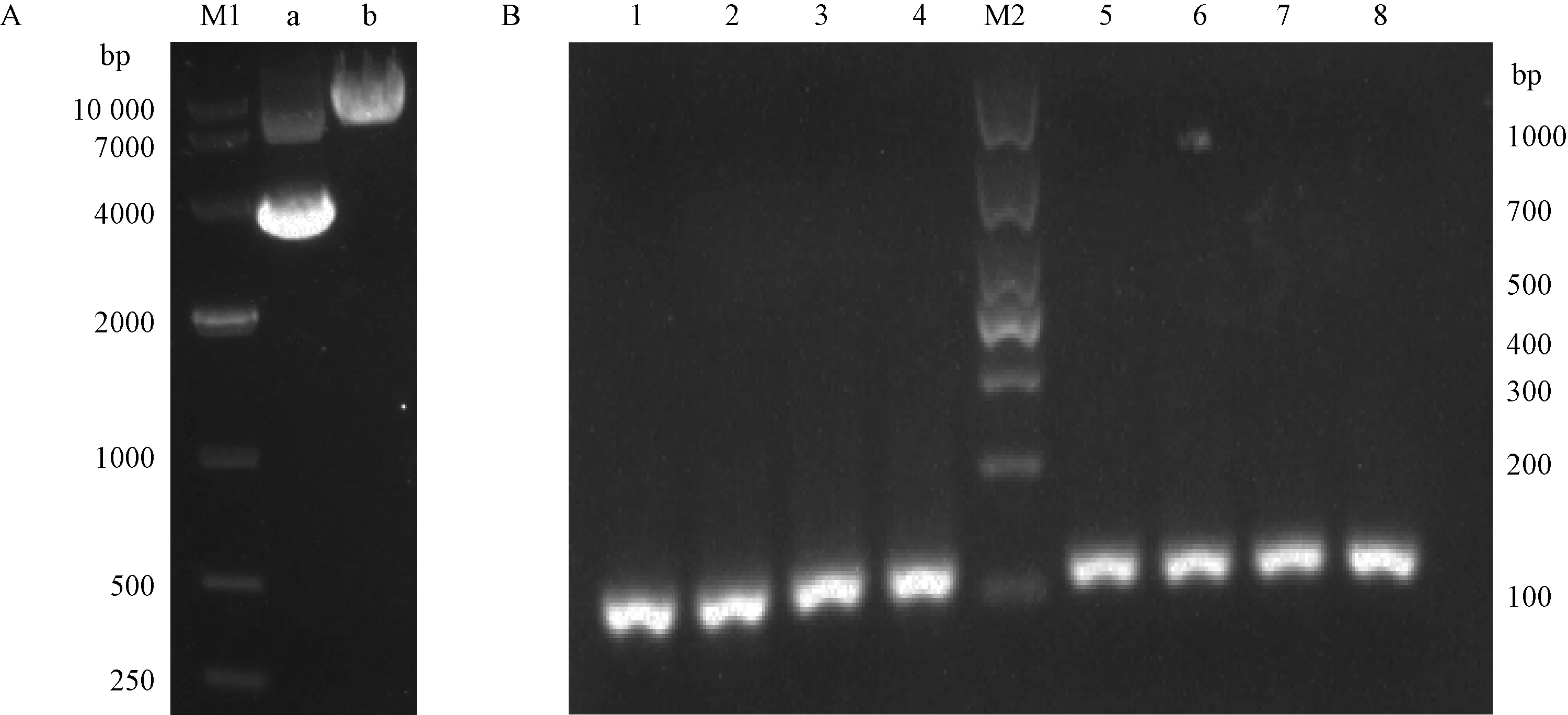
注:A. M1:DL10 000 DNA Marker;a: pT7-Cas9质粒;b: XbaⅠ酶切pT7-Cas9质粒;B. 1-4:一次PCR扩增产物; M2:DL1000 DNA Marker;5-8:二次PCR扩增产物。图1 线性化的pT7-Cas9质粒及体外转录sgRNA的模板Note. A. M1, DL10 000 DNA marker. a, pT7-Cas9 vector. b, pT7-Cas9 vector was cut by XbaI. B. 1-4: Products of the first PCR. M2, DL 10 000 DNA marker. 5-8, Products of the second PCR.Figure 1 Linearized pT7-Cas9 plasmid and templates of sgRNA transcription in vitro
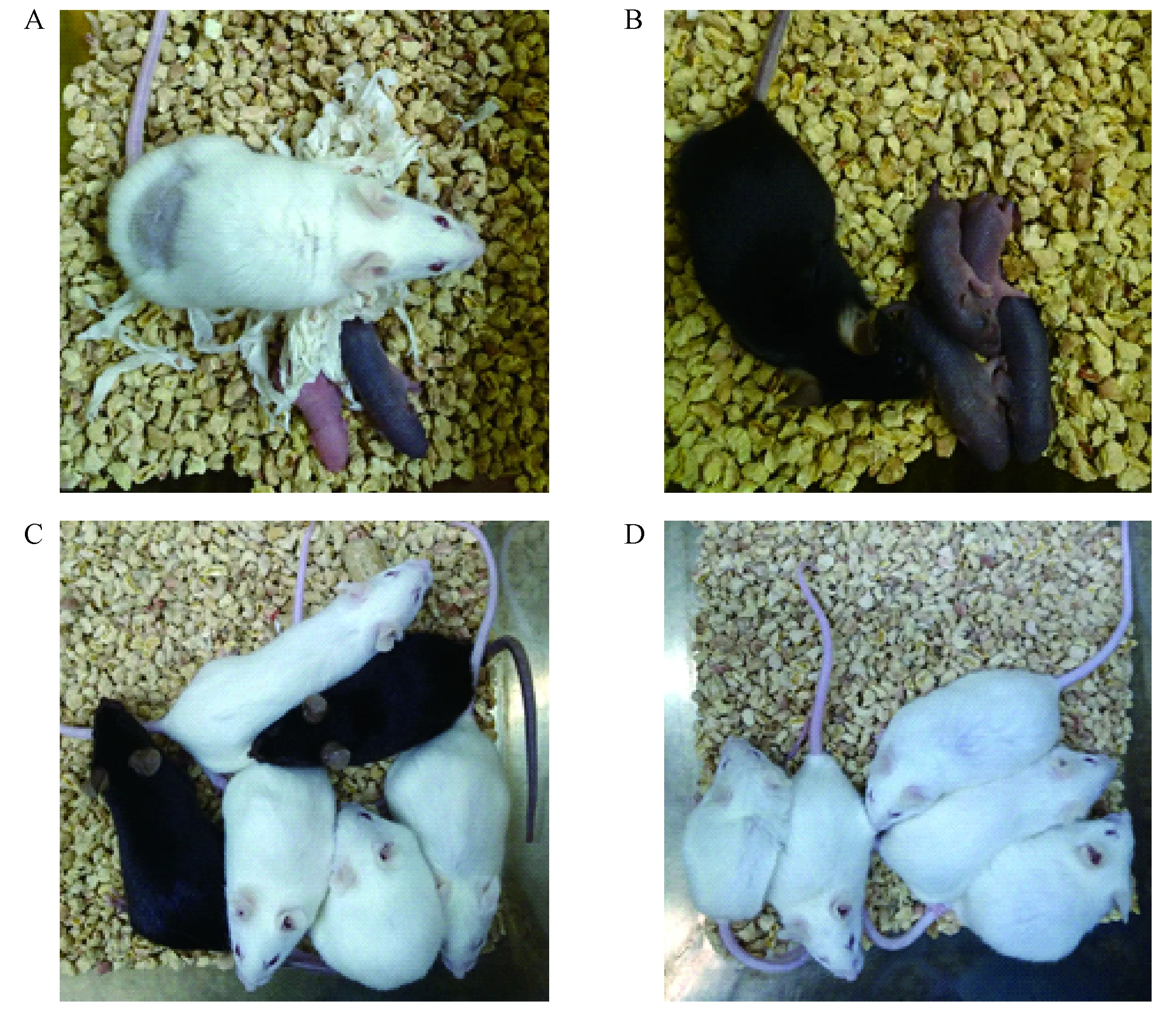
注:A. F0代小鼠;B. F1代小鼠;C. F2代小鼠;D. 白化C57BL/6N小鼠近交系。图2 Tyr基因敲除小鼠后代Note: A. Offspring of F0 generation. B. Offspring of F1 generation. C. Offspring of F2 generation. D. Albino C57BL/6N mouse inbred line.Figure 2 Offsprings of the Tyr knockout mice
2.2 F0代小鼠的获得和鉴定
通过显微注射的方式,将使用浓度为20 ng/μL的Cas9-mRNA和使用浓度均为10 ng/μL的sgTYR1F,sgTYR1R,sgTYR2F和sgTYR2R混匀后,将Cas9-sgRNA的混合液注射入原核期受精卵的胞质中。第2天将35枚发育至2细胞的经过基因编辑的胚胎通过胚胎移植技术移植入两只代孕受体的两侧输卵管中,20 d妊娠期结束后生产2只小鼠,其中一只为白色,一只为黑色(见图2A)。
将两只小鼠的DNA经过PCR鉴定,2%琼脂糖凝胶电泳以后(见图3A)发现,白色小鼠Exon1扩出了两条带,其中一条带明显短于目的条带;Exon2扩增的带没有差异,跨内含子的引物没有扩增出明显的带型。对PCR产物进行测序分析发现,白色小鼠的Exon1和Exon2都有移码突变,但是无法做具体分析。黑色F0代小鼠测序结果为野生型。
2.3 F1代小鼠的获得和鉴定
将F0代白色小鼠和野生型小鼠交配,获得4只F1代小鼠(见图2B),针对Exon1的PCR检测结果显示1号小鼠和2,3,4号小鼠基因型不同(见图3B),1号小鼠扩出1条带,2,3,4号小鼠均扩出2条带;针对Exon2的PCR检测结果显示1,2,3,4号小鼠基因带型相同(见图3B)。
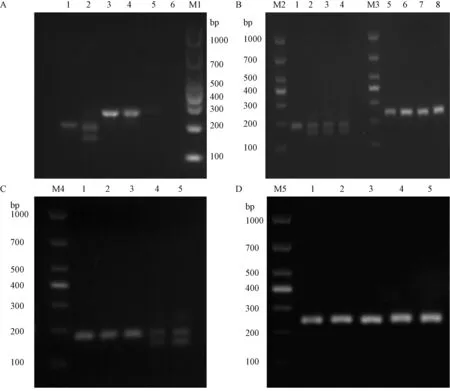
注:A, 1:F0代黑色小鼠Exon1 PCR扩增产物;2:F0代白色小鼠Exon1 PCR扩增产物;3:F0代黑色小鼠Exon2 PCR扩增产物;4:F0代白色小鼠Exon2 PCR扩增产物;5:F0代黑色小鼠跨内含子PCR扩增产物;6:F0代白色小鼠跨内含子PCR扩增产物;M1:DL1000 DNA Marker。B, M2:DL1000 DNA Marker;1-4: 4只F1代黑色小鼠Exon1 PCR扩增产物;M3:DL1000 DNA Marker;5-8: 4只F1代黑色小鼠Exon2 PCR扩增产物。C, M4:DL1000 DNA Marker;1-5∶5只纯合代白色小鼠Exon1 PCR扩增产物。D, M5:DL1000 DNA Marker;1-5: 5只纯合代白色小鼠Exon2 PCR扩增产物;图3 F0代、F1代、纯合后代的Exon1和Exon2 PCR结果Note. A, 1. Exon1 PCR product of black F0 generation. 2. Exon1 PCR product of white F0 generation. 3. Exon2 PCR product of black F0 generation. 4. Exon2 PCR product of white F0 generation. 5. Transintron PCR product of black F0 generation. 6. Trnasintron PCR product of white F0 generation. M1: DL1000 DNA marker. B, M2: DL1000 DNA marker. 1-4, Exon1 PCR products of four black offsprings of F1 generation. M3:DL1000 DNA marker. 5-8, Exon2 PCR products of four black offsprings of F1 generation. C, M4: DL1000 DNA marker. 1-5, Exon1 PCR products of five white offsprings of homozygous generation. D, M5: DL1000 DNA marker. 1-5, Exon2 PCR products of five white offsprings of homozygous generation.Figure 3 PCR products of Exon1 and Exon2 between F0, F1 and homozygous generations
2.4 F2代小鼠的获得和持续回交
利用F1代的3号和4号小鼠交配获得了F2代(见图2C),选择F2代中的白色小鼠与野生型黑色C57BL/6N进行回交。目前已经回交4次,现在维持白化C57BL/6N小鼠近交系(见图2D)。采用全同胞兄妹交配方式维持。将白化后代的PCR产物(见图3C&D)切胶后送测序经Blast比对后发现,白色小鼠在Exon1有两种突变类型,分别缺失45 bp和14 bp,Exon2也有两种突变类型,分别缺失7 bp和3 bp,通过纯合类型的分析发现其中E1-45和E2-3在同一条染色体上,E1-14和E2-7在同一条染色体上(见图4)。

注:红色字母表示PAM,绿色字母表示sgRNA位点。图4 sgRNA位点和纯合子小鼠的基因突变形式Note. The red letters indicate PAM and the green letters indicate sgRNA sites.Figure 4 sgRNA sites and mutant forms of the homozygous mice

图5 白化C57BL/6N小鼠与野生型C57BL/6N小鼠下颌骨扫描图像比较Figure 5 Comparison of the mandibular scan images between albino C57BL/6N and wild-type C57BL/6N mice
2.5 白化C57BL/6N小鼠的下颌骨测定
通过对3只白化C57BL/6N小鼠与4只野生型C57BL/6N小鼠下颌骨扫描图像的重合比较,我们发现白化C57BL/6N小鼠的下颌骨与野生型C57BL/6N小鼠的下颌骨非常一致(见图5)。没有明显的变异发生。
3 结论
本研究设计了两对sgRNA,针对小鼠Tyr基因的两个外显子进行敲除,通过一次胚胎注射实验,移植两只受体就获得了白化的C57BL/6N小鼠,产生突变的效率约50%,和CRISPR-Cas9在其他物种上的基因敲除结果类似[11-12],而且该小鼠具有繁殖能力,顺利地产生了后代,这也说明CRISPR-Cas9技术的简便高效。
在试验中简化了实验方法,将通过引物退火后插入到酶切后的质粒中获得sgRNA表达载体的方法改为通过两次PCR的方式直接扩增sgRNA体外合成的模板,这样可以将质粒构建,抽提,测序验证的步骤省略,可以节约3~5 d的时间和一部分实验费用。这对规模化利用CRISPR-Cas9技术制作小鼠模型很有帮助。
在小鼠胚胎移植的过程中,我们在输卵管靠近膨大部移植的方法基础上做了进一步改进[20],将移胚针装在显微注射器上使用,由于显微注射器操作灵敏,可以轻松的吸入微小的气泡,并且将移植胚胎紧密排列在移胚针内。吹入输卵管膨大部的液体较少,而且通过油压传动和螺旋推动,可以轻松克服输卵管内的液体压力,保证移植的成功率。
CRISPR-Cas9技术的一个缺点是脱靶效应,这主要是由于基因功能序列的相似性和模糊识别造成的。所以说CRISPR-Cas9技术在基因突变方面有很大的优势,但是还不能完全替代传统的ES细胞打靶技术。为了克服潜在的脱靶,我们对白化C57BL/6N小鼠的后代进行了连续的回交。下颌骨测定的结果显示白化C57BL/6N小鼠与野生型C57BL/6N小鼠没有区别。
在实验过程我们发现注射后的胚胎发育到期率比较低,这可能与注射的sgRNA数量较多有关,而且两个外显子同时敲除也给鉴定带来了麻烦。所以针对一个外显子设计1~2条sgRNA或许是一个好的思路,这样可以减少变异类型,方便获得基因突变小鼠后的基因型鉴定。
本研究通过CRISPR-Cas9技术敲除小鼠Tyr基因,成功建立了C57BL/6N白化小鼠近交系,为将来的嵌合体制作、组织移植提供了新的工具,本小鼠种系可以无偿提供给有需求的研究者。
