Smad2/3a对斑马鱼神经嵴细胞标记基因crestin表达的影响
2019-09-03李丽芳陈露西贾顺姬颜光玗
李丽芳,陈露西,贾顺姬,颜光玗
(1. 南方医科大学基础医学院,发育生物学教研室,广州 510515; 2. 清华大学生命科学学院,膜生物学国家重点实验室,北京 100084)
TGF-β超家族参与调控细胞的生长、增殖、分化、凋亡,在胚胎发生以及组织器官稳态维持的过程中发挥了至关重要的作用[1]。TGF-β信号传递可以通过SMAD信号通路[2]和/或DAXX信号通路[3]。SMAD信号通路的转导主要是通过膜外的TGF-β 配体结合位于膜上的TGF-βII 型受体,活化的TGF-βII型受体招募、结合并磷酸化TGF-βI型受体,激活的TGF-βI型受体磷酸化下游的受体调控型Smads(R-Smads),磷酸化的R-Smads与Smad4形成复合体进入细胞核,与各种转录因子结合来调节下游目的基因的表达[4]。哺乳动物中,R-Smads包括Smad1、Smad2、Smad3、Smad5和Smad8,这些蛋白包含两个保守的结构域,MH1和MH2。N端的MH1结构域主要与DNA结合,C端的MH2结构域对于互作蛋白的结合至关重要[5]。TGF-β 超家族包括TGFβ1、TGFβ12、TGFβ13、激活素(activins)、抑制素(inhibins)、Nodal、骨形成蛋白(bone morphogenetic protein,BMP)和生长分化因子(GDFs)等[1],其中Nodal信号在脊椎动物中内胚层诱导、神经诱导和神经板的前后分化、左右不对称以及背腹轴的形成过程中具有非常重要的作用[6]。Nodal信号的转导依赖于下游效应因子Smad2和Smad3。在小鼠中,Smad2缺失的小鼠不能形成前端内脏内胚层(AVE)[7],不能形成A-P轴[8]。smad3突变小鼠体型偏小,有前肢畸形的表型[9],存在黏膜免疫缺陷,但仍可存活至成年[10]。小鼠胚胎成纤维细胞中smad3缺失导致其不能形成Smad-DNA复合物,进而不能响应TGF-β信号,从而调控下游基因的转录[9]。smad2和smad3双纯合突变体不能形成中胚层和进行原肠作用[11]。在斑马鱼中,目前没有smad2/3纯合突变体,但表达其显性抑制形式(dnsmad2、dnsmad3a和dnsmad3b)会导致中内胚层发育缺陷,过表达smad3会促进神经诱导以及神经外胚层的后部化[12]。目前这些研究主要集中在Smad2和Smad3在中内胚层诱导以及前后轴线形成中的作用,但Smad2/3是否在神经嵴的发育过程中起作用,目前尚无相关报道。
神经嵴起源于神经外胚层和表皮外胚层交界的双侧结构域。当神经外胚层汇聚到中线形成神经管后,神经嵴细胞经历上皮-间充质细胞转换,在沿着神经管的背外侧形成一个离散的间充质细胞群,随后以固定的时间和空间模式向特定组织部位迁移,最终形成多种分化的细胞类型,包括周围神经元、胶质细胞、色素细胞和颅面骨骼细胞等[13]。神经嵴细胞的诱导发生主要受到BMP、成纤维细胞生长因子(fibroblast growth factor,FGF)、Wnt、Notch等多种信号的调节[14]。这些信号以及其他转录因子,共同组成基因调控网络,调控神经嵴的早期诱导发生、神经嵴祖细胞的维持、神经嵴祖细胞的上皮间充质转换以及通过不同通路向特定细胞的分化过程等。其中,Foxd3和Snail在早期诱导完成到神经嵴边界祖细胞确定过程中发挥了重要作用,同时其与Sox9共同在神经嵴祖细胞多能性维持以及祖细胞从神经管分离过程有一定的功能。此外,Sox9还与Sox10在神经嵴细胞终末分化过程中有作用[15]。这些转录因子是神经嵴细胞的标记基因,仅在迁移前神经嵴细胞中表达[16]。与这些基因不同,crestin在神经嵴前体细胞以及分化细胞中均有表达,其可以被用来较灵敏地评估神经嵴细胞或多或少的变化[13]。
目前,有一些研究结果提示Smad2以及Smad3可能在神经嵴细胞的发育中存在一定的功能,如:斑马鱼胚胎中smad3a在迁移的躯干神经嵴细胞中表达[17],小鼠胚胎中smad2杂合突变可导致颅面缺损[18]等。本研究以斑马鱼作为模式动物,利用吗啉环修饰的反义寡核苷酸(antisense morpholino oligonucleotide,MO)技术敲降斑马鱼smad2和smad3基因的表达,通过原位杂交检测神经嵴细胞标记基因的表达来初步探究Smad2/3在神经嵴细胞发育过程中的功能。
1 材料与方法
1.1 材料
1.1.1 实验动物
实验中所用到的斑马鱼品系为Tuebingen(TU)。野生型胚胎置于Holtfreter水(0.025 g/L 碳酸氢钠,0.1 g/L 无水氯化钙,0.05 g/L 氯化钾,3.5 g/L 氯化钠,pH 值 6.8~7.2)中,于28.5℃培养至特定时期。
1.1.2 主要试剂和仪器
RNeasy Mini纯化回收试剂盒(Qiagen,# 74104,美国),DNA纯化回收试剂盒(# DP214,天跟生化科技有限公司,北京),GoScript 随机引物反转录试剂盒(Promega,# A2790,北京照生莱博商贸有限公司),mMESSAGE mMACHINE T7/SP6转录酶试剂盒(Ambion,# AM1345/AM1340,美国),地高辛标记RNA试剂盒(Roche,# 11175025910,美国),BamH Ι(NEB,# R3136S,美国),Not Ι(NEB,# R3189S,美国), 封闭剂(Roche,# 11096176001美国),左旋咪唑(Sigma,# 16595-80-5,美国),地高辛抗体(Roche,# 11093274910),BM Purple AP(Roche,# 11442074001,美国),徕卡体视显微镜(M125 C,德国)。
1.2 方法
1.2.1 反义寡核苷酸的设计与合成
根据smad2的前体mRNA序列设计2个反义寡核苷酸,其中MO1序列位于第4个外显子和第4个内含子的交接处,MO2序列位于第4个内含子和第5个外显子交接处。序列分别为smad2-MO1(简称smad2 SM1):5’-CAATTTCCATACCTGGTG TCTCCAC-3’,smad2-MO2(简称smad2 SM2):5’-AAGAACTACAGGAGAGAAGATTAAA-3’。MO由GeneTools公司合成,合成好的MO粉末用无核酸酶的纯水溶解成20 μg/μL的贮液,-80℃冻存。使用时将MO稀释到合适浓度进行显微注射。smad3a/bMO和p53 MO的序列和信息详见已报道的文献[12]。
1.2.2 检测MO效率的引物设计
根据斑马鱼smad2基因的核酸序列,分别在MO所在区域的上下游约150 bp处设计检测引物。同时为了确定smad2 SM1和smad2 SM2共同注射是否会使得敲降效率更高,上游引物设计在第3个外显子,下游引物位于第6个外显子。阳性对照引物位于第2个外显子上。序列信息如表1所示。
1.2.3 胚胎总RNA的提取和cDNA的合成
本研究使用RNeasy Mini试剂盒提取胚胎总RNA,其后使用随机引物反转录试剂盒制备cDNA。提取总RNA需取15~30枚处于6体节时期经过不同处理的胚胎,用蛋白酶脱去绒毛膜,再用DEPC水清洗两次后,加入600 μL 裂解液RLT和 24 μL 二硫苏糖醇(DTT,1 mol/L),涡旋振荡使细胞充分裂解,直至无肉眼明显可见的颗粒。后续的详细步骤以及cDNA合成步骤参见产品说明书。
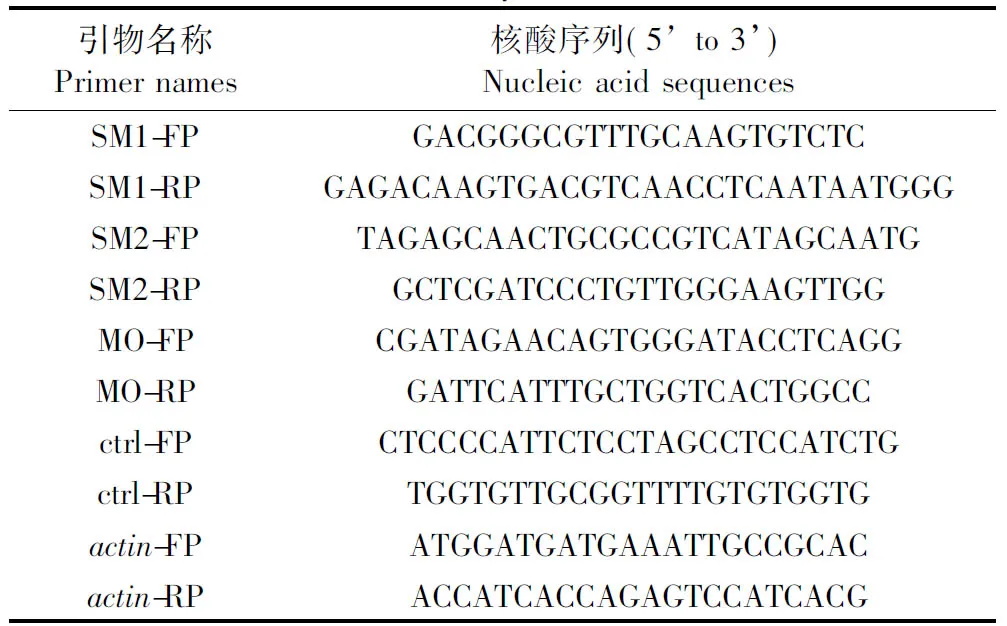
表1 smad2 MO有效性验证的引物名称及序列Table 1 Primer names and sequences for smad2 MO validity detection
1.2.4 体外合成mRNA及纯化回收
用于体外合成casmad2 mRNA和smad3amRNA的质粒信息详见之前的报道[12, 19]。提取12 μg质粒用相应的限制性内切酶切割,纯化后获得线性化DNA模板,然后体外合成mRNA,并将mRNA纯化回收,于-80℃保存。体外合成mRNA及mRNA的纯化回收的具体步骤参见产品说明书。
1.2.5 MO和mRNA的显微注射
smad2 SM1的注射剂量为5 ng,SM2的注射剂量为5 ng;smad3a/bMO的注射剂量均为5 ng;p53 MO的注射剂量为5 ng;casmad2 mRNA的注射剂量为5 pg;smad3amRNA的注射剂量为20 pg。将合成的MO及mRNA注射到斑马鱼单细胞时期的受精卵中,待胚胎发育至6体节时,用蛋白酶脱去绒毛膜,甲醛固定过夜后,梯度脱水(25%,50%,100%,100%)于甲醇中,-20℃保存备用。
1.2.6 斑马鱼整胚原位杂交
选取crestin,snail1b和foxd3基因靠近3’UTR区域的一段cDNA序列作为探针的模板。设计引物用于模板的扩增,其中下游引物5’端有T7启动子序列,序列信息如表2所示。扩增后的产物经回收后可直接用于合成地高辛标记的反义RNA探针。合成的探针用原位杂交液HYB+(50%甲酰胺,5 × SSC,0.1% Tween-20,0.5 mg/mL酵母RNA,0.05 mg/mL肝素)稀释到1.5%使用。探针使用之前,需于72℃变性处理10 min。sox10探针的序列信息详见已报道的文献[20]。
杂交第1天,取大约30枚胚胎到无核酸酶的EP管中,用配制在DEPC水中的PBST溶液梯度水化,水化后置换成 1 mL 4%多聚甲醛,室温固定20 min。然后用1 mL PBST溶液洗涤二次,每次5 min。吸走PBST溶液,加入300 μL 65℃预热的HYB-(50%甲酰胺,5 × SSC,0.1% Tween-20)溶液,65℃放置5 min;再置换成300 μL HYB+溶液,65℃预杂交3~4 h。将探针稀释,于72℃变性10 min后,立即置于冰上,用100 μL探针稀释液置换HYB+溶液,65℃水浴杂交12~16 h。第2天吸出探针,-20℃保存并可重复使用。胚胎用洗液I(50%甲酰胺,2× SSC,0.1% Tween-20)65℃洗2次,每次30 min,之后置换成2× SSCT溶液于65℃洗涤胚胎15 min。然后依次用0.2× SSCT溶液和0.02× SSCT溶液洗涤胚胎4次,每个浓度两次,每次30 min。然后置换成MABT溶液,室温放置5 min,重复一次后,换成封闭液(灭活山羊血清、10%封闭剂和MABT按照1∶2∶7比例混合),室温孵育1 h。之后,置换成抗体孵育液(碱性磷酸酶标记的地高辛抗体按1∶3000的比例稀释于封闭液中),4℃孵育12~16 h。第3天,吸走抗体孵育液,加入含10%灭活山羊血清的MABT溶液,室温摇动30 min;置换成MABT溶液,摇动30 min,再重复2次,时间依次为1 h和30 min。之后置换成染色缓冲液(100 mmol/L氯化钠,50 mmol/L氯化镁,100 mmol/L Tris-Cl,1 mmol/L左旋咪唑和 0.1% Tween-20),室温放置 5 min,重复3次。然后将胚胎转移至48孔板中,除去染色缓冲液,加入200 μL底物,用锡箔纸包裹后于室温反应。每30 min取出观察显色结果。待显色充分后,吸走底物,用PBST溶液洗涤两次,然后置换成4%多聚甲醛,4℃放置过夜以终止反应。用PBST 溶液洗涤胚胎两次后,置换成甘油,待胚胎完全浸润后在徕卡体式显微镜下进行拍照。
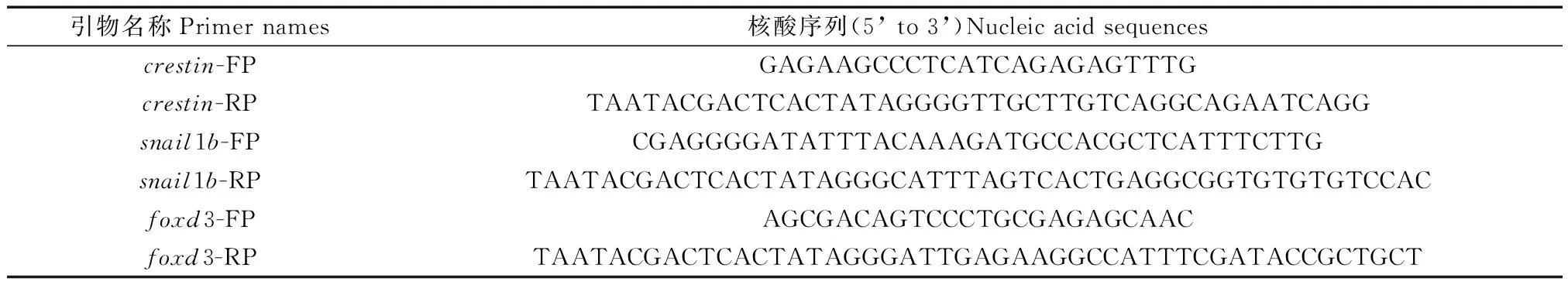
表2 合成探针模板的引物名称及序列Table 2 Primer names and sequences of the synthetic probe templates
2 结果
2.1 利用MO抑制smad2的表达
根据smad2的基因结构,本研究设计了两条针对性干扰smad2第4、5外显子剪接的MO,分别命名为SM1和SM2。为了确定smad2 SM1和SM2是否可以干扰其正确剪接过程,从而下调smad2基因的表达,我们提取了未注射和不同注射组胚胎的总RNA,反转录得到cDNA,并通过不同位置的检测引物对目的片段扩增(引物位置如图1A所示)。
核酸凝胶电泳显示注射SM1和SM2后,smad2前体mRNA的剪接被破坏。其中,actin引物扩增的目的条带大小和亮度在各个样品中一致,表明各样品间总RNA的量一致;阳性对照引物扩增的条带在各处理组间基本一致,表明smad2 mRNA的总量变化不大;与未注射组相比,在不同MO注射组中,MO引物扩增的目的条带相对较少,表明smad2第4和5号外显子正确剪接的比率降低,其中SM1的效率高于SM2,并且SM1与SM2共注几乎可以阻止smad2进行正确剪接;在MO注射组中,SM1与SM2引物扩增出非正确剪接的条带,表明4号内含子被保留下来,从而干扰正常smad2 mRNA的表达(如图1B所示)。
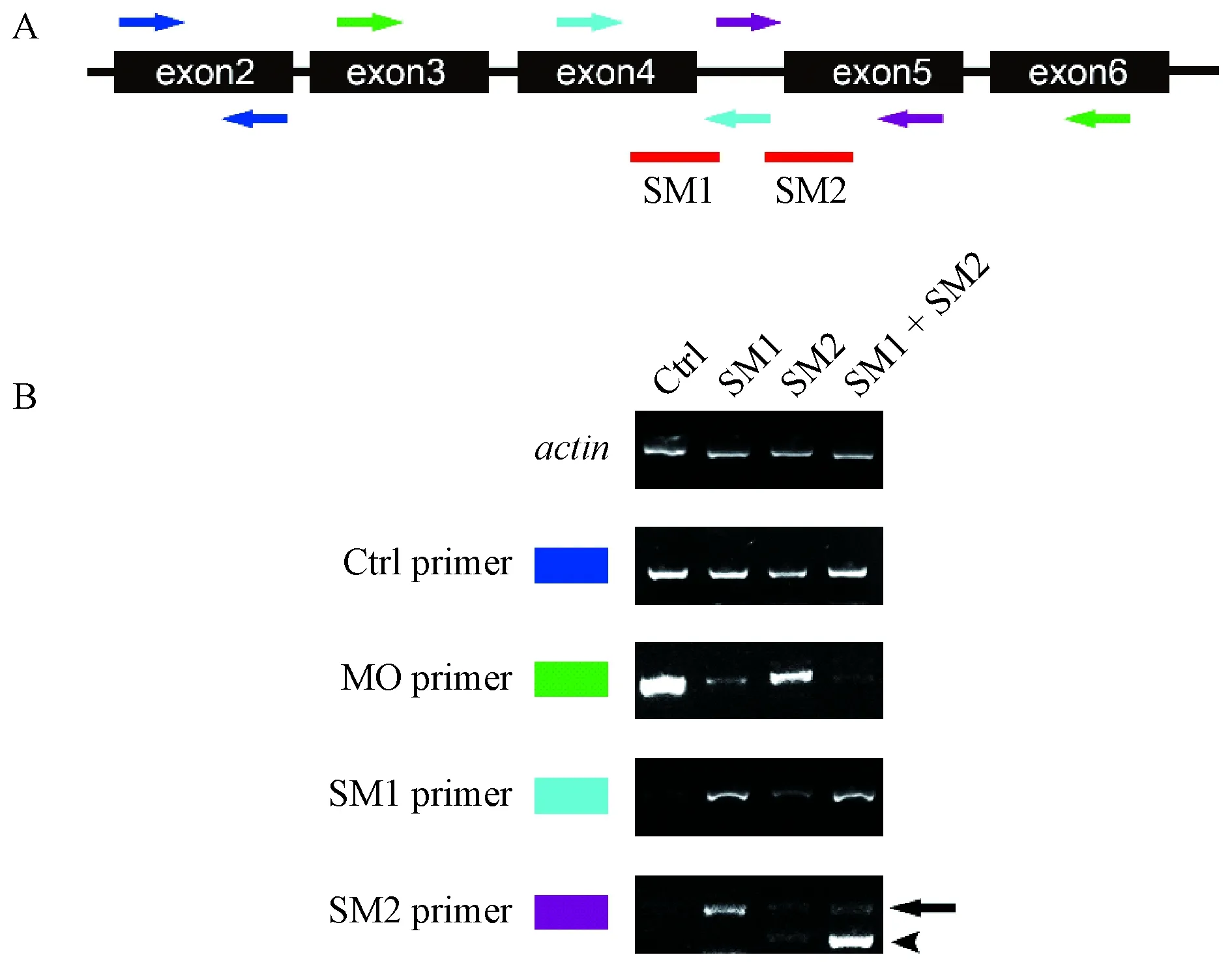
注:A. smad2 SM1/2有效性验证引物设计示意图。青色引物和紫色引物分别用于检测单独注射SM1和SM2的有效性,绿色引物用于检测SM1和SM2共同注射的有效性,蓝色引物作为阳性对照。红色短线标明SM1和SM2的结合位置。B. DNA电泳结果显示SM1/2对smad2 mRNA剪接正确性的影响。箭头表示目的条带,三角箭头表示新出现的剪接体。图1 smad2 SM1和SM2有效性检测Note. A. Schematic design of the smad2 SM1/2 primer validation. Cyan primers and purple primers were used to detect the effectiveness of SM1 and SM2 injection alone, green primers were used to detect the effectiveness of SM1 and SM2 injection together, and blue primers were used as positive control. The red short line indicated the combination position of SM1 and SM2. B. DNA electrophoresis results showed that SM1/2 affected the splicing accuracy of smad2 mRNA. The arrow represented the target band, and the triangular arrow showed the emerging splice.Figure 1 Validity detection of the smad2 SM1 and SM2
2.2 p53 MO不会影响神经嵴细胞的发育
由于注射MO可能会引起p53信号通路的激活,进而导致细胞凋亡等非特异性表型的出现[21]。并且之前的文献表明与p53 MO共同注射可以挽救smad3 MO引起的凋亡表型[12]。为此,我们注射p53 MO至单细胞受精卵中,通过原位杂交检测神经嵴细胞标记基因snail1b,sox10,foxd3及crestin的表达情况。结果显示,与野生型胚胎相比,注射p53 MO的胚胎snail1b,sox10,foxd3和crestin的表达量均无明显变化(图2),表明p53的敲低并不会影响神经嵴细胞的发育。因此,在接下来的研究中,为了避免非特异的调亡现象,我们注射smad2 MO以及smad3a/bMO的同时,均会与同浓度的p53 MO共注射。

注:6体节时期神经嵴细胞标记基因的原位杂交结果(bar=200 μm)。(下图同)图2 p53 MO不会影响神经嵴细胞的发育Note. In situ hybridization of marker genes of neural crest cells at 6-somite stage (bar=200 μm). (The same in the following figures)Figure 2 p53 MO does not affect the development of neural crest cells
2.3 敲低smad2/3对不同神经嵴细胞标记基因的影响
为了探究Smad2/3对神经嵴细胞发育的影响,我们分别将smad2 SM1、smad2 SM2、smad3aMO和smad3bMO注射到野生型斑马鱼单细胞期的受精卵中,待胚胎发育至6体节时通过原位杂交检测神经嵴细胞标记基因snail1b、sox10、foxd3和crestin的表达情况。原位杂交结果显示,smad2/3a被敲低后,crestin的表达量显著降低,snail1b、sox10和foxd3的表达量无明显变化;smad3b被敲低后,snail1b、sox10、foxd3和crestin的表达量均无明显变化(图3)。crestin是斑马鱼中特异标记所有神经嵴细胞的标志基因,其表达量的显著降低预示smad2/3a敲低使得神经嵴细胞发育异常。因此,在接下来的实验中,我们选择神经嵴细胞标记基因crestin作为研究对象探究Smad2/3a对神经嵴细胞发育的影响。

图3 敲低smad2/3a对不同神经嵴细胞标记基因的影响Figure 3 Effect of smad2/3 knockdown on the expression of marker genes in different neural crest cells
2.4 敲低smad2/3a会特异抑制crestin表达
为了探究Smad2和Smad3a对神经嵴细胞发育的影响,我们分别将smad2 SM1/SM2和smad3aMO注射到野生型斑马鱼单细胞期的受精卵中,待胚胎发育至6体节时检测crestin的表达情况。原位杂交结果表明smad2/3a敲低使crestin表达下降,与前面的结果保持一致(图4)。为了进一步确定Smad2和Smad3a对crestin的影响是否特异,本研究通过体外合成了casmad2 mRNA和smad3amRNA,分别在单细胞时期注入野生型胚胎,6体节时通过原位杂交检测crestin的表达情况。caSmad2是持续激活形式的Smad2,该突变体不含有MH1结构域,其位于羧基端的丝氨酸-甲硫氨酸-丝氨酸(SMS)基序被突变为天冬氨酸-甲硫氨酸-天冬氨酸(DMD)基序,以此来模拟Smad2被受体激活的磷酸化状态。之前的研究表明在斑马鱼中,过表达全长的smad2不会对胚胎造成任何影响,但过表达casmad2则导致严重的背部化和第二体轴的形成[17],表明caSmad2是Smad2的持续激活形式,可以更有效的激活下游信号传导。结果显示,注射了casmad2 mRNA和smad3amRNA后,crestin的表达量升高(图4)。敲低和过表达smad2/3a对crestin的表达产生相反的结果,由此我们推测Smad2/3a特异性地调控crestin的表达。
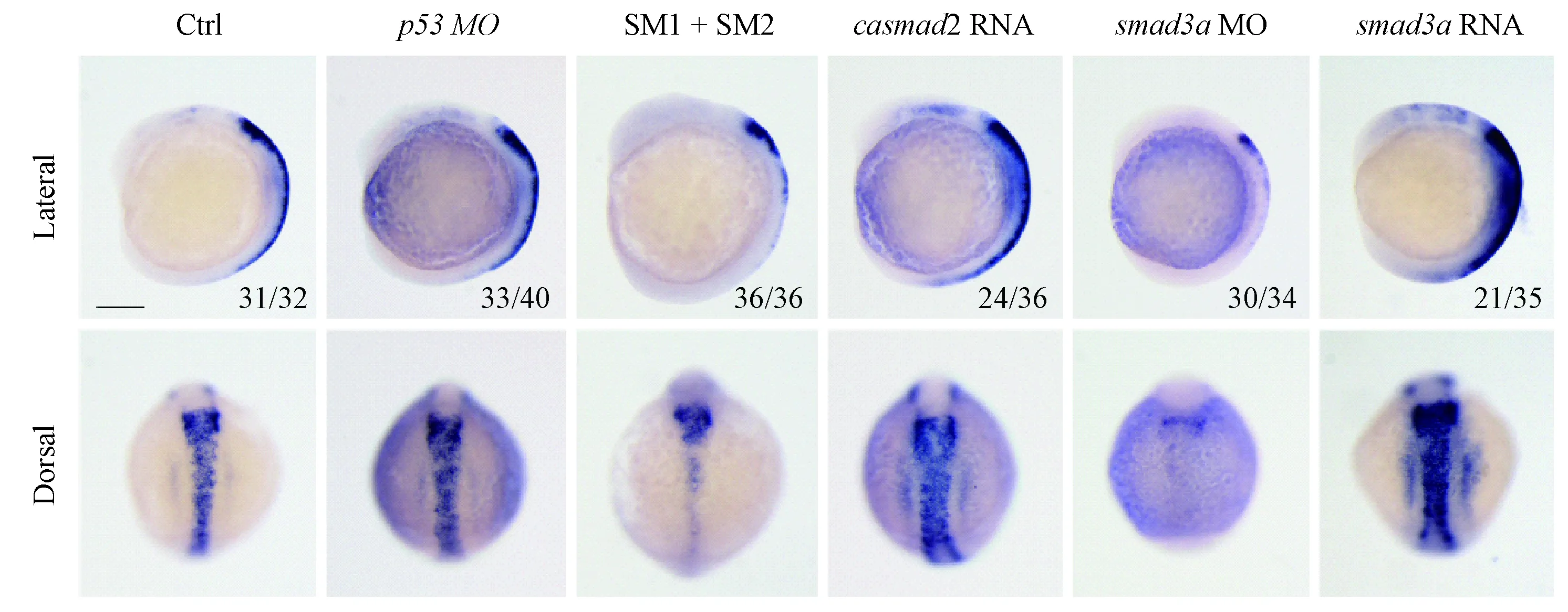
图4 smad2/3a特异性地调控crestin的表达Figure 4 smad2/3a specifically regulates the expression of crestin
2.5 过表达casmad2和smad3a可拯救smad2/3a敲降所导致crestin的低表达
为了确定crestin的低表达是由smad2及smad3a基因敲降直接造成的,我们分别将smad2 SM1/SM2和casmad2 mRNA及smad3aMO和smad3amRNA共注射到野生型斑马鱼单细胞期的受精卵中。待胚胎发育到6体节时,通过原位杂交检测crestin的表达是否被挽救。结果显示,与单独注射MO的胚胎相比,MO和mRNA共注射胚胎中crestin的表达量基本可以回归到野生型胚胎的水平(图5),进一步表明Smad2和Smad3a在神经嵴细胞的发育过程中特异性地调控crestin的表达。
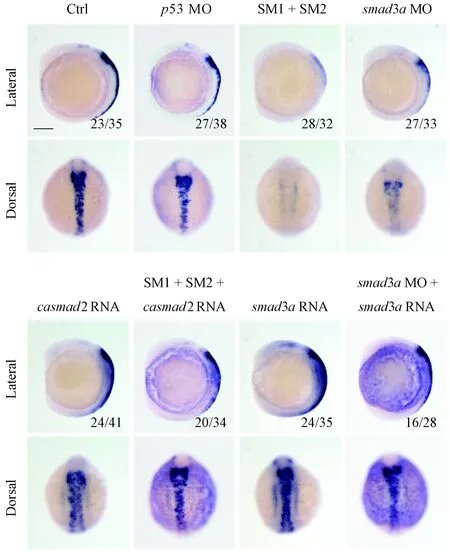
图5 过表达casmad2和smad3a可拯救smad2/3a敲降所导致crestin的低表达Figure 5 Overexpression of casmad2 and smad3a rescues the down-regulation of crestin caused by smad2/3a MO injection
3 讨论
神经嵴起源于神经板的边界,其诱导发生、分化和迁移受到一系列转录因子的调控,如Snail,Sox9,Sox10,Foxd3等[16]。Foxd3在维持神经嵴细胞祖细胞未分化状态发挥了重要作用,foxd3突变体胚胎存在严重的颅面畸形、色素较少的表型,其缺失导致sox10,sox9b,snail1b和crestin的表达均下调[22]。Sox9b对颅骨神经嵴细胞迁移过程有影响,缺失sox9b导致胚胎仅有较少的软骨细胞,而且sox9b的表达减少或增加都会影响sox10,snail1b,foxd3和crestin的正常表达[23]。Sox10在躯干和迷走神经嵴细胞分化迁移过程中有一定的作用,缺失sox10的突变体胚胎缺乏色素,神经嵴细胞在迁移过程中凋亡[24]。Snail1b表达量的增加或减少导致神经嵴区域增加或神经嵴细胞分化迁移受阻,同时snail1b可直接调控神经嵴细胞的上皮间充质转换过程,进而影响神经嵴细胞的发育[25]。本研究结果显示敲低smad2/3a后,6体节时期胚胎中foxd3,snail1b和sox10的表达量变化并不明显,可能是因为Smad2/3a对于这些转录因子并没有直接调控作用,或者是需要其他信号通路的协同作用,单一信号通路的抑制并不会使这些转录因子的表达受到明显影响。而crestin有可能可以受到smad2/3a的直接调控。当然,要更进一步探究Smad2/3a对神经嵴细胞发育的影响,如对色素细胞、软骨细胞等形成的调控,我们需收集10~12体节甚至更晚时期smad2/3a敲低、甚至是相应基因敲除的胚胎,检测上述神经嵴细胞标记基因及下游分化细胞标记基因的表达,确定Smad2/3a在神经嵴细胞发育中的功能。
smad2/3a的表达被敲低后,crestin的表达显著降低,而且这种低表达可以被smad2/3a的过表达所挽救,意味着smad2/3a调控crestin的表达是特异地,为此我们通过生物信息学手段分析了crestin的启动子序列,发现crestin启动子序列中存在着Smad2/3a的潜在结合区,说明Smad2/3a可能通过与crestin启动子直接相互作用,从而调控crestin的表达,这种相互作用需要进一步的ChIP实验来验证。此外,之前的研究结果表明在crestin的启动子区域存在包含sox10在内的多个转录因子结合位点,突变sox10结合位点导致转基因鱼Tg(crestin:EGFP) 的绿色荧光表达显著降低,说明crestin受到sox10等多种神经嵴转录因子的调控[26]。经过分析,我们确实发现在crestin启动子区还存在Sox家族蛋白的潜在结合位点,说明Sox可能作为上游调控因子参与调控crestin的表达。在爪蟾中,Smad3与含有高迁移率(HMG)结构域的淋巴增强剂结合因子1/T细胞特异性因子(LEF1/TCF)存在物理相互作用[27],而Sox9是含有HMG域的转录因子,提示Smad3a可能与Sox9b存在相互作用,共同调控crestin的表达,但这需要通过免疫共沉淀实验来证明。
斑马鱼胚胎神经嵴细胞的发育受一系列信号通路和转录因子的调控,其中任何一因子功能的缺失都会导致胚胎发育异常。本研究首次证实Smad2/3a对神经嵴细胞特异性标记基因crestin的表达有调控作用,这为后续进一步研究Smad2/3a或其介导的TGF-β信号通路在神经嵴细胞发育过程中的功能奠定了基础。
